
第三章酸碱解离平衡和沉淀溶解平衡 本章知识点与考核要求 ·酸碱平衡 。 缓冲溶液 沉淀溶解平衡
第三章酸碱解离平衡和沉淀溶解平衡 本章知识点与考核要求 • 酸碱平衡 • 缓冲溶液 • 沉淀溶解平衡

第一节酸碱理论 传统的酸碱理论(Arrlennius) 质子酸碱理论(J.N.Bronsted) 电子酸碱理论(Lewis.)
第一节 酸碱理论 传统的酸碱理论(Arrlennius) 质子酸碱理论(J.N.Bronsted) 电子酸碱理论(Lewis)

一、酸碱质子理论 酸、碱:凡是能给出质子的叫酸 (如HCl、CH3COOH);凡是能 接受质子叫碱(如OH、NH3等) 例如: HCL、HAc、NH4+等能给出结构 中的质子,所以都是酸。 NH3、Ac一、OH等可以接受外来 的质子,则为碱
例如: HCl、HAc、NH4 +等能给出结构 中的质子,所以都是酸。 NH3、Ac一、OH-等可以接受外来 的质子,则为碱 。 一、酸碱质子理论 酸、碱:凡是能给出质子的叫酸 (如HCl、CH3COOH) ;凡是能 接受质子叫碱(如OH-、NH3等)

1.酸碱的共轭关系 ■酸和碱不是孤立存在的。 酸给出质子H+,碱接受H+。酸是H 0及 的给予体,酸给出H+后剩下的部分 就是碱,碱是H的接受体,碱接受 质子后即成为酸。 酸一质子+碱
1.酸碱的共轭关系 酸和碱不是孤立存在的。 酸给出质子H+,碱接受H+ 。酸是H+ 的给予体,酸给出H+后剩下的部分 就是碱 ,碱是H+的接受体,碱接受 质子后即成为酸。 酸 质子+碱

若以HA代表酸,A代表碱 ,酸和碱 之间的关系,可用下式表示: HA :H++A- 表明:酸给出H+后转变为碱,碱接受 H+后变为酸。 从上式可知HA和A有互为依存、 相互转化的关系,称为酸碱的共轭 关系
若以HA代表酸,A-代表碱,酸和碱 之间的关系,可用下式表示: HA H++A- 表明:酸给出H+后转变为碱,碱接受 H+后变为酸。 从上式可知HA和A-有互为依存、 相互转化的关系,称为酸碱的共轭 关系
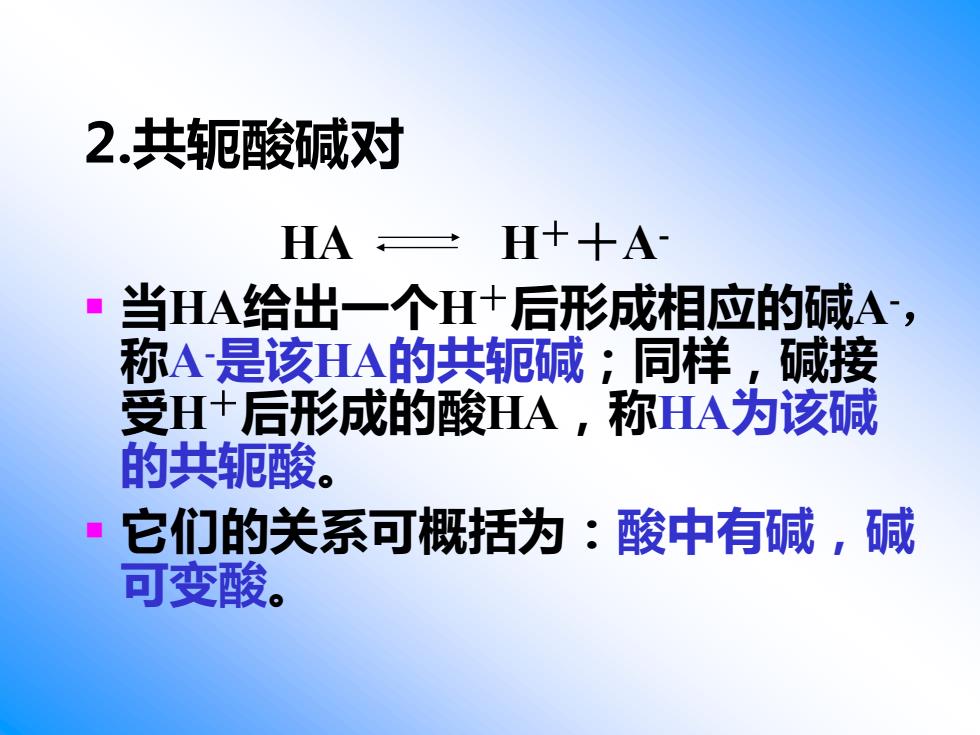
2.共轭酸碱对 HA三H+十A ■当HA给出一个H+后形成相应的碱A, 称A是该HA的共轭碱;同样,碱接 受H+后形成的酸HA,称HA为该碱 的共轭酸。 ·它们的关系可概括为:酸中有碱,碱 可变酸
2.共轭酸碱对 HA H++A- ▪ 当HA给出一个H+后形成相应的碱A-, 称A-是该HA的共轭碱;同样,碱接 受H+后形成的酸HA,称HA为该碱 的共轭酸。 ▪ 它们的关系可概括为:酸中有碱,碱 可变酸

■HA一A互相依存转化。 酸HA比它的共轭碱多一个H+,共 轭酸碱对之间只相差一个H+。 ·这种在组成上仅相差一个H+的一对 酸碱称为共轭碱酸对。 如:NH4+-NH3 HAc·Ac
▪ HA-A-互相依存转化。 ▪ 酸HA比它的共轭碱多一个H+,共 轭酸碱对之间只相差一个H+ 。 ▪ 这种在组成上仅相差一个H+的一对 酸碱称为共轭碱酸对。 如:NH4 +-NH3 HAc -Ac-

例:H2C03的共轭碱是C032-对吗? 解:共轭酸碱对之间只相差一个H+ H2C03=H++HC03 HC03°=H++C032- H2CO3失去H+转化为HCO3°, 失去2H+才形成C032·,所以H2C03 的共轭碱是HC03°,而不是C032
解:共轭酸碱对之间只相差一个H+ H2CO3 H+ +HCO3 - HCO3 - H++CO3 2- H2CO3失去H+转化为HCO3 - , 失去2 H+才形成CO3 2-,所以H2CO3 的共轭碱是HCO3 - ,而不是CO3 2- 。 例:H2CO3的共轭碱是CO3 2-对吗?

3.酸碱的物质形式 (1)酸、碱可以是分子,如HAc、NH3 称为分子酸、分子碱;也可以是离子, 如 NH4+、Ac·,称为离子酸、离子碱。 (2)有些物质既能给出质子,也能接受质子, 它们被称为两性物质。 如:H20、HC03一、HPO42-、HS
3.酸碱的物质形式 (1)酸、碱可以是分子,如HAc、NH3 称为分子酸、分子碱;也可以是离子, 如 NH4 + 、Ac-,称为离子酸、离子碱。 (2)有些物质既能给出质子,也能接受质 子, 它们被称为两性物质。 如: H2O、HCO3 一、HPO4 2一、HS一

又如:HS-=H++S2- HS-+H+=H,S HS-既是S2-的共轭酸,又是H,S 的共轭碱
又如:HS-=H++S 2- HS-+H+=H2S HS-既是S 2-的共轭酸,又是H2S 的共轭碱