
固体结构 陈红余 2009.11.28
固体结构 ◼ 陈红余 ◼ 2009.11.28

主要内容 晶体的特征及晶格理论 金属晶体 三、 离子晶体 四、原子晶体 五、分子晶体 六、 离子极化
主要内容 ◼ 一、 晶体的特征及晶格理论 ◼ 二、 金属晶体 ◼ 三、 离子晶体 ◼ 四、 原子晶体 ◼ 五、 分子晶体 ◼ 六、 离子极化

晶体的特征及晶格理论 1.晶体结构的特征 晶体(crystal):内部微粒(原子、分子或离子) 在空间按一定规律周期性紧密排列构成的固体。 非晶体(amorphous solid):内部微粒在空间 作无规则排列构成的固体
晶体(crystal):内部微粒(原子、分子或离子) 在空间按一定规律周期性紧密排列构成的固体。 1.晶体结构的特征 一、 晶体的特征及晶格理论 非晶体(amorphous solid):内部微粒在空间 作无规则排列构成的固体

晶体 非晶体
晶体 非晶体

晶体与非晶体的区别 晶体 非晶体 规则几何外形 无定形 确定的熔点 无确定的熔点 各向异性 各向同性 对X射线的衍射效应 无 对称性 无
晶 体 非 晶 体 规则几何外形 无定形 确定的熔点 各向异性 各向同性 无确定的熔点 对X射线的衍射效应 无 对称性 无 晶体与非晶体的区别
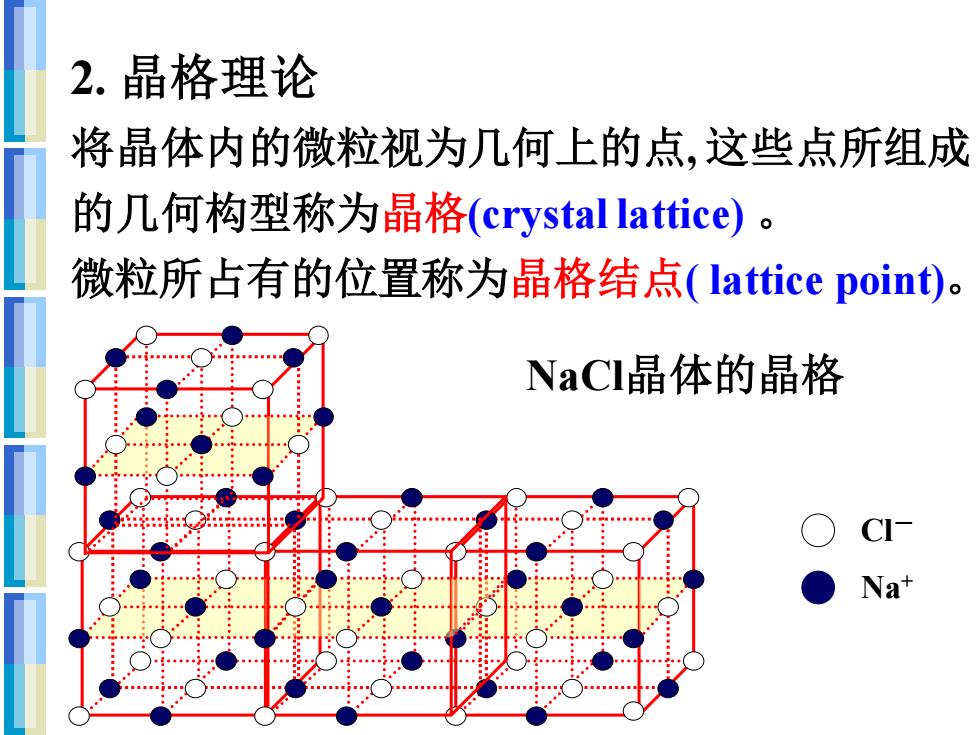
2.晶格理论 将晶体内的微粒视为几何上的点,这些点所组成 的几何构型称为晶格(crystal lattice)。 微粒所占有的位置称为晶格结点(lattice point). NaCI晶体的晶格 CI Na+
将晶体内的微粒视为几何上的点, 这些点所组成 的几何构型称为晶格(crystal lattice) 。 微粒所占有的位置称为晶格结点( lattice point)。 2. 晶格理论 NaCl晶体的晶格 Na+ Cl-
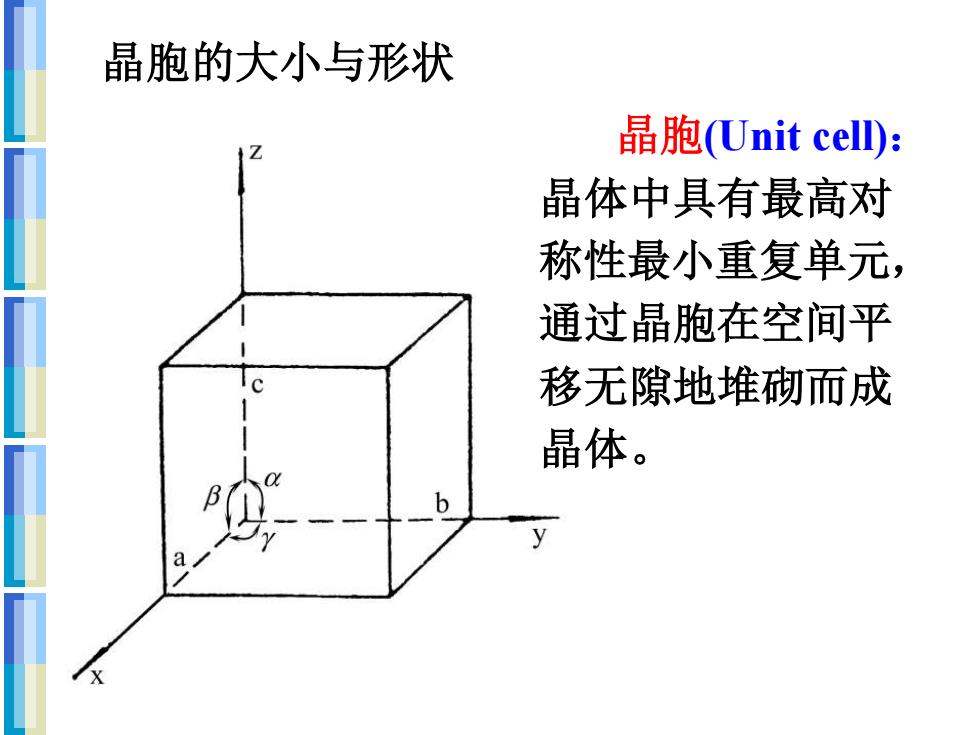
晶胞的大小与形状 晶胞(Unit cell)山: 晶体中具有最高对 称性最小重复单元, 通过晶胞在空间平 移无隙地堆砌而成 晶体
晶胞的大小与形状 晶胞(Unit cell): 晶体中具有最高对 称性最小重复单元, 通过晶胞在空间平 移无隙地堆砌而成 晶体
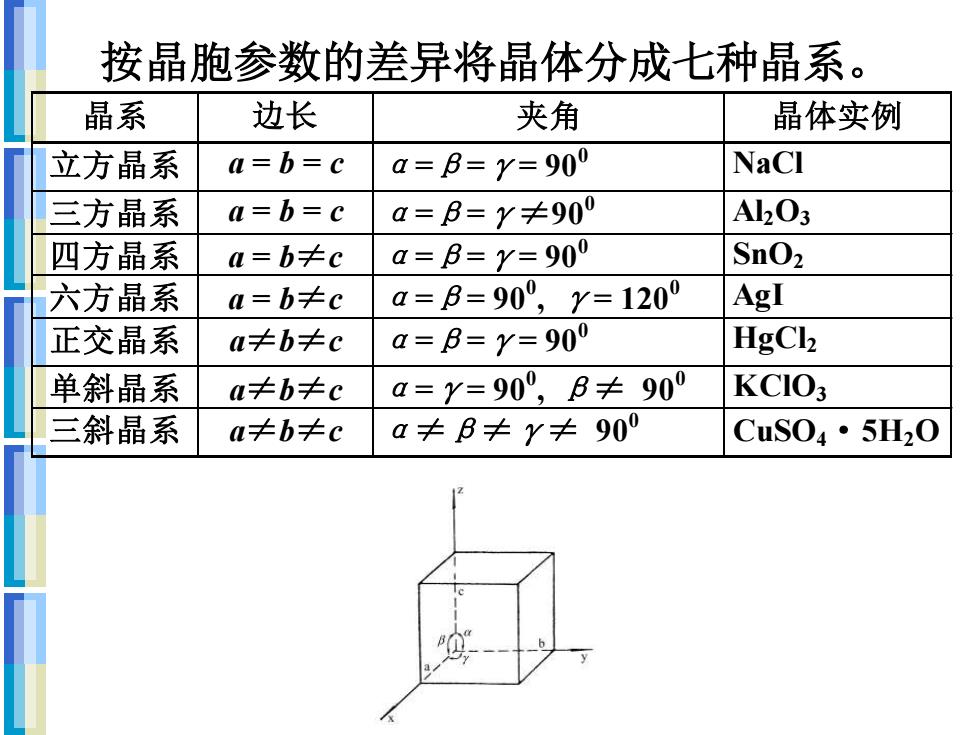
按晶胞参数的差异将晶体分成七种晶系。 晶系 边长 夹角 晶体实例 立方晶系 a=b=c a=B=Y=900 NaCl 三方晶系 a=b=c a=B=y≠90° A203 四方晶系 a=b≠c a=B=Y=900 SnO2 六方晶系 a=b≠c a=B=90°,Y=1200 AgI 正交晶系 a≠b≠c a=B=Y=900 HgCl 单斜晶系 a≠b≠c a=y=90°,B≠90 KCIO3 三斜晶系 a≠b≠c a≠B≠Y≠90 CuS04·5H20
按晶胞参数的差异将晶体分成七种晶系。 晶 系 边 长 夹 角 晶体实例 立方晶系 a = b = c α=β=γ= 9 00 NaCl 三方晶系 a = b = c α=β=γ≠9 00 Al2O3 四方晶系 a = b≠c α=β=γ= 9 00 SnO2 六方晶系 a = b≠c α=β= 9 00 , γ= 1200 AgI 正交晶系 a≠b≠c α=β=γ= 9 00 HgCl2 单斜晶系 a≠b≠c α=γ= 9 00 , β≠ 900 KClO3 三斜晶系 a≠b≠c α≠β≠γ≠ 900 CuSO4·5 H2O
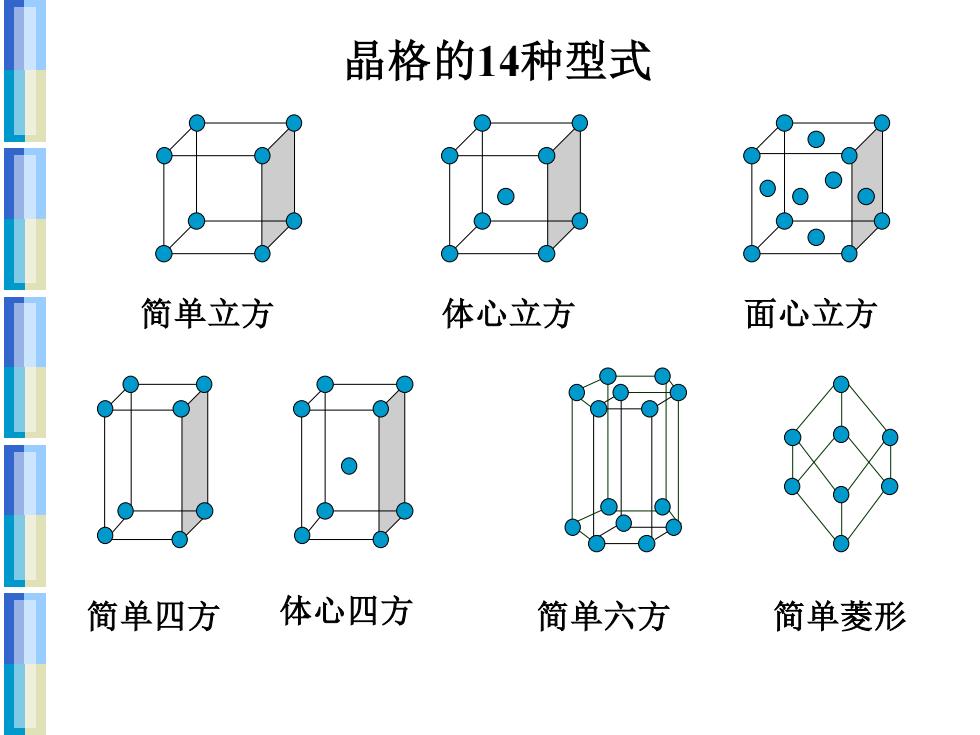
晶格的14种型式 简单立方 体心立方 面心立方 简单四方 体心四方 简单六方 简单菱形
晶格的14种型式 简单立方 体心立方 面心立方 简单四方 体心四方 简单六方 简单菱形
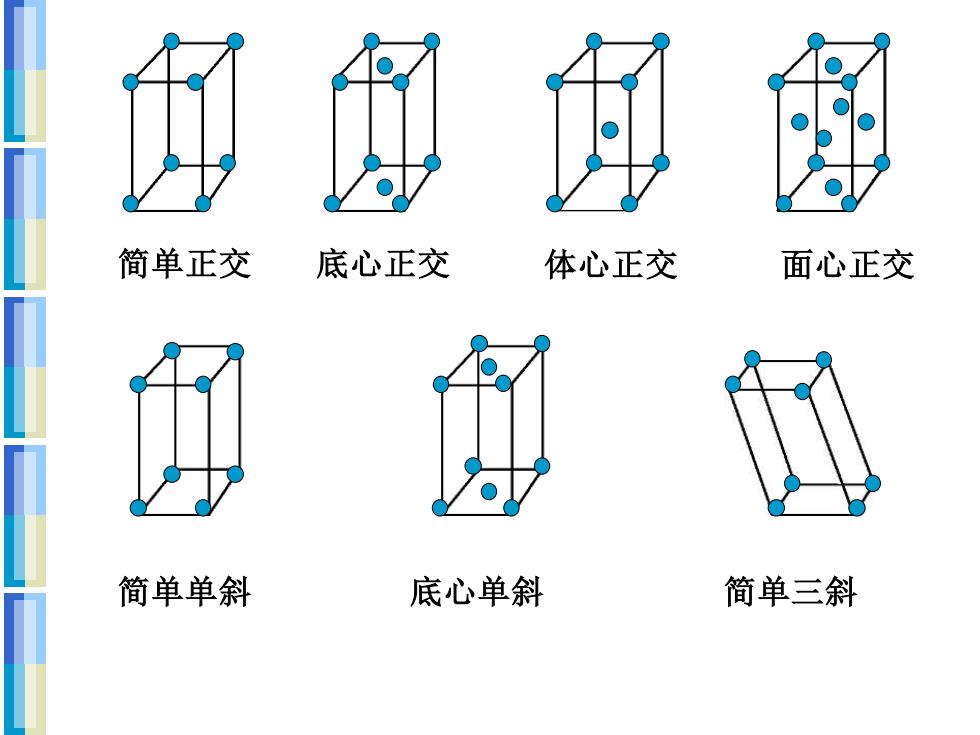
简单正交 底心正交 体心正交 面心正交 简单单斜 底心单斜 简单三斜
简单正交 底心正交 体心正交 面心正交 简单单斜 底心单斜 简单三斜