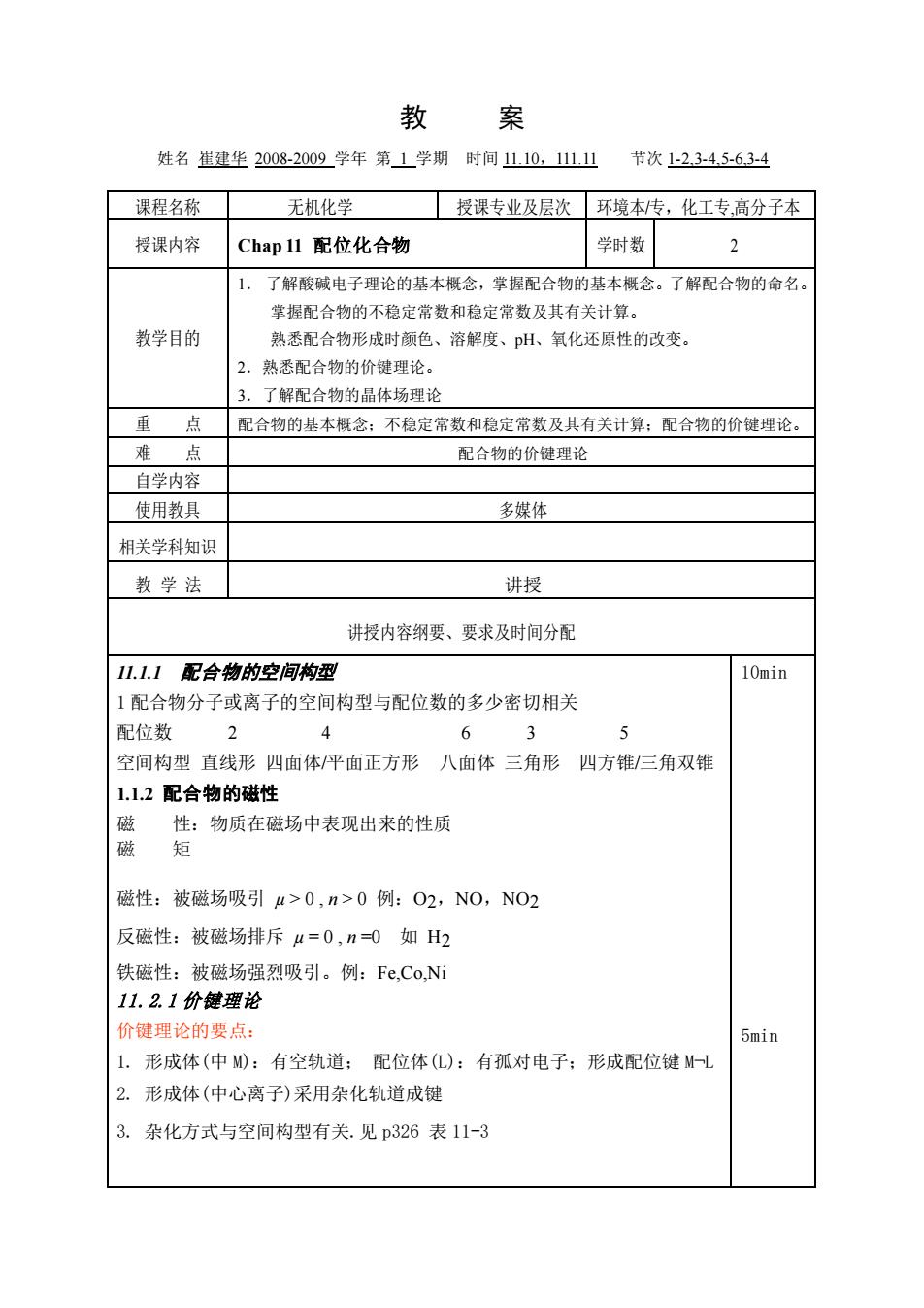
教 案 姓名崔建坐2008-2009学年第1学期时间1110,111.1山 节次1-23-4.5-6.3-4 课程名称 无机化学 授课专业及层次 环境本传,化工专高分子本 授课内容 Chap 11配位化合物 学时数 2 1. 了解酸碱电子理论的基本概念,掌握配合物的基本概念。了解配合物的命名。 掌握配合物的不稳定常数和稳定常数及其有关计算。 教学目的 熟悉配合物形成时颜色、溶解度、pH、氧化还原性的改变。 2. 熟悉配合物的价键理论。 3.了解配合物的晶体场理论 重点配合物的基本概念:不稳定常数和稳定常数及其有关计算:配合物的价键理论。 难点 配合物的价键理论 自学内容 使用教具 多媒体 相关学科知识 教学法 讲授 讲授内容纲要、要求及时间分配 11.1.1配合物的空间构型 10min 1配合物分子或离子的空间构型与配位数的多少密切相关 配位数 2 6 3 5 空间构型直线形四面体平面正方形八面体三角形四方锥/三角双锥 1.12配合物的磁性 磁性:物质在磁场中表现出来的性质 矩 磁性:被磁场吸引4>0,n>0例:O2,NO,NO2 反磁性:被磁场排斥μ=0,n=0如H2 铁磁性:被磁场强烈吸引。例:Fe,Co,Ni 11.2.1价键理论 价键理论的要点: 5min 1.形成体(中M0:有空轨道:配位体(L):有孤对电子:形成配位键M一 2.形成体(中心离子)采用杂化轨道成键 3.杂化方式与空间构型有关.见p326表11-3
教 案 姓名 崔建华 2008-2009 学年 第 1 学期 时间 11.10,111.11 节次 1-2,3-4,5-6,3-4 课程名称 无机化学 授课专业及层次 环境本/专,化工专,高分子本 授课内容 Chap 11 配位化合物 学时数 2 教学目的 1. 了解酸碱电子理论的基本概念,掌握配合物的基本概念。了解配合物的命名。 掌握配合物的不稳定常数和稳定常数及其有关计算。 熟悉配合物形成时颜色、溶解度、pH、氧化还原性的改变。 2.熟悉配合物的价键理论。 3.了解配合物的晶体场理论 重 点 配合物的基本概念;不稳定常数和稳定常数及其有关计算;配合物的价键理论。 难 点 配合物的价键理论 自学内容 使用教具 多媒体 相关学科知识 教 学 法 讲授 讲授内容纲要、要求及时间分配 11.1.1 配合物的空间构型 1 配合物分子或离子的空间构型与配位数的多少密切相关 配位数 2 4 6 3 5 空间构型 直线形 四面体/平面正方形 八面体 三角形 四方锥/三角双锥 1.1.2 配合物的磁性 磁 性:物质在磁场中表现出来的性质 磁 矩 磁性:被磁场吸引 µ > 0 , n > 0 例:O2,NO,NO2 反磁性:被磁场排斥 µ = 0 , n =0 如 H2 铁磁性:被磁场强烈吸引。例:Fe,Co,Ni 11.2.1 价键理论 价键理论的要点: 1. 形成体(中 M):有空轨道; 配位体(L):有孤对电子;形成配位键 M¬L 2. 形成体(中心离子)采用杂化轨道成键 3. 杂化方式与空间构型有关.见 p326 表 11-3 10min 5min

讲授内容纲要、要求及时间分配(附页) 1.配位数为2的配合物[AgNH32十的空间构型为直线形,μ=O。Sp杂化 25min 2.配位数为4的配合物BeX42-的空间构型为四面体:sp3杂化 Ni(CN4]2-的空间构型为平面正方形,u=0:dsp2杂化 3.配位数为6的配合物 绝大多数是八面体构型,形成体可能采取d2sp3或sp32杂化轨道成键。 Fe(CN613-,=2.4B.M d2sp3 内轨配键。以内轨配键形成的配合物叫内轨形配合物。 [FeF63-,H=5.90B.M sp3d2 外轨配键。以外轨配键形成的配合物叫外轨形配合物。 对价键理论的评价: 10min 小结: 11.22晶体场理论 晶体场理论要点: 1.八面体型的配合物例如:mH206]3 Ti3+:3dl 15min a.八面体场中d轨道能级分裂: & 00000 00000 15min b.影响D。的因素(中心离子,配位体,晶体场) ①中心M离子:电荷Z增大,Do增大:主量子数n增大, Do增大。 ②配位体的影响光谱化学序列③晶体场类型的影响 2.八面体场中心离子的d电子分布排布原则: 15min ①能量最低原理 ②Hund规则 ③Pauli不相容原理 电子成对能(:两个电子进入同一轨道时需要消耗的能量。 强场:Do>P弱场:Do〈P 小结答疑: 练习:习题2.5.8,10 5min
讲授内容纲要、要求及时间分配(附页) 1.配位数为 2 的配合物 [Ag(NH3)2]+的空间构型为直线形,μ=0。 Sp 杂化 2. 配位数为 4 的配合物 [BeX4]2-的空间构型为四面体:sp3 杂化 [Ni(CN)4]2-的空间构型为平面正方形,μ=0:dsp2 杂化 3.配位数为 6 的配合物 绝大多数是八面体构型,形成体可能采取 d2sp3 或 sp3d2 杂化轨道成键。 [Fe(CN)6]3- ,μ=2.4B.M. d2sp3 内轨配键。以内轨配键形成的配合物叫内轨形配合物。 [FeF6]3- ,μ=5.90B.M. sp3d2 外轨配键。以外轨配键形成的配合物叫外轨形配合物。 对价键理论的评价: 小结: 11.2.2 晶体场理论 晶体场理论要点: 1.八面体型的配合物例如:[Ti(H2O)6]3+ Ti 3+ :3d1 a.八面体场中 d 轨道能级分裂: b. 影响 Do 的因素(中心离子,配位体,晶体场) ①中心 M 离子:电荷 Z 增大, Do 增大;主量子数 n 增大, Do 增大。 ②配位体的影响:光谱化学序列③晶体场类型的影响 2.八面体场中心离子的 d 电子分布排布原则: ①能量最低原理 ②Hund 规则 ③Pauli 不相容原理 电子成对能(P):两个电子进入同一轨道时需要消耗的能量。 强场:Do > P 弱场:Do < P 小结答疑: 练习:习题 2,5,8,10 25min 10min 15min 15min 15min 5min dz2 dx 2-y 2 dxydxz dyz Δ 3 2 5 Δ 5 Δ =6 =10 = 4 Dq Dq Dq eg t2g o o o