
教案 姓名崔建坐2009~2010学年第1学期时间10.9,1011节次13.5-7.1351
教 案 姓名崔建华 2009~2010 学年 第 1 学期 时间 10.9,10.11 节次 1-3.5-7.1-3.5-7
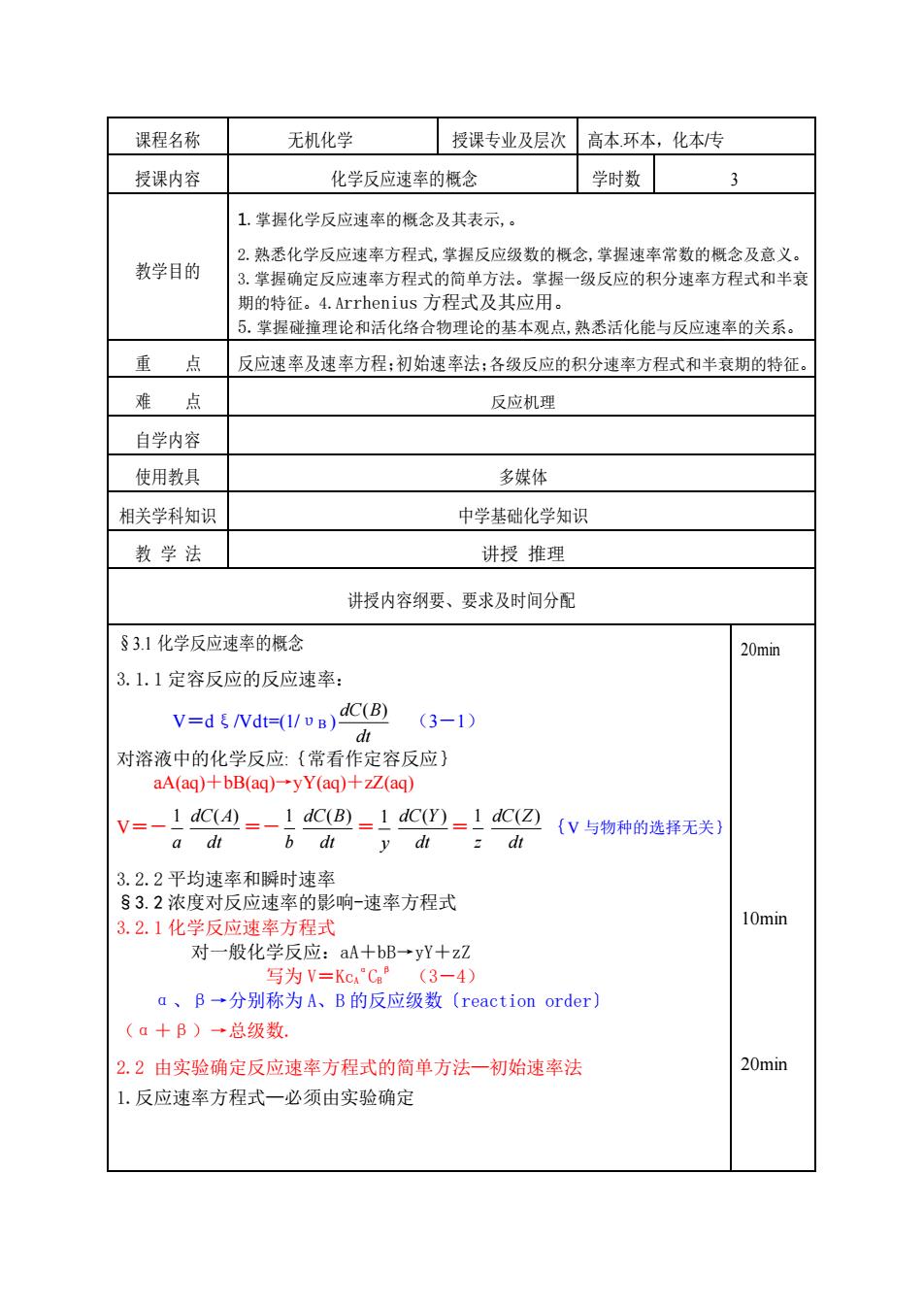
课程名称 无机化学 授课专业及层次高本环本,化本传 授课内容 化学反应速率的概念 学时数 3 1.掌握化学反应速率的概念及其表示,。 2熟悉化学反应速率方程式,掌握反应级数的概念,掌握速率常数的概念及意义。 教学目的 3,掌握确定反应速率方程式的简单方法。掌握一级反应的积分速率方程式和半衰 期的特征。4.Arrhenius方程式及其应用。 5.掌握碰撞理论和活化络合物理论的基本观点,熟悉活化能与反应速率的关系。 重点 反应速率及速率方程:初始速率法:各级反应的积分速率方程式和半衰期的特征。 难点 反应机理 自学内容 使用教具 多媒体 相关学科知识 中学基础化学知识 教学法 讲授推理 讲授内容纲要、要求及时间分配 §3.1化学反应速率的概念 20min 3.1.1定容反应的反应速率: V=d/dt-(/)C(B) (3-1) 对溶液中的化学反应:(常看作定容反应) aA(aq)+bB(aq)-yY(aq)+zZ(aq) v=-1CL=-dC(=1C=C(与物种的选择无关) a dt b dr y dt 3.2.2平均速率和瞬时速率 §3.2浓度对反应速率的影响-速率方程式 3.2.1化学反应速率方程式 10min 对一般化学反应:aA+bB→yY+zZ 写为V=KcC”(3-4) a、B→分别称为A、B的反应级数(reaction order) (a十B)·总级数. 2.2由实验确定反应速率方程式的简单方法一初始速率法 20min 1.反应速率方程式一必须由实验确定
课程名称 无机化学 授课专业及层次 高本.环本,化本/专 授课内容 化学反应速率的概念 学时数 3 教学目的 1.掌握化学反应速率的概念及其表示,。 2.熟悉化学反应速率方程式,掌握反应级数的概念,掌握速率常数的概念及意义。 3.掌握确定反应速率方程式的简单方法。掌握一级反应的积分速率方程式和半衰 期的特征。4.Arrhenius 方程式及其应用。 5.掌握碰撞理论和活化络合物理论的基本观点,熟悉活化能与反应速率的关系。 重 点 反应速率及速率方程;初始速率法;各级反应的积分速率方程式和半衰期的特征。 难 点 反应机理 自学内容 使用教具 多媒体 相关学科知识 中学基础化学知识 教 学 法 讲授 推理 讲授内容纲要、要求及时间分配 §3.1 化学反应速率的概念 3.1.1 定容反应的反应速率: V=dξ/Vdt=(1/υB ) dt dC(B) (3-1) 对溶液中的化学反应:{常看作定容反应} aA(aq)+bB(aq)→yY(aq)+zZ(aq) V=- a 1 dt dC(A) =- b 1 dt dC(B) = y 1 dt dC(Y ) = z 1 dt dC(Z) {V 与物种的选择无关} 3.2.2 平均速率和瞬时速率 §3.2 浓度对反应速率的影响-速率方程式 3.2.1 化学反应速率方程式 对一般化学反应:aA+bB→yY+zZ 写为 V=KcA α CB β (3-4) α、β→分别称为 A、B 的反应级数〔reaction order〕 (α+β)→总级数. 2.2 由实验确定反应速率方程式的简单方法—初始速率法 1.反应速率方程式—必须由实验确定 20min 10min 20min

讲授内容纲要、要求及时间分配(附页) 3.2.3浓度与时间的定量关系 20min 1.一级反应 速率方程式为:V=kCa 定积分:1n{C(A)/C(A)}=-Kt(3-6a) 或1nC,(A=-kt+1n/C(A)(3-6b) 半衰期(佣T片表示) 与初始浓度无关,这是一级反应的重要特征之一。 3.3.1 Arrhenius方程式 1889年瑞典化学家S.A.Arrhenius 20min 提出了速率系数与温度关系的方程式 k=koexp(-Ea/RT) 或k=k。e(-E./RT)(3-9a) 对数形式为: n {k)=1n (ko}-E./RT (3-9b) 微分形式: dh&=E,/RT2(3-9c】 dT §3.4化学反应速率理论和反应机理简介 1.碰撞理论 2活化络合物理论 15m 3.4.3活化能与反应速率 20min 1活化能的两种定义 2.浓度对反应速率的影响: 增大浓度等于增大了活化分子总数 3.温度的影响: 升高温度等于增大了活化分子分数 §3.5催化剂及催化作用 3.5.1催化剂和催化作用的基本特征 10min 课堂小结: 作业:P.68习题5,8,16,19 5min
讲授内容纲要、要求及时间分配(附页) 3.2.3 浓度与时间的定量关系 1.一级反应 速率方程式为:V=kCA 定积分:ln{Ct(A)/C0(A)}=-Kt(3-6a) 或 ln Ct(A)=-kt+ln/C0(A)〔3-6b〕 半衰期(用 T 2 1 表示) T 2 1 = k 0.693 与初始浓度无关,这是一级反应的重要特征之一。 3.3.1 Arrhenius 方程式 1889 年瑞典化学家 S.A.Arrhenius 提出了速率系数与温度关系的方程式: k=k0exp(-Ea/RT) , 或 k=k0 e(-Ea/RT) (3-9a) 对数形式为: n{k}=ln{k0}-Ea/RT 〔3-9b〕 微分形式: dT d ln{k} =Ea/RT2 〔3-9c〕 §3.4 化学反应速率理论和反应机理简介 1.碰撞理论 2 活化络合物理论 3.4. 3 活化能与反应速率 1 活化能的两种定义 2.浓度对反应速率的影响: 增大浓度等于增大了活化分子总数 3.温度的影响: 升高温度等于增大了活化分子分数 §3.5 催化剂及催化作用 3.5.1 催化剂和催化作用的基本特征 课堂小结: 作业:P.68 习题 5,8,16,19 20min 20min 10min 15min 20min 10min 5min