
第九单元检测 一、选择题(每题3分,共30分) 1.将少量下列物质分别放入水中,充分搅拌,不能形成溶液的是( A.蔗糖 B.牛奶 C.酒精 D.白醋 2.用下列物质清洗油污时,发生乳化现象的是( A.汽油 B.氢氧化钠溶液 C.加洗涤剂的水D.热水 3.下列关于溶液的说法中正确的是( )o A.溶液一定是无色、透明的混合物 B.溶液的体积等于溶质和溶剂的体积之和 C物质溶于水时,溶液温度一定不变 D.溶液中各部分的浓度一致 4.除质量分数以外,人们有时也用体积分数来表示溶液的浓度。例如:52%的饮用 白酒就是指每100体积的饮用白酒中含有52体积的乙醇。下列溶液的浓度属于 用体积分数来表示的是()。 A.0.9%的生理盐水 B.5%的葡萄糖注射液 C.10%的氢氧化钠溶液 D.75%的医用酒精 5.用50g质量分数为6%的氢氧化钠溶液配制成质量分数为3%的氢氧化钠溶液, 需加水的质量为( ) A.50g B.100g C.47g D.25g 6.在30℃时,50g水中最多溶解A物质5g,而在60℃时,20g水中最多能溶解 B物质10g,则()。 A.A的溶解度比B的大 BB的溶解度比A的大 C.二者的溶解度相等 D.无法比较 7.某实验室用氯化钠固体配制100g溶质质量分数为8%的氯化钠溶液,下列说法 中错误的是()。 A.实验步骤为计算、称量、量取、溶解 B.量取水时,用规格为100mL的量筒 C,若用量筒量取水时俯视凹液面的最低处,则配制溶液的溶质质量分数小于8% D溶解过程中,玻璃棒搅拌的作用是加快氯化钠的溶解 8.某同学在工具书中查到NaOH在水和酒精中的溶解度,如下表所列。通过分析, 他得出以下结论,其中不正确的是( )e 溶剂 20℃ 40℃ 水 109g 129g 酒精 17.3g 40g
第九单元检测 一、选择题(每题 3 分,共 30 分) 1.将少量下列物质分别放入水中,充分搅拌,不能形成溶液的是( )。 A.蔗糖 B.牛奶 C.酒精 D.白醋 2.用下列物质清洗油污时,发生乳化现象的是( )。 A.汽油 B.氢氧化钠溶液 C.加洗涤剂的水 D.热水 3.下列关于溶液的说法中正确的是( )。 A.溶液一定是无色、透明的混合物 B.溶液的体积等于溶质和溶剂的体积之和 C.物质溶于水时,溶液温度一定不变 D.溶液中各部分的浓度一致 4.除质量分数以外,人们有时也用体积分数来表示溶液的浓度。例如:52%的饮用 白酒就是指每 100 体积的饮用白酒中含有 52 体积的乙醇。下列溶液的浓度属于 用体积分数来表示的是( )。 A.0.9%的生理盐水 B.5%的葡萄糖注射液 C.10%的氢氧化钠溶液 D.75%的医用酒精 5.用 50 g 质量分数为 6%的氢氧化钠溶液配制成质量分数为 3%的氢氧化钠溶液, 需加水的质量为( )。 A.50 g B.100 g C.47 g D.25 g 6.在 30 ℃时,50 g 水中最多溶解 A 物质 5 g,而在 60 ℃时,20 g 水中最多能溶解 B 物质 10 g,则( )。 A.A 的溶解度比 B 的大 B.B 的溶解度比 A 的大 C.二者的溶解度相等 D.无法比较 7.某实验室用氯化钠固体配制 100 g 溶质质量分数为 8%的氯化钠溶液,下列说法 中错误的是( )。 A.实验步骤为计算、称量、量取、溶解 B.量取水时,用规格为 100 mL 的量筒 C.若用量筒量取水时俯视凹液面的最低处,则配制溶液的溶质质量分数小于 8% D.溶解过程中,玻璃棒搅拌的作用是加快氯化钠的溶解 8.某同学在工具书中查到 NaOH 在水和酒精中的溶解度,如下表所列。通过分析, 他得出以下结论,其中不正确的是( )。 溶剂 20 ℃ 40 ℃ 水 109 g 129 g 酒精 17.3 g 40 g

A.温度和溶剂种类对NaOH的溶解度都有影响 B.NaOH易溶于水,也易溶于酒精 C.40℃时,40 g NaOH溶解在100g酒精中达到饱和 D.将等质量的40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃, 析出的晶体前者比后者多 9.下图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为 升温蒸发过程②溶液恰好为饱和状态。分析实验过程,下列判断正确的是 (). ② A.在①→②过程中,氯化钠溶液的溶质质量分数保持不变 B.在②→③过程中,氯化钠的溶解度不断增大 C.在③→④过程中,水的质量分数不断增大 D.在②→④过程中,氯化钠溶液的溶质质量分数先不变后增大 10.20℃时,四个实验小组分别取不同质量的NaCL,逐渐加入各盛有50g水的烧 杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCI的质量。记录数据如 下表所列。 测量数据 第一组 第二组 第三组 第四组 水的质量g 50 50 50 50 所取NaCI的质量/g 15 20 25 30 剩余NaCI的质量g 0 2 7 12 下列说法错误的是( ) A.20℃时,50 g NaCl饱和溶液中含有18 g NaCl B.用蒸发的方法可以使不饱和溶液变成饱和溶液 C.第二组所得溶液中溶质与溶剂的质量比为9:25 D.相同温度下,NaCI在水中的溶解度与水的质量无关 二、填空题(共36分) 11.(12分)生命的孕育和维系需要水,人类的日常生活和工农业生产也离不开水, 水是最常用的溶剂。 A、B两种物质的溶解度曲线如图1所示。20℃时,将A、B两种固体各50g分 别加入盛有100g水的烧杯中,充分搅拌后,实验现象如图2所示。升温到50℃ 时,A、B两种固体在水中的溶解情况如图3所示。(已知:A、B两物质均不含结 晶水)
A.温度和溶剂种类对 NaOH 的溶解度都有影响 B.NaOH 易溶于水,也易溶于酒精 C.40 ℃时,40 g NaOH 溶解在 100 g 酒精中达到饱和 D.将等质量的 40 ℃的饱和 NaOH 水溶液和饱和 NaOH 酒精溶液降温至 20 ℃, 析出的晶体前者比后者多 9.下图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为 升温蒸发过程,②溶液恰好为饱和状态。分析实验过程,下列判断正确的是 ( )。 A.在①→②过程中,氯化钠溶液的溶质质量分数保持不变 B.在②→③过程中,氯化钠的溶解度不断增大 C.在③→④过程中,水的质量分数不断增大 D.在②→④过程中,氯化钠溶液的溶质质量分数先不变后增大 10.20 ℃时,四个实验小组分别取不同质量的 NaCl,逐渐加入各盛有 50 g 水的烧 杯中,不断搅拌直到不再溶解为止,然后分别称量剩余 NaCl 的质量。记录数据如 下表所列。 测量数据 第一组 第二组 第三组 第四组 水的质量/g 50 50 50 50 所取 NaCl 的质量/g 15 20 25 30 剩余 NaCl 的质量/g 0 2 7 12 下列说法错误的是( )。 A.20 ℃时,50 g NaCl 饱和溶液中含有 18 g NaCl B.用蒸发的方法可以使不饱和溶液变成饱和溶液 C.第二组所得溶液中溶质与溶剂的质量比为 9∶25 D.相同温度下,NaCl 在水中的溶解度与水的质量无关 二、填空题(共 36 分) 11.(12 分)生命的孕育和维系需要水,人类的日常生活和工农业生产也离不开水, 水是最常用的溶剂。 A、B 两种物质的溶解度曲线如图 1 所示。20 ℃时,将 A、B 两种固体各 50 g 分 别加入盛有 100 g 水的烧杯中,充分搅拌后,实验现象如图 2 所示。升温到 50 ℃ 时,A、B 两种固体在水中的溶解情况如图 3 所示。(已知:A、B 两物质均不含结 晶水)

甲 60 25 升温 2050 20C 50C 温度C 图1 图2 图3 请回答下列问题。 (1)温度从20℃到50℃的变化过程中,一直处于饱和状态的是 (填“A” 或B)溶液。 (2)图1中能表示A物质溶解度随温度变化的曲线是 (填“甲”或“乙)。 (3)图1中P点的含义是 (4)图3中A溶液的溶质质量分数是 (计算结果精确到0.1%)。 12.(12分)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固 体,搅拌至充分溶解(如有不溶的KNO3固体用过滤的方法除去),得到溶液。加入 KNO3固体的质量与所得溶液的质量如下表所列。 质 量 实验a 实验b 实验c 实验d 加入KNO3固体的质量 45 50 55 60 所得溶液的质量g 95 100 105 105 (1)写出一种将硝酸钾的不饱和溶液转化为饱和溶液的方法: 实 验a、b、c、d中,溶液一定饱和的是 (填实验编号) (2)把实验a、d所得溶液分别恒温蒸发掉20g水,则实验 (填“a”或“d)析出 晶体的质量多。 (3)取实验d所得溶液,加入食盐,食盐 (填“会”或“不会)溶解。 (4)实验a、b、c、d所得溶液中,溶质质量分数大小关系为 (用“<=”或”连接) (5)把20℃时硝酸钾饱和溶液升温到60℃,下列分析正确的是 (填字母)。 A.溶液仍然是饱和溶液 B.溶质质量分数变大 C.溶剂质量不变 13.(12分)溶液在日常生活、工农业生产和科学研究中具有广泛用途。 (1)KNO3属于复合肥料,溶质质量分数为3%的KNO3溶液常用作无土栽培的营养 液。配制100g该营养液所需要的溶质是 其质量为 8,配 制时常用玻璃棒搅拌的目的是 (2)某KNO3固体混有少量NaCL,要用它配制上述营养液,需在配制前进行提纯(图 1为溶解度曲线)。60℃时,KNO3的溶解度为 g,将该固体溶于水 配制为接近饱和的溶液,可采用降温结晶的方法提纯KNO3,其理由 是 (3)探究温度对溶解度的影响,实验过程如图2所示。固体X是NH4NO3或 NaOH,固体Y是KNO3或Ca(OHD2。烧杯中盛放20℃Y的饱和溶液(有少量Y
请回答下列问题。 (1)温度从 20 ℃到 50 ℃的变化过程中,一直处于饱和状态的是 (填“A” 或“B”)溶液。 (2)图 1 中能表示 A 物质溶解度随温度变化的曲线是 (填“甲”或“乙”)。 (3)图 1 中 P 点的含义是 。 (4)图 3 中 A 溶液的溶质质量分数是 (计算结果精确到 0.1%)。 12.(12 分)在一定温度下,向质量均为 50 g 的 4 份水中分别加入一定量的 KNO3固 体,搅拌至充分溶解(如有不溶的 KNO3 固体用过滤的方法除去),得到溶液。加入 KNO3 固体的质量与所得溶液的质量如下表所列。 质 量 实验 a 实验 b 实验 c 实验 d 加入 KNO3 固体的质量 /g 45 50 55 60 所得溶液的质量/g 95 100 105 105 (1)写出一种将硝酸钾的不饱和溶液转化为饱和溶液的方法: 。实 验 a、b、c、d 中,溶液一定饱和的是 (填实验编号)。 (2)把实验 a、d 所得溶液分别恒温蒸发掉 20 g 水,则实验 (填“a”或“d”)析出 晶体的质量多。 (3)取实验 d 所得溶液,加入食盐,食盐 (填“会”或“不会”)溶解。 (4)实验 a、b、c、d 所得溶液中,溶质质量分数大小关系为 (用“”连接)。 (5)把 20 ℃时硝酸钾饱和溶液升温到 60 ℃,下列分析正确的是 (填字母)。 A.溶液仍然是饱和溶液 B.溶质质量分数变大 C.溶剂质量不变 13.(12 分)溶液在日常生活、工农业生产和科学研究中具有广泛用途。 (1)KNO3 属于复合肥料,溶质质量分数为 3%的 KNO3溶液常用作无土栽培的营养 液。配制 100 g 该营养液所需要的溶质是 ,其质量为 g,配 制时常用玻璃棒搅拌的目的是 。 (2)某 KNO3 固体混有少量 NaCl,要用它配制上述营养液,需在配制前进行提纯(图 1 为溶解度曲线)。60 ℃时,KNO3 的溶解度为 g,将该固体溶于水 配制为接近饱和的溶液,可采用降温结晶的方法提纯 KNO3,其理由 是 。 (3)探究温度对溶解度的影响,实验过程如图 2 所示。固体 X 是 NH4NO3 或 NaOH,固体 Y 是 KNO3或 Ca(OH)2。烧杯中盛放 20 ℃ Y 的饱和溶液(有少量 Y
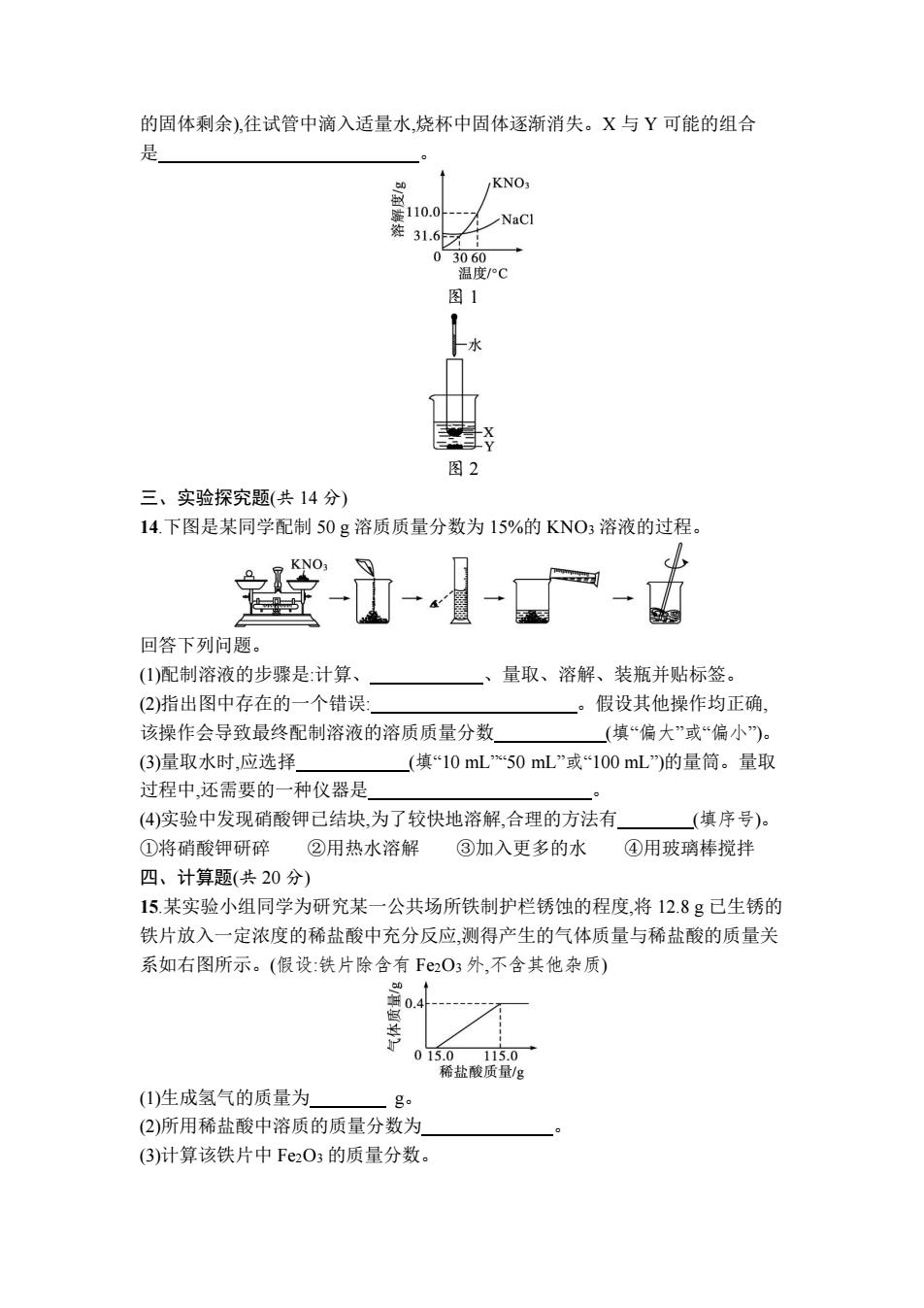
的固体剩余),往试管中滴入适量水,烧杯中固体逐渐消失。X与Y可能的组合 是 KNO 110.0 NaCl 31.6 03060 温度/°C 图1 图2 三、实验探究题(共14分) 14.下图是某同学配制50g溶质质量分数为15%的KNO3溶液的过程。 --- 回答下列问题。 (1)配制溶液的步骤是:计算、 量取、溶解、装瓶并贴标签。 (2)指出图中存在的一个错误: 、。 假设其他操作均正确、 该操作会导致最终配制溶液的溶质质量分数 (填“偏大”或“偏小”)。 (3)量取水时,应选择 (填“10mL50mL”或“100mL)的量筒。量取 过程中,还需要的一种仪器是 (4)实验中发现硝酸钾已结块,为了较快地溶解,合理的方法有 (填序号) ①将硝酸钾研碎 ②用热水溶解 ③加入更多的水 ④用玻璃棒搅拌 四、计算题(共20分) 15.某实验小组同学为研究某一公共场所铁制护栏锈蚀的程度,将12.8g己生锈的 铁片放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关 系如右图所示。(假设:铁片除含有F2O3外,不含其他杂质) 0g 015.0115.0 稀盐酸质量/g (1)生成氢气的质量为 g。 (2)所用稀盐酸中溶质的质量分数为 (3)计算该铁片中Fe2O3的质量分数
的固体剩余),往试管中滴入适量水,烧杯中固体逐渐消失。X 与 Y 可能的组合 是 。 图 1 图 2 三、实验探究题(共 14 分) 14.下图是某同学配制 50 g 溶质质量分数为 15%的 KNO3 溶液的过程。 回答下列问题。 (1)配制溶液的步骤是:计算、 、量取、溶解、装瓶并贴标签。 (2)指出图中存在的一个错误: 。假设其他操作均正确, 该操作会导致最终配制溶液的溶质质量分数 (填“偏大”或“偏小”)。 (3)量取水时,应选择 (填“10 mL”“50 mL”或“100 mL”)的量筒。量取 过程中,还需要的一种仪器是 。 (4)实验中发现硝酸钾已结块,为了较快地溶解,合理的方法有 (填序号)。 ①将硝酸钾研碎 ②用热水溶解 ③加入更多的水 ④用玻璃棒搅拌 四、计算题(共 20 分) 15.某实验小组同学为研究某一公共场所铁制护栏锈蚀的程度,将 12.8 g 已生锈的 铁片放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关 系如右图所示。(假设:铁片除含有 Fe2O3 外,不含其他杂质) (1)生成氢气的质量为 g。 (2)所用稀盐酸中溶质的质量分数为 。 (3)计算该铁片中 Fe2O3 的质量分数

答案: 1.B2.C3D4D 5.A设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则50g×6%(50 g+x)×3%,解得x=50g。故选A。 6D根据溶解度的概念可知,30℃时,A物质的溶解度是10g:60℃时,B物质的 溶解度是50g。由于温度不同,物质也不相同,它们的溶解度随温度的变化规律也 未知,故无法比较它们的溶解度大小。故选D。 7.C 8D由题中信息可知,在不同温度、不同溶剂中,NaOH的溶解度不同,因此温度 和溶剂种类对NaOH的溶解度都有影响,A正确。20℃时,NaOH在水和酒精中 的溶解度都大于10g,属于易溶物质,B正确。40℃时,NaOH在酒精中的溶解度 为40g,即40 g NaOH溶解在100g酒精中恰好达到饱和,C正确。若质量为229 g的40℃的饱和NaOH水溶液降温至20℃时,析出晶体20g:40℃时质量为 140g的饱和NaOH酒精溶液降温至20℃时,析出的晶体为22.7g。40℃时229 g NaOH酒精溶液降温至20℃,析出晶体的质量应大于22.7g,则等质量40℃的 饱和NaOH水溶液和NaOH酒精溶液降温至20℃,析出的晶体前者比后者少,D 错误。 9.D 10.A分析四组数据可得出,20℃时50g水中最多溶解18g氯化钠,即68g饱 和溶液中含有18g氯化钠,A错误;不饱和溶液通过蒸发溶剂能变成饱和溶液,B 正确;第二组所得溶液中溶质和溶剂的质量比为18g:50g=9:25,C正确;溶解度 是一定温度时100g水中最多溶解溶质的质量,与水的质量无关,D正确。 11.答案:(1)B(2)甲(3)20℃时,A、B两物质的溶解度相等(4)33.3% 解析:20℃时,将A、B两种固体各50g,分别加入盛有100g水的烧杯中,充分搅 拌后现象如图2所示:升温到50℃时,A、B两种固体在水中的溶解情况如图3 所示,B物质的固体增多,A物质的固体减少,所以甲是A物质的溶解度曲线,乙是 B物质的溶解度曲线。 (1)从20℃到50℃的变化过程中,B烧杯底部一直有固体剩余,所以一直处于饱 和状态的是B的溶液。(2)图1中能表示A物质溶解度随温度变化的曲线是 甲。(3)图1中P点的含义是20℃时,A、B物质的溶解度相等。(4)图3中 A溶液的溶质质量分数是508×100%33.3%。 150g 12.答案:(1)加硝酸钾固体(或:降温、蒸发溶剂)c、d (2)d(3)会(4)a<b<c=d(5)C 解析:(1)使硝酸钾不饱和溶液转化为饱和溶液的方法包括:向不饱和的硝酸钾溶 液中加入溶质硝酸钾固体、恒温蒸发不饱和硝酸钾溶液中的水、降温;、b、 c、d实验中,向质量均为50g的4份水中分别加入45g、50g、55g、60g的硝 酸钾固体,得到的溶液质量分别为95g、100g、105g、105g,可见c、d实验中
答案: 1.B 2.C 3.D 4.D 5.A 设要加水的质量为 x,根据溶液稀释前后溶质的质量不变,则 50 g×6%=(50 g+x)×3%,解得 x=50 g。故选 A。 6.D 根据溶解度的概念可知,30 ℃时,A 物质的溶解度是 10 g;60 ℃时,B 物质的 溶解度是 50 g。由于温度不同,物质也不相同,它们的溶解度随温度的变化规律也 未知,故无法比较它们的溶解度大小。故选 D。 7.C 8.D 由题中信息可知,在不同温度、不同溶剂中,NaOH 的溶解度不同,因此温度 和溶剂种类对 NaOH 的溶解度都有影响,A 正确。20 ℃时,NaOH 在水和酒精中 的溶解度都大于 10 g,属于易溶物质,B 正确。40 ℃时,NaOH 在酒精中的溶解度 为 40 g,即 40 g NaOH 溶解在 100 g 酒精中恰好达到饱和,C 正确。若质量为 229 g 的 40 ℃的饱和 NaOH 水溶液降温至 20 ℃时,析出晶体 20 g;40 ℃时质量为 140 g 的饱和 NaOH 酒精溶液降温至 20 ℃时,析出的晶体为 22.7 g。40 ℃时 229 g NaOH 酒精溶液降温至 20 ℃,析出晶体的质量应大于 22.7 g,则等质量 40 ℃的 饱和 NaOH 水溶液和 NaOH 酒精溶液降温至 20 ℃,析出的晶体前者比后者少,D 错误。 9.D 10.A 分析四组数据可得出,20 ℃时 50 g 水中最多溶解 18 g 氯化钠,即 68 g 饱 和溶液中含有 18 g 氯化钠,A 错误;不饱和溶液通过蒸发溶剂能变成饱和溶液,B 正确;第二组所得溶液中溶质和溶剂的质量比为 18 g∶50 g=9∶25,C 正确;溶解度 是一定温度时 100 g 水中最多溶解溶质的质量,与水的质量无关,D 正确。 11.答案:(1)B (2)甲 (3)20 ℃时,A、B 两物质的溶解度相等 (4)33.3% 解析:20 ℃时,将 A、B 两种固体各 50 g,分别加入盛有 100 g 水的烧杯中,充分搅 拌后现象如图 2 所示;升温到 50 ℃时,A、B 两种固体在水中的溶解情况如图 3 所示,B 物质的固体增多,A 物质的固体减少,所以甲是 A 物质的溶解度曲线,乙是 B 物质的溶解度曲线。 (1)从 20 ℃到 50 ℃的变化过程中,B 烧杯底部一直有固体剩余,所以一直处于饱 和状态的是 B 的溶液。 (2)图 1 中能表示 A 物质溶解度随温度变化的曲线是 甲。 (3)图 1 中 P 点的含义是:20 ℃时,A、B 物质的溶解度相等。 (4)图 3 中 A 溶液的溶质质量分数是 50 g 150 g ×100%≈33.3%。 12.答案:(1)加硝酸钾固体(或:降温、蒸发溶剂) c、d (2)d (3)会 (4)a<b<c=d (5)C 解析:(1)使硝酸钾不饱和溶液转化为饱和溶液的方法包括:向不饱和的硝酸钾溶 液中加入溶质硝酸钾固体、恒温蒸发不饱和硝酸钾溶液中的水、降温;a、b、 c、d 实验中,向质量均为 50 g 的 4 份水中分别加入 45 g、50 g、55 g、60 g 的硝 酸钾固体,得到的溶液质量分别为 95 g、100 g、105 g、105 g,可见 c、d 实验中

溶液一定饱和。(2)把实验a、d所得溶液分别恒温蒸发掉20g水,由于d为饱 和溶液,析出晶体的质量多。(3)实验d所得溶液只是硝酸钾的饱和溶液,加入 食盐会继续溶解。(4)实验a、b、c、d配制的溶液中,溶剂水的质量都为50g 所以在溶剂相同的情况下溶质越多,所得溶液的溶质质量分数越大。在实验中 溶质的质量为45g,在实验b中溶质的质量为50g,在实验℃、d中溶质的质量均 为55g,实验a、b、c、d所配制的溶液中溶质的质量分数的大小为a<b<c=d。 (⑤)把20℃时硝酸钾饱和溶液升温到60℃,溶液变为不饱和溶液,但溶液中溶 质、溶剂都没有改变,溶质质量分数也不变。 13.答案(1)硝酸钾3加快溶解速率(2)110硝酸钾的溶解度受温度的影响 大,随着温度降低,其溶解度急剧减小,而氯化钠的溶解度受温度影响较小,故降温 时硝酸钾析出(3)NH4NO3、Ca(OH)2(或:NaOH、KNO3) 解析(1)配制100g溶质质量分数为3%的硝酸钾溶液需要的溶质是硝酸钾;其质 量为100g×3%=3g配制时常用玻璃棒搅拌,目的是加快溶解速率。(2)根据题 目信息和溶解度曲线可知60℃时,硝酸钾的溶解度为110g;将该固体溶于水配 制为接近饱和的溶液,可采用降温结晶的方法提纯硝酸钾,其理由是硝酸钾的溶解 度受温度的影响大,随温度降低其溶解度急剧减小,而氯化钠的溶解度受温度影响 较小,故降温时硝酸钾析出。(3)往试管中滴入适量水,烧杯中固体逐渐消失,X 应为溶于水能吸收或放出热量的物质。若X为NH4NO3,则Y应为溶解度随温度 降低而增大的物质,即Y为Ca(OH)2;若X为NaOH,则Y应为溶解度随温度升高 而增大的物质,即Y为KNO3,则X与Y可能的组合为NH4NO3、Ca(OH)2或 NaOH、KNO3o 14.答案:(1)称量(2)砝码放反了(或:仰视读数)偏小(3)50mL胶头滴管 (4)①②④ 15.答案:(1)0.4(2)14.6%(3)12.5% 解析(1)由图中信息可知,消耗稀盐酸的质量为115.0g,产生氢气的质量为0.4g。 (2)设生成0.4g氢气需要铁的质量为x,所用盐酸中溶质的质量为y。 Fe+2HC-FeCl2+H2↑ 56 732 X y0.4g = x=11.2g 孕=六8 =14.6g 与铁反应的盐酸的质量为115.0g-15.0g=100.0g, 盐酸中溶质的质量分数为146邑×100%=14.6%。 100.0g (3)铁锈的质量为12.8g-11.2g=1.6g, 铁片中F203的质量分数为6&x100%=12.5%。 12.8g
溶液一定饱和。 (2)把实验 a、d 所得溶液分别恒温蒸发掉 20 g 水,由于 d 为饱 和溶液,析出晶体的质量多。 (3)实验 d 所得溶液只是硝酸钾的饱和溶液,加入 食盐会继续溶解。 (4)实验 a、b、c、d 配制的溶液中,溶剂水的质量都为 50 g, 所以在溶剂相同的情况下溶质越多,所得溶液的溶质质量分数越大。在实验 a 中 溶质的质量为 45 g,在实验 b 中溶质的质量为 50 g,在实验 c、d 中溶质的质量均 为 55 g,实验 a、b、c、d 所配制的溶液中溶质的质量分数的大小为 a<b<c=d。 (5)把 20 ℃时硝酸钾饱和溶液升温到 60 ℃,溶液变为不饱和溶液,但溶液中溶 质、溶剂都没有改变,溶质质量分数也不变。 13.答案:(1)硝酸钾 3 加快溶解速率 (2)110 硝酸钾的溶解度受温度的影响 大,随着温度降低,其溶解度急剧减小,而氯化钠的溶解度受温度影响较小,故降温 时硝酸钾析出 (3)NH4NO3、Ca(OH)2(或:NaOH、KNO3) 解析:(1)配制 100 g 溶质质量分数为 3%的硝酸钾溶液需要的溶质是硝酸钾;其质 量为 100 g×3%=3 g;配制时常用玻璃棒搅拌,目的是加快溶解速率。 (2)根据题 目信息和溶解度曲线可知 60 ℃时,硝酸钾的溶解度为 110 g;将该固体溶于水配 制为接近饱和的溶液,可采用降温结晶的方法提纯硝酸钾,其理由是硝酸钾的溶解 度受温度的影响大,随温度降低其溶解度急剧减小,而氯化钠的溶解度受温度影响 较小,故降温时硝酸钾析出。 (3)往试管中滴入适量水,烧杯中固体逐渐消失,X 应为溶于水能吸收或放出热量的物质。若 X 为 NH4NO3,则 Y 应为溶解度随温度 降低而增大的物质,即 Y 为 Ca(OH)2;若 X 为 NaOH,则 Y 应为溶解度随温度升高 而增大的物质,即 Y 为 KNO3,则 X 与 Y 可能的组合为 NH4NO3、Ca(OH)2或 NaOH、KNO3。 14.答案:(1)称量 (2)砝码放反了(或:仰视读数) 偏小 (3)50 mL 胶头滴管 (4)①②④ 15.答案:(1)0.4 (2)14.6% (3)12.5% 解析:(1)由图中信息可知,消耗稀盐酸的质量为 115.0 g,产生氢气的质量为 0.4 g。 (2)设生成 0.4 g 氢气需要铁的质量为 x,所用盐酸中溶质的质量为 y。 Fe+2HCl FeCl2+H2↑ 56 73 2 X y 0.4 g 56 2 = 𝑥 0.4 g x=11.2 g 73 2 = 𝑦 0.4 g y=14.6 g 与铁反应的盐酸的质量为 115.0 g-15.0 g=100.0 g, 盐酸中溶质的质量分数为 14.6 g 100.0 g ×100%=14.6%。 (3)铁锈的质量为 12.8 g-11.2 g=1.6 g, 铁片中 Fe2O3 的质量分数为 1.6 g 12.8 g ×100%=12.5%