
第八单元检测 一、选择题(每题3分,共30分) 1.下图所示物品所使用的主要材料属于合金的是( A.橡胶轮胎 B.木雕作品 C.艺术瓷瓶 D.青铜摆件 2.为了减缓铁制品的锈蚀,下列做法不当的是()。 A.在车船的表面喷涂油漆 B.将使用后的菜刀用布擦干 C.洗净铁制品表面的油膜 D.在铁制品表面镀上一层锌 3.下列有关金属材料的说法错误的是( A.铜制导线主要利用了铜的导电性 B.钨制灯丝主要利用了钨硬度大的性质 C.铁制炊具主要利用了铁的导热性 D锡合金焊接金属主要利用了合金熔点低的性质 4.常见金属X与硝酸银溶液反应的化学方程式为X+3AgNO一3Ag+XNO3), 有关该反应的说法错误的是()。 A该反应是置换反应 B.X可能是铁 C.金属活动性X>Ag DX表面有固体析出 5.铝、铁、铜三种金属与我们的生活密切相关,下列关于铝、铁、铜的说法错误 的是() A.铝与硫酸铜溶液反应的化学方程式为A+CuSO,一A1SO4+Cu B.用硫酸铝溶液、氯化铜溶液、单质铁三种物质可探究出三种金属活动性顺序 C.铝制品具有抗腐蚀性,是因为铝制品表面可形成致密的氧化物薄膜 D我国历史上最早使用的金属是铜 6将相同质量、相同形状的铁和锌,分别与等质量、等浓度的稀盐酸反应,产生氢 气的量与反应时间的关系如右图所示。下列说法正确的是( )。 时间/s A.乙表示锌与盐酸的反应 B.铁可能与盐酸恰好完全反应,而锌有剩余 C两个反应消耗金属的质量不相等 D.所得溶液的质量相等
第八单元检测 一、选择题(每题 3 分,共 30 分) 1.下图所示物品所使用的主要材料属于合金的是( )。 2.为了减缓铁制品的锈蚀,下列做法不当的是( )。 A.在车船的表面喷涂油漆 B.将使用后的菜刀用布擦干 C.洗净铁制品表面的油膜 D.在铁制品表面镀上一层锌 3.下列有关金属材料的说法错误的是( )。 A.铜制导线主要利用了铜的导电性 B.钨制灯丝主要利用了钨硬度大的性质 C.铁制炊具主要利用了铁的导热性 D.锡合金焊接金属主要利用了合金熔点低的性质 4.常见金属 X 与硝酸银溶液反应的化学方程式为 X+3AgNO3 3Ag+X(NO3)3, 有关该反应的说法错误的是( )。 A.该反应是置换反应 B.X 可能是铁 C.金属活动性 X>Ag D.X 表面有固体析出 5.铝、铁、铜三种金属与我们的生活密切相关,下列关于铝、铁、铜的说法错误 的是( )。 A.铝与硫酸铜溶液反应的化学方程式为 Al+CuSO4 AlSO4+Cu B.用硫酸铝溶液、氯化铜溶液、单质铁三种物质可探究出三种金属活动性顺序 C.铝制品具有抗腐蚀性,是因为铝制品表面可形成致密的氧化物薄膜 D.我国历史上最早使用的金属是铜 6.将相同质量、相同形状的铁和锌,分别与等质量、等浓度的稀盐酸反应,产生氢 气的量与反应时间的关系如右图所示。下列说法正确的是( )。 A.乙表示锌与盐酸的反应 B.铁可能与盐酸恰好完全反应,而锌有剩余 C.两个反应消耗金属的质量不相等 D.所得溶液的质量相等
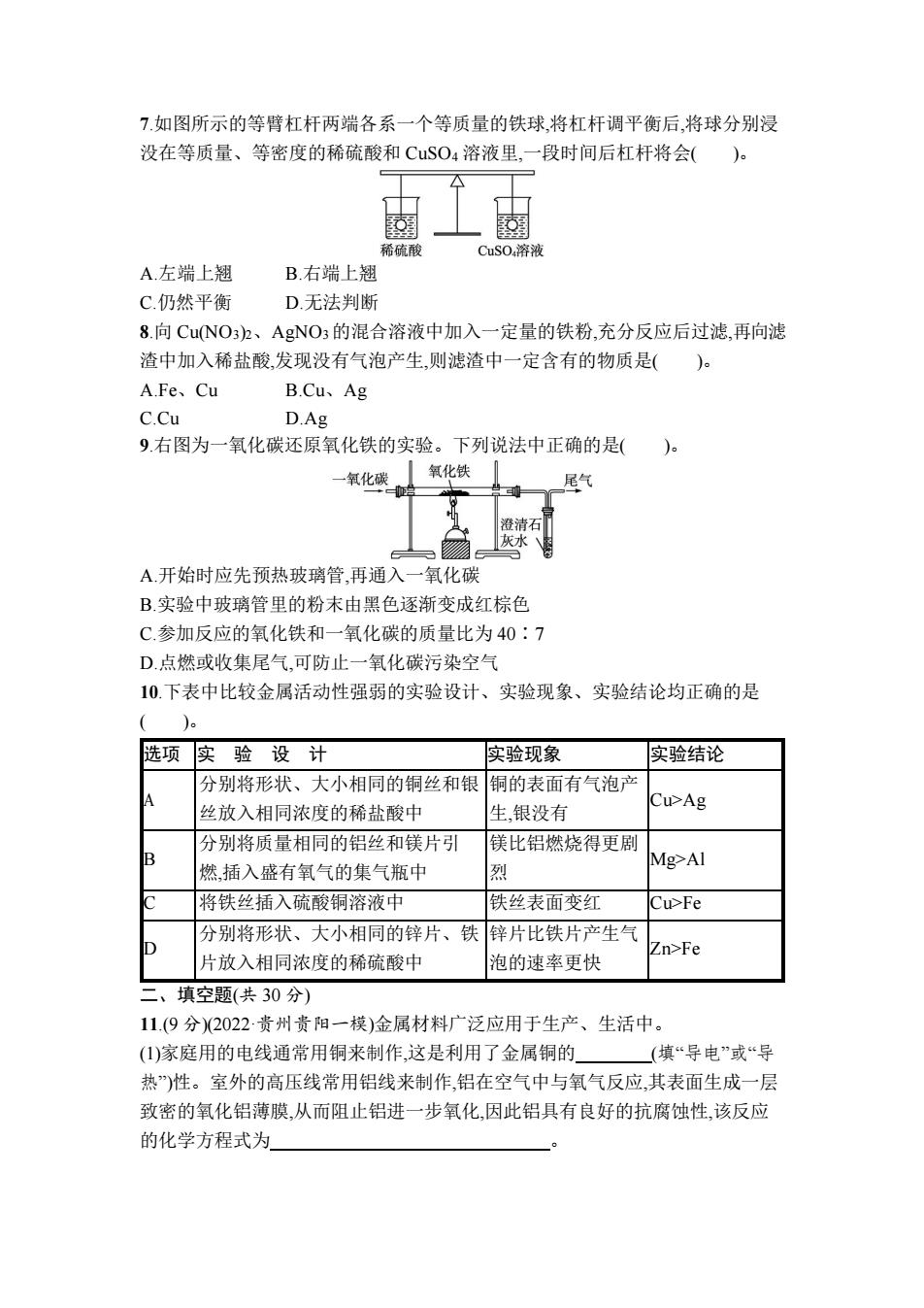
7.如图所示的等臂杠杆两端各系一个等质量的铁球,将杠杆调平衡后,将球分别浸 没在等质量、等密度的稀硫酸和CuSO4溶液里,一段时间后杠杆将会()。 稀硫酸 CuSO4溶液 A.左端上翘 B.右端上翘 C.仍然平衡 D.无法判断 8.向CuNO3)2、AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,再向滤 渣中加入稀盐酸,发现没有气泡产生,则滤渣中一定含有的物质是()。 A.Fe、Cu B.Cu、Ag C.Cu D.Ag 9.右图为一氧化碳还原氧化铁的实验。下列说法中正确的是()。 一氧化碳 氧化铁 尾气 澄清石 灰水、 A.开始时应先预热玻璃管,再通入一氧化碳 B.实验中玻璃管里的粉末由黑色逐渐变成红棕色 C.参加反应的氧化铁和一氧化碳的质量比为40:7 D.点燃或收集尾气,可防止一氧化碳污染空气 10.下表中比较金属活动性强弱的实验设计、实验现象、实验结论均正确的是 选项实验设计 实验现象 实验结论 分别将形状、大小相同的铜丝和银 铜的表面有气泡产 丝放入相同浓度的稀盐酸中 生,银没有 Cu>Ag 分别将质量相同的铝丝和镁片引 镁比铝燃烧得更剧 燃,插入盛有氧气的集气瓶中 烈 Mg>Al 将铁丝插入硫酸铜溶液中 铁丝表面变红 Cu>Fe 分别将形状、大小相同的锌片、铁 锌片比铁片产生气 Zn>Fe 片放入相同浓度的稀硫酸中 泡的速率更快 二、填空题(共30分) 11.(9分)2022·贵州贵阳一模)金属材料广泛应用于生产、生活中。 (1)家庭用的电线通常用铜来制作,这是利用了金属铜的 (填“导电”或“导 热”)性。室外的高压线常用铝线来制作,铝在空气中与氧气反应,其表面生成一层 致密的氧化铝薄膜,从而阻止铝进一步氧化,因此铝具有良好的抗腐蚀性,该反应 的化学方程式为
7.如图所示的等臂杠杆两端各系一个等质量的铁球,将杠杆调平衡后,将球分别浸 没在等质量、等密度的稀硫酸和 CuSO4 溶液里,一段时间后杠杆将会( )。 A.左端上翘 B.右端上翘 C.仍然平衡 D.无法判断 8.向 Cu(NO3)2、AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,再向滤 渣中加入稀盐酸,发现没有气泡产生,则滤渣中一定含有的物质是( )。 A.Fe、Cu B.Cu、Ag C.Cu D.Ag 9.右图为一氧化碳还原氧化铁的实验。下列说法中正确的是( )。 A.开始时应先预热玻璃管,再通入一氧化碳 B.实验中玻璃管里的粉末由黑色逐渐变成红棕色 C.参加反应的氧化铁和一氧化碳的质量比为 40∶7 D.点燃或收集尾气,可防止一氧化碳污染空气 10.下表中比较金属活动性强弱的实验设计、实验现象、实验结论均正确的是 ( )。 选项 实 验 设 计 实验现象 实验结论 A 分别将形状、大小相同的铜丝和银 丝放入相同浓度的稀盐酸中 铜的表面有气泡产 生,银没有 Cu>Ag B 分别将质量相同的铝丝和镁片引 燃,插入盛有氧气的集气瓶中 镁比铝燃烧得更剧 烈 Mg>Al C 将铁丝插入硫酸铜溶液中 铁丝表面变红 Cu>Fe D 分别将形状、大小相同的锌片、铁 片放入相同浓度的稀硫酸中 锌片比铁片产生气 泡的速率更快 Zn>Fe 二、填空题(共 30 分) 11.(9 分)(2022·贵州贵阳一模)金属材料广泛应用于生产、生活中。 (1)家庭用的电线通常用铜来制作,这是利用了金属铜的 (填“导电”或“导 热”)性。室外的高压线常用铝线来制作,铝在空气中与氧气反应,其表面生成一层 致密的氧化铝薄膜,从而阻止铝进一步氧化,因此铝具有良好的抗腐蚀性,该反应 的化学方程式为

(2)铁是用量最大的金属。生产铁主要是利用高炉炼铁,其主要反应原理是一氧化 碳与氧化铁的反应,该反应的化学方程式为 生产出来的铁制品容易生锈,请写出生活中铁制品防锈的一条具体措 施: (3)某锌粉含有铜、镁中的一种杂质,取该样品13g与足量稀盐酸充分反应,生成 氢气0.42g,该锌粉中含有的杂质是 。 另取一定量该样品放入硫酸铜 溶液中,充分反应后过滤,得到滤渣和滤液。将滤渣洗净,滴入稀硫酸,有气泡产生」 则滤液中一定含有的溶质是 (填化学式) 12.(12分)请用化学知识回答下列问题。 (1)某市的锰资源非常丰富,锰及锰的化合物应用广泛,实验室用氯酸钾和二氧化 锰混合制取氧气,二氧化锰的作用是 (2)钢铁在生活中应用广泛,在潮湿的空气中铁制品容易生锈(铁锈的主要成分是 F2O3),用稀硫酸除铁锈的化学方程式为 (3)金属及金属材料在生产、生活中有广泛的应用,请根据相关信息回答问题。 ①现有铁、铜、锌三种金属,请选择一种试剂 (填化学 式),通过实验证明它们金属活动性的强弱。 ②金属钠非常活泼,在自然界以化合物的形式存在,科学家们对钠电池的研究也取 得了较大进展。工业上常用电解熔融状态的氯化钠制取单质钠,并产生氯气(C), 请写出该反应的化学方程式: (该反应与电解水 类似)。 13.(9分)某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属 铜,设计了如下图所示实验。 固体A②加人过量的稀酰酸铜 含有Al2(SO)3、①加人过量的铁粉 过滤 CuSO,的废液 过滤 溶液B (1)①中有关反应的化学方程式为 (2)溶液B中所含的物质(水除外)是 (3)②中加入过量稀硫酸的目的是 三、实验探究题(共20分) 14.钢铁是使用最广泛的金属材料。 稀 硫 硫酸铜 硝酸银 铁酸铁溶液铁溶液 实验 实验二 图1 氧化铁 化碳 粉末 澄清 石灰水
(2)铁是用量最大的金属。生产铁主要是利用高炉炼铁,其主要反应原理是一氧化 碳与氧化铁的反应,该反应的化学方程式为 。 生产出来的铁制品容易生锈,请写出生活中铁制品防锈的一条具体措 施: 。 (3)某锌粉含有铜、镁中的一种杂质,取该样品 13 g 与足量稀盐酸充分反应,生成 氢气 0.42 g,该锌粉中含有的杂质是 。另取一定量该样品放入硫酸铜 溶液中,充分反应后过滤,得到滤渣和滤液。将滤渣洗净,滴入稀硫酸,有气泡产生, 则滤液中一定含有的溶质是 (填化学式)。 12.(12 分)请用化学知识回答下列问题。 (1)某市的锰资源非常丰富,锰及锰的化合物应用广泛,实验室用氯酸钾和二氧化 锰混合制取氧气,二氧化锰的作用是 。 (2)钢铁在生活中应用广泛,在潮湿的空气中铁制品容易生锈(铁锈的主要成分是 Fe2O3),用稀硫酸除铁锈的化学方程式为 。 (3)金属及金属材料在生产、生活中有广泛的应用,请根据相关信息回答问题。 ①现有铁、铜、锌三种金属,请选择一种试剂: (填化学 式),通过实验证明它们金属活动性的强弱。 ②金属钠非常活泼,在自然界以化合物的形式存在,科学家们对钠电池的研究也取 得了较大进展。工业上常用电解熔融状态的氯化钠制取单质钠,并产生氯气(Cl2), 请写出该反应的化学方程式: (该反应与电解水 类似)。 13.(9 分)某化学兴趣小组的同学想从含有 Al2(SO4)3、CuSO4 的废液中回收金属 铜,设计了如下图所示实验。 (1)①中有关反应的化学方程式为 。 (2)溶液 B 中所含的物质(水除外)是 。 (3)②中加入过量稀硫酸的目的是 。 三、实验探究题(共 20 分) 14.钢铁是使用最广泛的金属材料。 图 1

图2 (1)小林在家中找到一段铁丝。为了解铁的有关化学性质,他和小伙伴们将它截成 了四小段,完成以下两个实验 ①实验一结束后,可能产生的不良后果是 ②实验二中铁与硫酸铜溶液反应的化学方程式是 ③在实验二的基础上,要比较铁、铜、银三种金属的活动性强弱,还需补充完成的 实验是 (2)小林和小伙伴们对铁是如何治炼的产生了好奇,于是他们对教材上所示模拟炼 铁装置进行了改进,设计了如图2所示的装置,模拟炼铁。 ①实验中可看到A处玻璃管里的现象是。 ②该实验中,盛满澄清石灰水的装置除了可验证反应生成了二氧化碳并将其吸收 外,还能起到的作用是 ③实验结束后应先 (填“停止通一氧化碳”或“熄灭酒 精喷灯)。 四、计算题(共20分) 15.生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因 其含碳量不同分为生铁和钢(生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%)。 将一块质量为5.8g的铁合金放入烧杯中,再向烧杯中加入98g稀硫酸,恰好与铁 合金中的铁完全反应,所得氢气的质量为0.2g。通过计算回答:该铁合金是生铁 还是钢?(写出计算过程,结果精确到0.1%) 答案: 1.D2.C3.B 4B该反应是一种单质与一种化合物反应生成了另一种单质和另一种化合物 属于置换反应,A正确:由X与硝酸银溶液反应生成XNO3)3,X在化合物中的化 合价为+3价,铁与硝酸银溶液反应生成硝酸亚铁,故该金属不可能是铁,B错误:由 金属X能与硝酸银反应置换出银,说明X的活动性比银强,C正确:X表面有固体 银析出,D正确。 5.A铝与疏酸铜溶液反应的化学方程式为2A+3CuSO,一Al2(SO4)+3Cu。故 选A。 6.C锌比铁活泼,所以锌与酸反应的速率快,甲表示锌与盐酸的反应,A错误:生成 的氢气质量是相等的,则参加反应的盐酸的质量也是相等的,无剩余,那么根据化 学方程式可知铁消耗得少、锌消耗得多,根据“相同质量、相同形状的铁和锌”可 知,铁一定有剩余,所得溶液的质量不相等,C正确,B、D错误。 7.A 8D向AgNO3和CuNO3)2混合溶液中加入一定量的铁粉,铁粉首先置换硝酸银 中的银,待硝酸银完全反应后继续与硝酸铜发生反应置换出铜。充分反应后向滤 渣中加入稀盐酸无气泡,说明铁没有剩余,滤渣中一定含有Ag,可能含有铜
图 2 (1)小林在家中找到一段铁丝。为了解铁的有关化学性质,他和小伙伴们将它截成 了四小段,完成以下两个实验: ①实验一结束后,可能产生的不良后果是 。 ②实验二中铁与硫酸铜溶液反应的化学方程式是 。 ③在实验二的基础上,要比较铁、铜、银三种金属的活动性强弱,还需补充完成的 实验是 。 (2)小林和小伙伴们对铁是如何冶炼的产生了好奇,于是他们对教材上所示模拟炼 铁装置进行了改进,设计了如图 2 所示的装置,模拟炼铁。 ①实验中可看到 A 处玻璃管里的现象是 。 ②该实验中,盛满澄清石灰水的装置除了可验证反应生成了二氧化碳并将其吸收 外,还能起到的作用是 。 ③实验结束后应先 (填“停止通一氧化碳”或“熄灭酒 精喷灯”)。 四、计算题(共 20 分) 15.生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因 其含碳量不同分为生铁和钢(生铁含碳量为 2%~4.3%,钢含碳量为 0.03%~2%)。 将一块质量为 5.8 g 的铁合金放入烧杯中,再向烧杯中加入 98 g 稀硫酸,恰好与铁 合金中的铁完全反应,所得氢气的质量为 0.2 g。通过计算回答:该铁合金是生铁 还是钢?(写出计算过程,结果精确到 0.1%) 答案: 1.D 2.C 3.B 4.B 该反应是一种单质与一种化合物反应生成了另一种单质和另一种化合物, 属于置换反应,A 正确;由 X 与硝酸银溶液反应生成 X(NO3)3,X 在化合物中的化 合价为+3 价,铁与硝酸银溶液反应生成硝酸亚铁,故该金属不可能是铁,B 错误;由 金属 X 能与硝酸银反应置换出银,说明 X 的活动性比银强,C 正确;X 表面有固体 银析出,D 正确。 5.A 铝与硫酸铜溶液反应的化学方程式为 2Al+3CuSO4 Al2(SO4)3+3Cu。故 选 A。 6.C 锌比铁活泼,所以锌与酸反应的速率快,甲表示锌与盐酸的反应,A 错误;生成 的氢气质量是相等的,则参加反应的盐酸的质量也是相等的,无剩余,那么根据化 学方程式可知铁消耗得少、锌消耗得多,根据“相同质量、相同形状的铁和锌”可 知,铁一定有剩余,所得溶液的质量不相等,C 正确,B、D 错误。 7.A 8.D 向 AgNO3 和 Cu(NO3)2混合溶液中加入一定量的铁粉,铁粉首先置换硝酸银 中的银,待硝酸银完全反应后继续与硝酸铜发生反应置换出铜。充分反应后向滤 渣中加入稀盐酸无气泡,说明铁没有剩余,滤渣中一定含有 Ag,可能含有铜

9.D 10D由于铜和银的活动性都小于氢,所以都不会发生反应,A错误:分别将质量 相同的铝丝和镁片引燃插入盛有氧气的集气瓶中,由于金属的形状不同,无法得 出两种金属的活动性强弱,B错误;铁的金属活动性比铜强,能与硫酸铜溶液发生 置换反应,将铁丝放入硫酸铜溶液中,铁的表面会覆盖一层紫红色物质,说明了金 属活动性F>Cu,C错误;分别将形状、大小相同的锌片、铁片放入相同浓度的稀 硫酸中,锌片比铁片产生气泡的速率更快,说明锌的金属活动性比铁的强,即 Zn>Fe,D正确。 11.答案:(1)导电4A+302一2A203 (2Fe203+3CC高2F®+3CO2保持铁制品表面干燥[或铁制品表面涂保护膜(刷 漆、涂油)(答案合理即可) (3)镁MgSO4 解析:(1)用铜作电线是利用了金属铜的导电性;铝在空气中与氧气反应,生成氧化 铝,反应的化学方程式为4A+3O2一2A203。 (2)一氧化碳与氧化铁的反应,即高温条件下氧化铁与一氧化碳反应生成铁和二氧 化碳,该反应的化学方程式为Fe203+3CC高漂2F®+3C02生活中铁制品的防锈措施 有保持铁制品表面干燥、铁制品表面涂保护膜(刷漆、涂油)等。 (3)解:设13g锌、13g镁分别与稀盐酸反应生成氢气的质量为x、y。 Zn+2 HCIZnC2+H2↑ 65 2 13g 兴 x=0.4g Mg+2HCI一MgCh+H2↑ 24 2 13g y y =1.08g 由以上质量关系可知,13g镁和锌的混合物完全反应生成氢气的质量大于0.4 g,13g铜和锌的混合物完全反应生成氢气的质量小于0.4g,取该样品13g与足 量稀盐酸充分反应,生成氢气0.42g,该锌粉中含有的杂质是镁; 另取一定量该样品放入硫酸铜溶液中,镁先与硫酸铜反应生成硫酸镁和铜,然后锌 与硫酸铜反应生成硫酸锌和铜,充分反应后过滤,得到滤渣和滤液。将滤渣洗净, 滴入稀硫酸,有气泡产生,说明滤渣中至少含有铜和锌,则滤液中一定含有的溶质 是镁与硫酸铜反应生成的硫酸镁。 12.答案:(1)催化作用(2)Fe203+3H2S0.一Fe2(SO4)3+3H20(3)① 通电 FeC[或:FeSO4、FeNO3)2]②2 NaCI(熔融)2Na+Ch↑
9.D 10.D 由于铜和银的活动性都小于氢,所以都不会发生反应,A 错误;分别将质量 相同的铝丝和镁片引燃,插入盛有氧气的集气瓶中,由于金属的形状不同,无法得 出两种金属的活动性强弱,B 错误;铁的金属活动性比铜强,能与硫酸铜溶液发生 置换反应,将铁丝放入硫酸铜溶液中,铁的表面会覆盖一层紫红色物质,说明了金 属活动性 Fe>Cu,C 错误;分别将形状、大小相同的锌片、铁片放入相同浓度的稀 硫酸中,锌片比铁片产生气泡的速率更快,说明锌的金属活动性比铁的强,即 Zn>Fe,D 正确。 11.答案:(1)导电 4Al+3O2 2Al2O3 (2)Fe2O3+3CO 2Fe+3CO2 保持铁制品表面干燥[或:铁制品表面涂保护膜(刷 漆、涂油)](答案合理即可) (3)镁 MgSO4 解析:(1)用铜作电线是利用了金属铜的导电性;铝在空气中与氧气反应,生成氧化 铝,反应的化学方程式为 4Al+3O2 2Al2O3。 (2)一氧化碳与氧化铁的反应,即高温条件下氧化铁与一氧化碳反应生成铁和二氧 化碳,该反应的化学方程式为 Fe2O3+3CO 2Fe+3CO2;生活中铁制品的防锈措施 有保持铁制品表面干燥、铁制品表面涂保护膜(刷漆、涂油)等。 (3)解:设 13 g 锌、13 g 镁分别与稀盐酸反应生成氢气的质量为 x、y。 Zn+2HCl ZnCl2+H2↑ 65 2 13 g x 65 2 = 13 g 𝑥 x=0.4 g Mg+2HCl MgCl2+H2↑ 24 2 13 g y 24 2 = 13 g 𝑦 y=1.08 g 由以上质量关系可知,13 g 镁和锌的混合物完全反应生成氢气的质量大于 0.4 g,13 g 铜和锌的混合物完全反应生成氢气的质量小于 0.4 g,取该样品 13 g 与足 量稀盐酸充分反应,生成氢气 0.42 g,该锌粉中含有的杂质是镁; 另取一定量该样品放入硫酸铜溶液中,镁先与硫酸铜反应生成硫酸镁和铜,然后锌 与硫酸铜反应生成硫酸锌和铜,充分反应后过滤,得到滤渣和滤液。将滤渣洗净, 滴入稀硫酸,有气泡产生,说明滤渣中至少含有铜和锌,则滤液中一定含有的溶质 是镁与硫酸铜反应生成的硫酸镁。 12.答案:(1)催化作用 (2)Fe2O3+3H2SO4 Fe2(SO4)3+3H2O (3)① FeCl2[或:FeSO4、Fe(NO3)2] ②2NaCl(熔融) 2Na+Cl2↑

解析:(1)实验室用氯酸钾和二氧化锰混合制取氧气,二氧化锰的作用是催化作 用。(2)氧化铁与硫酸反应生成硫酸铁和水,配平即可。(3)①现有铁、铜、锌 三种金属,用亚铁的盐溶液可以验证三种金属的活动性顺序。②工业上常用电 解熔融状态的氯化钠制取单质钠,并产生氯气(C2),配平即可。 13.答案:(1)Fe+CuSO4一FeSO4+Cu (2)Al2(SO4)3、FeSO4(3)除去铜粉中混有的铁粉 14.答案:(1)①瓶底炸裂②Fe+CuSO4一FeSO4+Cu③将铜丝伸入硝酸银溶液 中 (2)①红棕色粉末变成黑色②收集尾气中的一氧化碳,防止污染空气③熄灭酒 精喷灯 解析(1)①集气瓶瓶底没有盛少量水或铺少量细沙,所以实验结束后,可能产生的 不良后果是瓶底炸裂。②铁与硫酸铜反应生成硫酸亚铁和铜。 ③由实验二可知,铁比铜、银活泼,所以要比较铁、铜、银三种金属的活动性强 弱,还需补充完成的实验是将铜丝伸入硝酸银溶液中。(2)①一氧化碳与氧化铁 在高温的条件下生成铁和二氧化碳,所以实验中可看到A处玻璃管里的现象是红 棕色粉末变成黑色。②一氧化碳难溶于水,所以该实验中,盛满澄清石灰水的装 置除了可验证反应生成了二氧化碳并将其吸收外,还能起到的作用是收集尾气中 的一氧化碳,防止污染空气。③实验结束后应先熄灭酒精喷灯,防止液体倒吸, 炸裂玻璃管。 15.答案:解:设参加反应的铁的质量为x。 Fe+H2SO.—FeSO4+H↑ 56 2 分 02g x=5.6g 该铁合金中的含碳量为5856邑×100%3.4%. 5.8g 2%<3.4%<4.3%,故该铁合金是生铁
解析:(1)实验室用氯酸钾和二氧化锰混合制取氧气,二氧化锰的作用是催化作 用。 (2)氧化铁与硫酸反应生成硫酸铁和水,配平即可。 (3)①现有铁、铜、锌 三种金属,用亚铁的盐溶液可以验证三种金属的活动性顺序。 ②工业上常用电 解熔融状态的氯化钠制取单质钠,并产生氯气(Cl2),配平即可。 13.答案:(1)Fe+CuSO4 FeSO4+Cu (2)Al2(SO4)3、FeSO4 (3)除去铜粉中混有的铁粉 14.答案:(1)①瓶底炸裂 ②Fe+CuSO4 FeSO4+Cu ③将铜丝伸入硝酸银溶液 中 (2)①红棕色粉末变成黑色 ②收集尾气中的一氧化碳,防止污染空气 ③熄灭酒 精喷灯 解析:(1)①集气瓶瓶底没有盛少量水或铺少量细沙,所以实验结束后,可能产生的 不良后果是瓶底炸裂。 ②铁与硫酸铜反应生成硫酸亚铁和铜。 ③由实验二可知,铁比铜、银活泼,所以要比较铁、铜、银三种金属的活动性强 弱,还需补充完成的实验是将铜丝伸入硝酸银溶液中。 (2)①一氧化碳与氧化铁 在高温的条件下生成铁和二氧化碳,所以实验中可看到 A 处玻璃管里的现象是红 棕色粉末变成黑色。 ②一氧化碳难溶于水,所以该实验中,盛满澄清石灰水的装 置除了可验证反应生成了二氧化碳并将其吸收外,还能起到的作用是收集尾气中 的一氧化碳,防止污染空气。 ③实验结束后应先熄灭酒精喷灯,防止液体倒吸, 炸裂玻璃管。 15.答案:解:设参加反应的铁的质量为 x。 Fe+H2SO4 FeSO4+H2↑ 56 2 x 0.2 g 56 2 = 𝑥 0.2 g x=5.6 g 该铁合金中的含碳量为5.8 g-5.6 g 5.8 g ×100%≈3.4%。 2%<3.4%<4.3%,故该铁合金是生铁