
第十单元检测 一、选择题(每题3分,共30分) 1.实验室中下列物质不需要密封保存的是( A石灰石 B.生石灰 C.氢氧化钠 D.浓盐酸 2.土壤的酸碱度会影响植物的生长,下列植物在微酸性土壤中不适宜种植的是 ) 植 物 花生 苹果 西瓜 沙枣 适宜的pH范围 5.0-6.0 5.06.5 6.0-7.0 8.0-8.7 A.花生 B.苹果 C.西瓜 D.沙枣 3.食醋里通常含有3%~5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清 石灰水变浑浊的气体。下列说法不正确的是( ) A.产生的气体是二氧化碳 B.加水稀释食醋,溶液pH变小 C.醋酸在水溶液里能解离出H+D.不宜用铝制容器盛装食醋 4.下列有关实验现象的描述正确的是()。 A.小木棍蘸取浓硫酸一段时间后,小木棍变黑 B.硝酸铵固体溶于水后,溶液的温度几乎不变 C.氢氧化钠固体久置于表面皿上无明显变化 D.打开盛浓硫酸的瓶盖,产生刺激性气味的气体 5.“××洁厕精”产品特性或使用注意事项如下:①轻松去除锈迹:②勿与碱性物质混 合使用:③不适用于大理石地面。其中,与洁厕精含有盐酸有关的是( ) A.③ B.①② C.②③ D.①②③ 6.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是 (). A.CO2 B.CaO C.Cu(NO3)2 D.HCI 7.下列说法错误的是( A.用pH试纸测得醋酸溶液的pH为9 B.用稀盐酸除去铁表面的铁锈 C.用熟石灰改良酸性土壤 D浓硫酸有吸水性,可用作干燥剂 8.物质在发生化学变化时常伴随着一些现象,下列需要借助酸碱指示剂才能观察 到化学反应发生的是()
第十单元检测 一、选择题(每题 3 分,共 30 分) 1.实验室中下列物质不需要密封保存的是( )。 A.石灰石 B.生石灰 C.氢氧化钠 D.浓盐酸 2.土壤的酸碱度会影响植物的生长,下列植物在微酸性土壤中不适宜种植的是 ( )。 植 物 花生 苹果 西瓜 沙枣 适宜的 pH 范围 5.0~6.0 5.0~6.5 6.0~7.0 8.0~8.7 A.花生 B.苹果 C.西瓜 D.沙枣 3.食醋里通常含有 3%~5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清 石灰水变浑浊的气体。下列说法不正确的是( )。 A.产生的气体是二氧化碳 B.加水稀释食醋,溶液 pH 变小 C.醋酸在水溶液里能解离出 H+ D.不宜用铝制容器盛装食醋 4.下列有关实验现象的描述正确的是( )。 A.小木棍蘸取浓硫酸一段时间后,小木棍变黑 B.硝酸铵固体溶于水后,溶液的温度几乎不变 C.氢氧化钠固体久置于表面皿上,无明显变化 D.打开盛浓硫酸的瓶盖,产生刺激性气味的气体 5.“××洁厕精”产品特性或使用注意事项如下:①轻松去除锈迹;②勿与碱性物质混 合使用;③不适用于大理石地面。其中,与洁厕精含有盐酸有关的是( )。 A.③ B.①② C.②③ D.①②③ 6.在 Ca(OH)2 的饱和溶液中加入下列物质,冷却至室温,溶液的 pH 没有改变的是 ( )。 A.CO2 B.CaO C.Cu(NO3)2 D.HCl 7.下列说法错误的是( )。 A.用 pH 试纸测得醋酸溶液的 pH 为 9 B.用稀盐酸除去铁表面的铁锈 C.用熟石灰改良酸性土壤 D.浓硫酸有吸水性,可用作干燥剂 8.物质在发生化学变化时常伴随着一些现象,下列需要借助酸碱指示剂才能观察 到化学反应发生的是( )
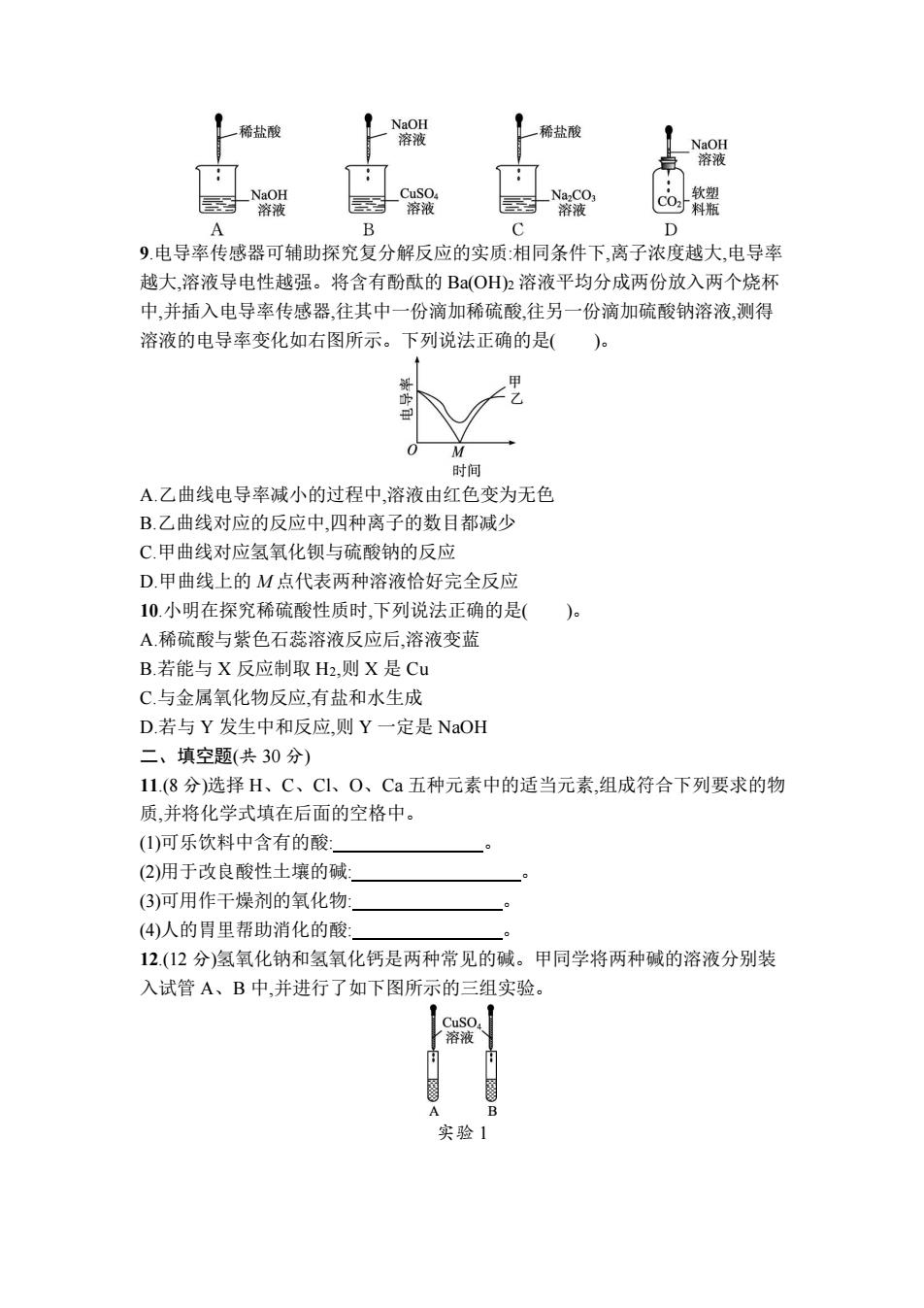
稀盐酸 NaOH 溶液 稀盐酸 NaOH 溶液 NaOH Na.CO 软塑 溶液 溶液 溶液 CO料瓶 B D 9.电导率传感器可辅助探究复分解反应的实质:相同条件下,离子浓度越大,电导率 越大,溶液导电性越强。将含有酚酞的B(OH)2溶液平均分成两份放入两个烧杯 中,并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得 溶液的电导率变化如右图所示。下列说法正确的是( 0■ M 时间 A.乙曲线电导率减小的过程中,溶液由红色变为无色 B.乙曲线对应的反应中,四种离子的数目都减少 C.甲曲线对应氢氧化钡与硫酸钠的反应 D.甲曲线上的M点代表两种溶液恰好完全反应 10.小明在探究稀硫酸性质时,下列说法正确的是( A.稀硫酸与紫色石蕊溶液反应后,溶液变蓝 B.若能与X反应制取H2,则X是Cu C.与金属氧化物反应,有盐和水生成 D若与Y发生中和反应,则Y一定是NaOH 二、填空题(共30分) 11.(8分)选择H、C、Cl、O、Ca五种元素中的适当元素,组成符合下列要求的物 质,并将化学式填在后面的空格中。 (1)可乐饮料中含有的酸: (2)用于改良酸性土壤的碱: (3)可用作干燥剂的氧化物: (4)人的胃里帮助消化的酸 12.(12分)氢氧化钠和氢氧化钙是两种常见的碱。甲同学将两种碱的溶液分别装 入试管A、B中,并进行了如下图所示的三组实验。 CuSO 溶液 A B 实验1
9.电导率传感器可辅助探究复分解反应的实质:相同条件下,离子浓度越大,电导率 越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份放入两个烧杯 中,并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得 溶液的电导率变化如右图所示。下列说法正确的是( )。 A.乙曲线电导率减小的过程中,溶液由红色变为无色 B.乙曲线对应的反应中,四种离子的数目都减少 C.甲曲线对应氢氧化钡与硫酸钠的反应 D.甲曲线上的 M 点代表两种溶液恰好完全反应 10.小明在探究稀硫酸性质时,下列说法正确的是( )。 A.稀硫酸与紫色石蕊溶液反应后,溶液变蓝 B.若能与 X 反应制取 H2,则 X 是 Cu C.与金属氧化物反应,有盐和水生成 D.若与 Y 发生中和反应,则 Y 一定是 NaOH 二、填空题(共 30 分) 11.(8 分)选择 H、C、Cl、O、Ca 五种元素中的适当元素,组成符合下列要求的物 质,并将化学式填在后面的空格中。 (1)可乐饮料中含有的酸: 。 (2)用于改良酸性土壤的碱: 。 (3)可用作干燥剂的氧化物: 。 (4)人的胃里帮助消化的酸: 。 12.(12 分)氢氧化钠和氢氧化钙是两种常见的碱。甲同学将两种碱的溶液分别装 入试管 A、B 中,并进行了如下图所示的三组实验。 实验 1
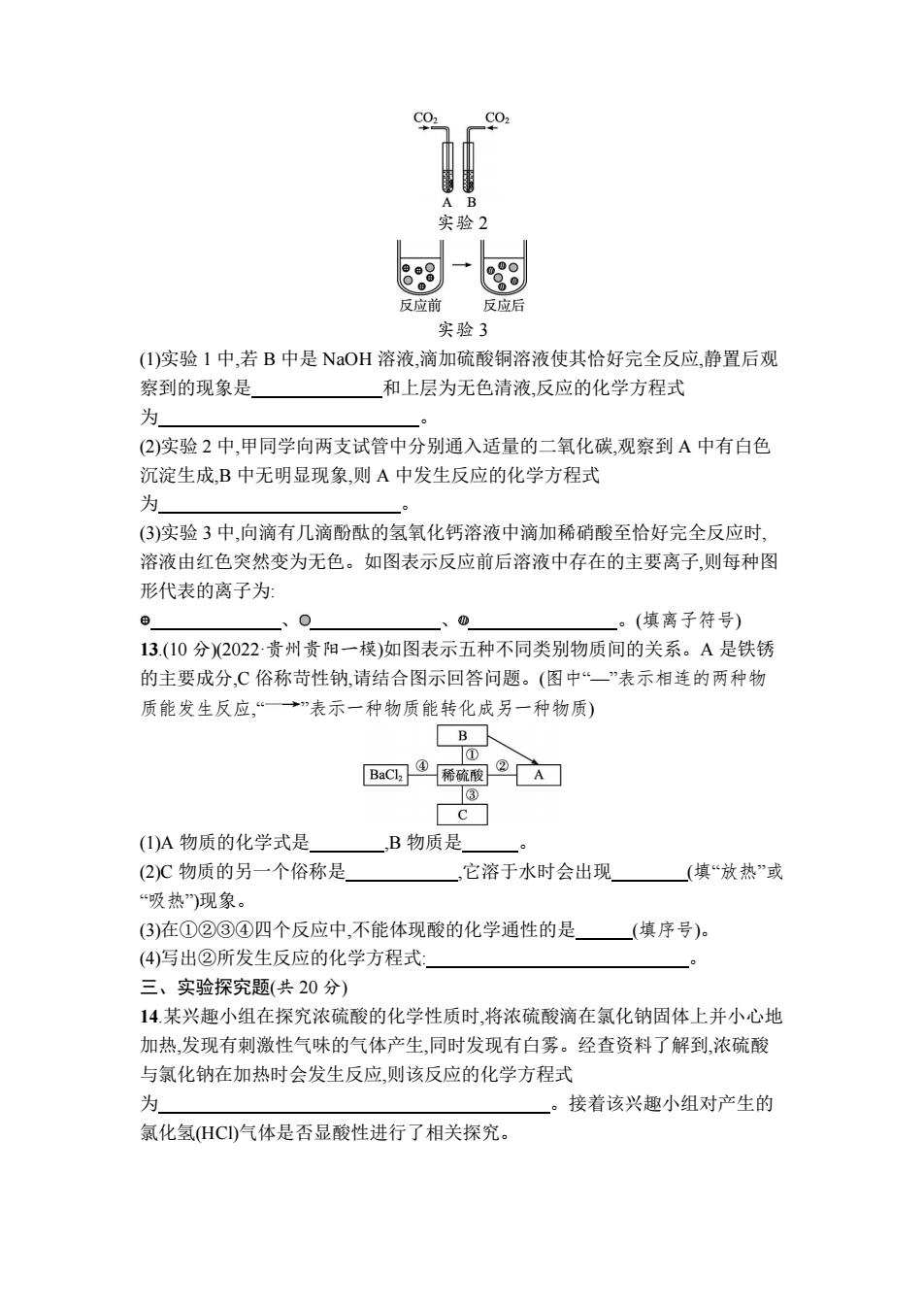
CO 实验2 反应前 反应后 实验3 (I)实验1中,若B中是NaOH溶液,滴加硫酸铜溶液使其恰好完全反应,静置后观 察到的现象是 和上层为无色清液,反应的化学方程式 为 (2)实验2中,甲同学向两支试管中分别通入适量的二氧化碳,观察到A中有白色 沉淀生成,B中无明显现象,则A中发生反应的化学方程式 为 (3)实验3中,向滴有几滴酚酞的氢氧化钙溶液中滴加稀硝酸至恰好完全反应时, 溶液由红色突然变为无色。如图表示反应前后溶液中存在的主要离子,则每种图 形代表的离子为 。(填离子符号) 13.(10分)2022贵州贵阳一模)如图表示五种不同类别物质间的关系。A是铁锈 的主要成分,C俗称苛性钠,请结合图示回答问题。(图中“一”表示相连的两种物 质能发生反应,“一→”表示一种物质能转化成另一种物质) B ① BaC④稀硫履 ③ c (1)A物质的化学式是 ,B物质是 (2)C物质的另一个俗称是 它溶于水时会出现 (填“放热”或 “吸热”)现象。 (3)在①②③④四个反应中,不能体现酸的化学通性的是 (填序号)。 (4)写出②所发生反应的化学方程式: 三、实验探究题(共20分) 14.某兴趣小组在探究浓硫酸的化学性质时,将浓硫酸滴在氯化钠固体上并小心地 加热,发现有刺激性气味的气体产生,同时发现有白雾。经查资料了解到,浓硫酸 与氯化钠在加热时会发生反应,则该反应的化学方程式 为 接着该兴趣小组对产生的 氯化氢HC)气体是否显酸性进行了相关探究
实验 2 实验 3 (1)实验 1 中,若 B 中是 NaOH 溶液,滴加硫酸铜溶液使其恰好完全反应,静置后观 察到的现象是 和上层为无色清液,反应的化学方程式 为 。 (2)实验 2 中,甲同学向两支试管中分别通入适量的二氧化碳,观察到 A 中有白色 沉淀生成,B 中无明显现象,则 A 中发生反应的化学方程式 为 。 (3)实验 3 中,向滴有几滴酚酞的氢氧化钙溶液中滴加稀硝酸至恰好完全反应时, 溶液由红色突然变为无色。如图表示反应前后溶液中存在的主要离子,则每种图 形代表的离子为: 、 、 。(填离子符号) 13.(10 分)(2022·贵州贵阳一模)如图表示五种不同类别物质间的关系。A 是铁锈 的主要成分,C 俗称苛性钠,请结合图示回答问题。(图中“—”表示相连的两种物 质能发生反应,“ ”表示一种物质能转化成另一种物质) (1)A 物质的化学式是 ,B 物质是 。 (2)C 物质的另一个俗称是 ,它溶于水时会出现 (填“放热”或 “吸热”)现象。 (3)在①②③④四个反应中,不能体现酸的化学通性的是 (填序号)。 (4)写出②所发生反应的化学方程式: 。 三、实验探究题(共 20 分) 14.某兴趣小组在探究浓硫酸的化学性质时,将浓硫酸滴在氯化钠固体上并小心地 加热,发现有刺激性气味的气体产生,同时发现有白雾。经查资料了解到,浓硫酸 与氯化钠在加热时会发生反应,则该反应的化学方程式 为 。接着该兴趣小组对产生的 氯化氢(HCl)气体是否显酸性进行了相关探究
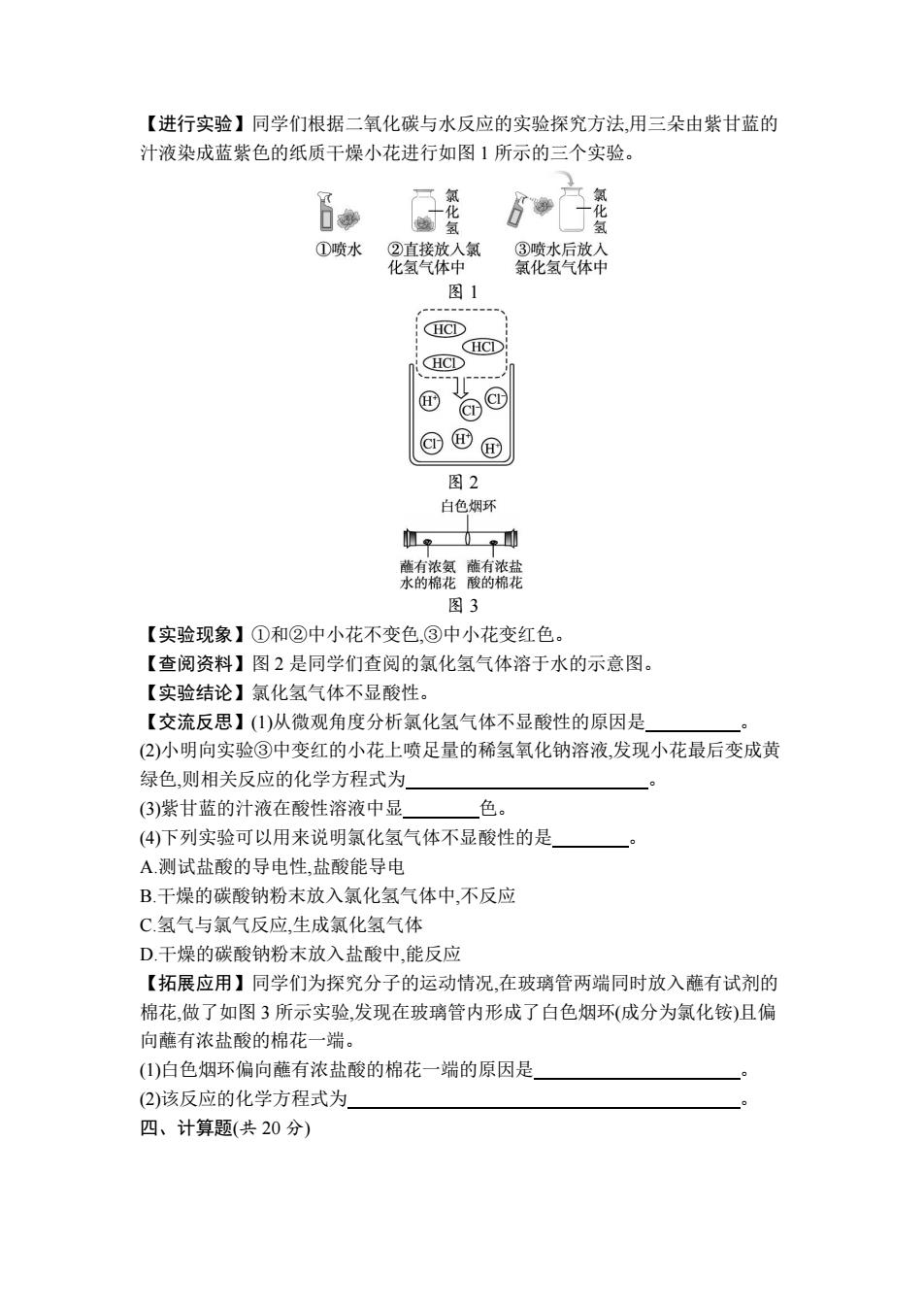
【进行实验】同学们根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的 汁液染成蓝紫色的纸质干燥小花进行如图1所示的三个实验。 化 氢 ①喷水 ②直接放入氯 ③喷水后放入 化氢气体中 氯化氢气体中 图1 CHCD CHCD HC① @c @ ⑧国 图2 白色烟环 单 0 蘸有浓氨蘸有浓盐 水的棉花酸的棉花 图3 【实验现象】①和②中小花不变色,③中小花变红色。 【查阅资料】图2是同学们查阅的氯化氢气体溶于水的示意图。 【实验结论】氯化氢气体不显酸性。 【交流反思】()从微观角度分析氯化氢气体不显酸性的原因是 (2)小明向实验③中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄 绿色,则相关反应的化学方程式为 (3)紫甘蓝的汁液在酸性溶液中显 色。 (4)下列实验可以用来说明氯化氢气体不显酸性的是 A.测试盐酸的导电性,盐酸能导电 B.干燥的碳酸钠粉末放入氯化氢气体中,不反应 C氢气与氯气反应,生成氯化氢气体 D.干燥的碳酸钠粉末放入盐酸中,能反应 【拓展应用】同学们为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的 棉花,做了如图3所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏 向蘸有浓盐酸的棉花一端。 (1)白色烟环偏向蘸有浓盐酸的棉花一端的原因是 (2)该反应的化学方程式为 四、计算题(共20分)
【进行实验】同学们根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的 汁液染成蓝紫色的纸质干燥小花进行如图 1 所示的三个实验。 图 1 图 2 图 3 【实验现象】①和②中小花不变色,③中小花变红色。 【查阅资料】图 2 是同学们查阅的氯化氢气体溶于水的示意图。 【实验结论】氯化氢气体不显酸性。 【交流反思】(1)从微观角度分析氯化氢气体不显酸性的原因是 。 (2)小明向实验③中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄 绿色,则相关反应的化学方程式为 。 (3)紫甘蓝的汁液在酸性溶液中显 色。 (4)下列实验可以用来说明氯化氢气体不显酸性的是 。 A.测试盐酸的导电性,盐酸能导电 B.干燥的碳酸钠粉末放入氯化氢气体中,不反应 C.氢气与氯气反应,生成氯化氢气体 D.干燥的碳酸钠粉末放入盐酸中,能反应 【拓展应用】同学们为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的 棉花,做了如图 3 所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏 向蘸有浓盐酸的棉花一端。 (1)白色烟环偏向蘸有浓盐酸的棉花一端的原因是 。 (2)该反应的化学方程式为 。 四、计算题(共 20 分)

15.(2022贵州毕节一模)常温下,在200g氢氧化钡和氢氧化钠的混合溶液中,逐滴 加入19.6%的稀硫酸。已知:发生的反应是Ba(OH)2+H2SO一BaSO4+2H20和 2NaOH+H2SO一Na2SO4+2H2O:滴加稀硫酸的质量与生成沉淀质量的变化关系 如图所示,当滴加稀疏酸的质量为300g时,溶液的pH=7。请计算: 46.6 0 100 滴加稀硫酸的质量g (1)与氢氧化钠反应的稀硫酸的质量为一g。 (2)原混合溶液中氢氧化钡的质量为 (3)当pH=7时,所得溶液中溶质的质量分数。(计算结果精确到0.1%) 答案: 1.A2.D 3B能使澄清石灰水变浑浊的气体是二氧化碳,A正确:加水稀释酸,溶液的酸性 减弱,pH会变大,B错误;醋酸显酸性,酸在溶液中都能解离出H,C正确;酸能与较 活泼的金属反应,不宜用铝制容器盛装食醋,D正确。 4.A5D 6B二氧化碳能与氢氧化钙反应,溶液的pH会减小,A错误;氧化钙溶于水生成 氢氧化钙,恢复到室温时溶液的pH不会改变,B正确:硝酸铜能与氢氧化钙反应生 成氢氧化铜沉淀,溶液的pH会减小,C错误:HCI能与氢氧化钙反应生成水,溶液的 pH会减小,D错误。 7.A 8.A氢氧化钠与稀盐酸反应的产物是氯化钠和水,没有明显反应现象,因此需通 过观察酚酞等指示剂的颜色变化判断反应是否发生,A正确:硫酸铜与氢氧化钠溶 液反应产生蓝色沉淀,B错误:碳酸钠与稀盐酸反应产生大量的气泡,C错误:氢氧 化钠溶液吸收二氧化碳后使瓶中的压强减小,可观察到软塑料瓶变瘪,D错误。 9D氢氧化钡与稀硫酸反应生成了硫酸钡沉淀和水,恰好反应时,溶液的电导率 为0:氢氧化钡与硫酸钠反应生成了硫酸钡沉淀和氢氧化钠,溶液始终显碱性。由 此可知,甲曲线为加入稀硫酸的曲线,乙曲线为加入硫酸钠溶液的曲线,C错误;乙 曲线电导率减小的过程中,溶液红色不变,A错误;乙曲线对应的反应中钡离子、 硫酸根离子数目都减少,氢氧根离子、钠离子数目不变,B错误;甲曲线上的M点 代表两种溶液恰好完全反应,D正确。 10.C稀硫酸与紫色石蕊溶液反应后,溶液变红色,A说法错误;若能与X反应制 取H2,则X不可能是铜,在金属活动性顺序中,铜的位置排在氢的后面,不与稀硫酸
15.(2022·贵州毕节一模)常温下,在 200 g 氢氧化钡和氢氧化钠的混合溶液中,逐滴 加入 19.6%的稀硫酸。已知:发生的反应是 Ba(OH)2+H2SO4 BaSO4↓+2H2O 和 2NaOH+H2SO4 Na2SO4+2H2O;滴加稀硫酸的质量与生成沉淀质量的变化关系 如图所示;当滴加稀硫酸的质量为 300 g 时,溶液的 pH=7。请计算: (1)与氢氧化钠反应的稀硫酸的质量为 g。 (2)原混合溶液中氢氧化钡的质量为 g。 (3)当 pH=7 时,所得溶液中溶质的质量分数。(计算结果精确到 0.1%) 答案: 1.A 2.D 3.B 能使澄清石灰水变浑浊的气体是二氧化碳,A 正确;加水稀释酸,溶液的酸性 减弱,pH 会变大,B 错误;醋酸显酸性,酸在溶液中都能解离出 H+ ,C 正确;酸能与较 活泼的金属反应,不宜用铝制容器盛装食醋,D 正确。 4.A 5.D 6.B 二氧化碳能与氢氧化钙反应,溶液的 pH 会减小,A 错误;氧化钙溶于水生成 氢氧化钙,恢复到室温时溶液的 pH 不会改变,B 正确;硝酸铜能与氢氧化钙反应生 成氢氧化铜沉淀,溶液的 pH 会减小,C 错误;HCl 能与氢氧化钙反应生成水,溶液的 pH 会减小,D 错误。 7.A 8.A 氢氧化钠与稀盐酸反应的产物是氯化钠和水,没有明显反应现象,因此需通 过观察酚酞等指示剂的颜色变化判断反应是否发生,A 正确;硫酸铜与氢氧化钠溶 液反应产生蓝色沉淀,B 错误;碳酸钠与稀盐酸反应产生大量的气泡,C 错误;氢氧 化钠溶液吸收二氧化碳后使瓶中的压强减小,可观察到软塑料瓶变瘪,D 错误。 9.D 氢氧化钡与稀硫酸反应生成了硫酸钡沉淀和水,恰好反应时,溶液的电导率 为 0;氢氧化钡与硫酸钠反应生成了硫酸钡沉淀和氢氧化钠,溶液始终显碱性。由 此可知,甲曲线为加入稀硫酸的曲线,乙曲线为加入硫酸钠溶液的曲线,C 错误;乙 曲线电导率减小的过程中,溶液红色不变,A 错误;乙曲线对应的反应中钡离子、 硫酸根离子数目都减少,氢氧根离子、钠离子数目不变,B 错误;甲曲线上的 M 点 代表两种溶液恰好完全反应,D 正确。 10.C 稀硫酸与紫色石蕊溶液反应后,溶液变红色,A 说法错误;若能与 X 反应制 取 H2,则 X 不可能是铜,在金属活动性顺序中,铜的位置排在氢的后面,不与稀硫酸

反应,B说法错误:稀硫酸与金属氧化物反应,有盐和水生成,C说法正确:若与Y发 生中和反应,Y不一定是NaOH,也可能是氢氧化钙等碱,D说法错误。 11.答案:(1)H2CO3(2)Ca(OH2(3)CaO (4)HC1 12.答案:(1)下层为蓝色沉淀2NaOH+CuSO一Cu(OH)2J+Na2SO4 (2)Ca(OH)2+CO2-CaCO3J+H2O (3)OH Ca2+NO; 解析(1)实验1中,若B中是NOH溶液,滴加硫酸铜溶液使其恰好完全反应,氢氧 化钠与硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,静置后观察现象,其中一个现 象是产生了蓝色沉淀。(2)实验2中,甲同学向两支试管中分别通入适量的二氧 化碳,A中有白色沉淀生成,说明A中是氢氧化钙溶液,据此书写化学方程式。 (3)实验3中,向滴有几滴酚酞的氢氧化钙溶液中滴加稀硝酸至恰好完全反应时, 溶液由红色突然变为无色。滴加前,溶液中含有钙离子、氢氧根离子:滴加后,溶 液中含有钙离子、硝酸根离子。故©是氢氧根离子○是钙离子0是硝酸根离子。 13.答案:(1)Fe2O3铁(或:Fe) (2)火碱(或:烧碱)放热(3)④ (4)Fe2O3+3H2S0.一Fe2(S04)3+3HO 解析:(1)A是铁锈的主要成分,则A是氧化铁,其化学式是F2O3:B能与稀硫酸反 应,能生成氧化铁,则B为铁。 (2)C俗称苛性钠,C物质的另一个俗称是火碱(或:烧碱):它溶于水时会出现放热现 象。 (3)在①②③④四个反应中,不能体现酸的化学通性的是④,因为稀盐酸不能与氯 化钡溶液反应。 (4)②是氧化铁与稀硫酸反应生成硫酸铁和水,反应的化学方程式是 Fe2O3+3H2SO.—Fe2SO4)3+3H2O。 14.答案H2SO4(浓+2NaCL△Na2S04+2HCIt 【交流反思】(1)氯化氢气体是由氯化氢分子构成的,在氯化氢气体中没有解离出 的氢离子,所以氯化氢气体不显酸性 (2)NaOH+HCINaCH+H2O (3)红 (4)B 【拓展应用】()氨分子的运动速率大于氯化氢分子的运动速率 (2)NH3+HCI-NH4CI 解析:将浓硫酸滴在氯化钠固体上并小心地加热,发现有刺激性气味的气体产生, 同时发现有白雾,说明浓硫酸与氯化钠在加热时会发生反应,生成硫酸钠和氯化氢 气体,反应的化学方程式为H2SO4(浓)H2NaC.二Na2SO4+2HCI↑。【交流反 思】(1)溶液显酸性,是因为溶液中含有自由移动的氢离子,因此从微观角度分析 氯化氢气体不显酸性的原因是:氯化氢气体中的氯化氢分子不能解离出自由移动
反应,B 说法错误;稀硫酸与金属氧化物反应,有盐和水生成,C 说法正确;若与 Y 发 生中和反应,Y 不一定是 NaOH,也可能是氢氧化钙等碱,D 说法错误。 11.答案:(1)H2CO3 (2)Ca(OH)2 (3)CaO (4)HCl 12.答案:(1)下层为蓝色沉淀 2NaOH+CuSO4 Cu(OH)2↓+Na2SO4 (2)Ca(OH)2+CO2 CaCO3↓+H2O (3)OH- Ca2+ NO3 - 解析:(1)实验 1 中,若 B 中是 NaOH 溶液,滴加硫酸铜溶液使其恰好完全反应,氢氧 化钠与硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,静置后观察现象,其中一个现 象是产生了蓝色沉淀。 (2)实验 2 中,甲同学向两支试管中分别通入适量的二氧 化碳,A 中有白色沉淀生成,说明 A 中是氢氧化钙溶液,据此书写化学方程式。 (3)实验 3 中,向滴有几滴酚酞的氢氧化钙溶液中滴加稀硝酸至恰好完全反应时, 溶液由红色突然变为无色。滴加前,溶液中含有钙离子、氢氧根离子;滴加后,溶 液中含有钙离子、硝酸根离子。故 是氢氧根离子, 是钙离子, 是硝酸根离子。 13.答案:(1)Fe2O3 铁(或:Fe) (2)火碱(或:烧碱) 放热 (3)④ (4)Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 解析:(1)A 是铁锈的主要成分,则 A 是氧化铁,其化学式是 Fe2O3;B 能与稀硫酸反 应,能生成氧化铁,则 B 为铁。 (2)C 俗称苛性钠,C 物质的另一个俗称是火碱(或:烧碱);它溶于水时会出现放热现 象。 (3)在①②③④四个反应中,不能体现酸的化学通性的是④,因为稀盐酸不能与氯 化钡溶液反应。 (4)②是氧化铁与稀硫酸反应生成硫酸铁和水,反应的化学方程式是 Fe2O3+3H2SO4 Fe2(SO4)3+3H2O。 14.答案:H2SO4(浓)+2NaCl Na2SO4+2HCl↑ 【交流反思】(1)氯化氢气体是由氯化氢分子构成的,在氯化氢气体中没有解离出 的氢离子,所以氯化氢气体不显酸性 (2)NaOH+HCl NaCl+H2O (3)红 (4)B 【拓展应用】(1)氨分子的运动速率大于氯化氢分子的运动速率 (2)NH3+HCl NH4Cl 解析:将浓硫酸滴在氯化钠固体上并小心地加热,发现有刺激性气味的气体产生, 同时发现有白雾,说明浓硫酸与氯化钠在加热时会发生反应,生成硫酸钠和氯化氢 气体,反应的化学方程式为 H2SO4(浓)+2NaCl Na2SO4+2HCl↑。 【交流反 思】(1)溶液显酸性,是因为溶液中含有自由移动的氢离子,因此从微观角度分析 氯化氢气体不显酸性的原因是:氯化氢气体中的氯化氢分子不能解离出自由移动

的氢离子。(2)小明向实验③中变红的小花上喷足量的稀氢氧化钠溶液,发现小 花最后变成黄绿色,说明稀盐酸与氢氧化钠反应生成了氯化钠和水,反应的化学方 程式为NaOH+HC一NaC+H2O。(3)由实验现象可知,紫甘蓝的汁液在酸性溶 液中显红色。(4)测试盐酸的导电性,盐酸能导电,不能证明氯化氢气体不显酸 性,A错误:千燥的碳酸钠粉末放入氯化氢气体中不反应,说明氯化氢气体不显酸 性,B正确;氢气与氯气反应,生成氯化氢气体,不能证明氯化氢气体不显酸性,C错 误:干燥的碳酸钠粉末放入盐酸中能反应,但不能证明氯化氢气体不显酸性D错 误。【拓展应用】(1)白色烟环偏向蘸有浓盐酸的棉花一端,是由于氨分子的运 动速率大于氯化氢分子的运动速率。(2)氨气与氯化氢气体反应生成氯化铵,该 反应的化学方程式为NH3+HC一NH4C1。 15.答案:(1)200 (2)34.2 (3)12.5% 解析:(1)根据图像可知滴加100g稀硫酸时,氢氧化钡被完全消耗,当滴加稀硫酸 的质量为300g时,溶液的pH=7,与氢氧化钠反应的稀硫酸质量为300g-100 g=200g。 (2)解:设原混合溶液中氢氧化钡的质量为x。 Ba(OH)2+H2SO.BaSO4J+2H2O 171 233 46.6g = 23346.6g 3x=34.2g 原混合溶液中氢氧化钡的质量为34.2g。 (3)解:设当pH=7时生成硫酸钠的质量为y。 2NaOH+H2SO4 Na2SO4+2H20 98 142 200g×19.6% 98=200gX19.6% 142 y =56.8g 当pH=7时,溶液的质量为200g+300g-46.6g=453.4g 当pH=7时溶液中溶质的质量分数为68B×10012.5% 453.4g
的氢离子。 (2)小明向实验③中变红的小花上喷足量的稀氢氧化钠溶液,发现小 花最后变成黄绿色,说明稀盐酸与氢氧化钠反应生成了氯化钠和水,反应的化学方 程式为 NaOH+HCl NaCl+H2O。 (3)由实验现象可知,紫甘蓝的汁液在酸性溶 液中显红色。 (4)测试盐酸的导电性,盐酸能导电,不能证明氯化氢气体不显酸 性,A 错误;干燥的碳酸钠粉末放入氯化氢气体中不反应,说明氯化氢气体不显酸 性,B 正确;氢气与氯气反应,生成氯化氢气体,不能证明氯化氢气体不显酸性,C 错 误;干燥的碳酸钠粉末放入盐酸中能反应,但不能证明氯化氢气体不显酸性,D 错 误。 【拓展应用】(1)白色烟环偏向蘸有浓盐酸的棉花一端,是由于氨分子的运 动速率大于氯化氢分子的运动速率。 (2)氨气与氯化氢气体反应生成氯化铵,该 反应的化学方程式为 NH3+HCl NH4Cl。 15.答案:(1)200 (2)34.2 (3)12.5% 解析:(1)根据图像可知滴加 100 g 稀硫酸时,氢氧化钡被完全消耗,当滴加稀硫酸 的质量为 300 g 时,溶液的 pH=7,与氢氧化钠反应的稀硫酸质量为 300 g-100 g=200 g。 (2)解:设原混合溶液中氢氧化钡的质量为 x。 Ba(OH)2+H2SO4 BaSO4↓+2H2O 171 233 x 46.6 g 171 233 = 𝑥 46.6 g x=34.2 g 原混合溶液中氢氧化钡的质量为 34.2 g。 (3)解:设当 pH=7 时生成硫酸钠的质量为 y。 2NaOH+H2SO4 Na2SO4+2H2O 98 142 200 g×19.6% y 98 142 = 200 g×19.6% 𝑦 y=56.8 g 当 pH=7 时,溶液的质量为 200 g+300 g-46.6 g=453.4 g 当 pH=7 时溶液中溶质的质量分数为 56.8 g 453.4 g ×100%≈12.5%