
期末检测 一、选择题(每题3分,共30分) 1.下列物质中不属于合金的是( A.玻璃钢 B.黄铜 C.生铁 D.硬铝 2.农作物种植过程中可以施用下列化肥,其中属于复合肥料的是( A.NH4NO3 B.KNO3 C.Ca(H2PO4)2 D.CO(NH2)2 3.下列做法正确的是()。 A.用霉变的花生做食品 B.用甲醛溶液浸泡鱼虾防腐 C.食用加碘盐可补充人体缺乏的碘元素 D.食品中加入过量的亚硝酸钠 4.在实验室长期保存下列药品的方法中,不正确的是( A.氢氧化钠固体密封保存在试剂瓶中 B.硝酸银溶液密封保存在棕色试剂瓶中 C.浓盐酸密封保存在试剂瓶中 D.少量氨水保存在烧杯中 5某同学为了探究甲、乙、丙三种金属的活动性强弱,做了如下实验,则三种金属 的活动性顺序是( )。 实验步骤 实验现象 ①把甲、乙、丙三种金属分别加入稀硫酸甲、乙表面有气泡产生,丙无明显变 中 化 ②再把甲放入乙的硫酸盐溶液中 无明显现象 A.甲>乙>丙 B.乙>甲>丙 C.丙>甲>乙 D丙>乙>甲 6.(2022·贵州毕节中考)已知CaC2溶液显中性。向CaC2与盐酸混合溶液中逐滴 滴加Na2CO3溶液,边加边搅拌,用pH计测得混合溶液pH的变化如图所示。下列 相关叙述正确的是( Na,CO溶液质量/g A.实验中C的数目保持不变 B.AB对应反应为中和反应 C.BC对应反应无明显现象
期末检测 一、选择题(每题 3 分,共 30 分) 1.下列物质中不属于合金的是( )。 A.玻璃钢 B.黄铜 C.生铁 D.硬铝 2.农作物种植过程中可以施用下列化肥,其中属于复合肥料的是( )。 A.NH4NO3 B.KNO3 C.Ca(H2PO4)2 D.CO(NH2)2 3.下列做法正确的是( )。 A.用霉变的花生做食品 B.用甲醛溶液浸泡鱼虾防腐 C.食用加碘盐可补充人体缺乏的碘元素 D.食品中加入过量的亚硝酸钠 4.在实验室长期保存下列药品的方法中,不正确的是( )。 A.氢氧化钠固体密封保存在试剂瓶中 B.硝酸银溶液密封保存在棕色试剂瓶中 C.浓盐酸密封保存在试剂瓶中 D.少量氨水保存在烧杯中 5.某同学为了探究甲、乙、丙三种金属的活动性强弱,做了如下实验,则三种金属 的活动性顺序是( )。 实验步骤 实验现象 ①把甲、乙、丙三种金属分别加入稀硫酸 中 甲、乙表面有气泡产生,丙无明显变 化 ②再把甲放入乙的硫酸盐溶液中 无明显现象 A.甲>乙>丙 B.乙>甲>丙 C.丙>甲>乙 D.丙>乙>甲 6.(2022·贵州毕节中考)已知 CaCl2 溶液显中性。向 CaCl2 与盐酸混合溶液中逐滴 滴加 Na2CO3 溶液,边加边搅拌,用 pH 计测得混合溶液 pH 的变化如图所示。下列 相关叙述正确的是( )。 A.实验中 Cl-的数目保持不变 B.AB 对应反应为中和反应 C.BC 对应反应无明显现象
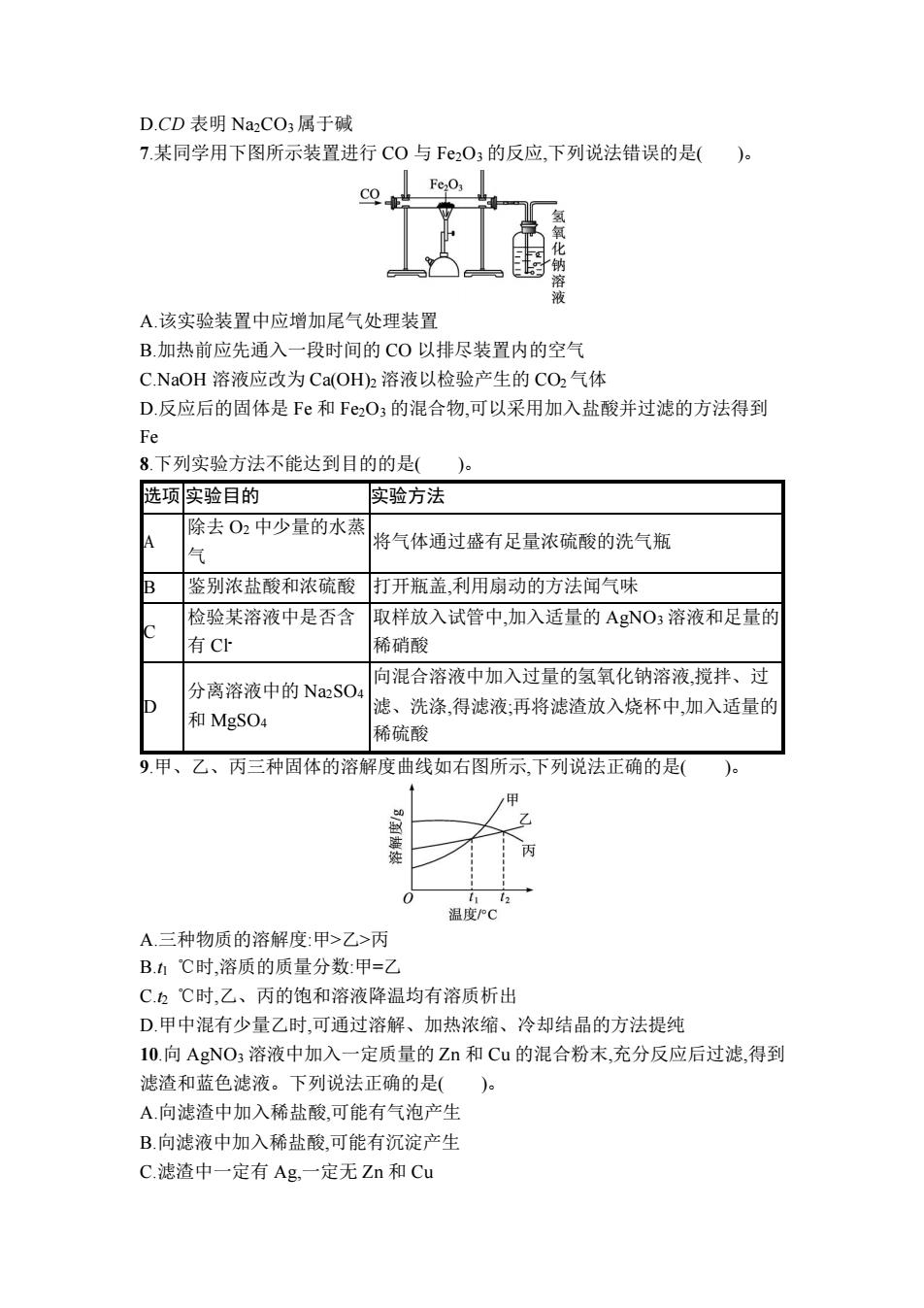
D.CD表明Na2CO3属于碱 7.某同学用下图所示装置进行CO与F2O3的反应,下列说法错误的是()。 化 溶 A.该实验装置中应增加尾气处理装置 B.加热前应先通入一段时间的CO以排尽装置内的空气 C.NaOH溶液应改为Ca(OH)h溶液以检验产生的CO2气体 D.反应后的固体是Fe和F2O3的混合物,可以采用加入盐酸并过滤的方法得到 Fe 8.下列实验方法不能达到目的的是( 选项实验目的 实验方法 除去O2中少量的水蒸 A 将气体通过盛有足量浓硫酸的洗气瓶 气 B 鉴别浓盐酸和浓硫酸 打开瓶盖,利用扇动的方法闻气味 检验某溶液中是否含 取样放入试管中,加入适量的AgNO3溶液和足量的 有C 稀硝酸 向混合溶液中加入过量的氢氧化钠溶液,搅拌、过 分离溶液中的Na2SO4 滤、洗涤得滤液:再将滤渣放入烧杯中,加入适量的 和MgSO4 稀硫酸 9.甲、乙、丙三种固体的溶解度曲线如右图所示,下列说法正确的是( 0 12 温度PC A.三种物质的溶解度:甲>乙>丙 B.1℃时,溶质的质量分数:甲=乙 C.2℃时,乙、丙的饱和溶液降温均有溶质析出 D.甲中混有少量乙时,可通过溶解、加热浓缩、冷却结晶的方法提纯 10.向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到 滤渣和蓝色滤液。下列说法正确的是()。 A.向滤渣中加入稀盐酸,可能有气泡产生 B.向滤液中加入稀盐酸,可能有沉淀产生 C.滤渣中一定有Ag,一定无Zn和Cu
D.CD 表明 Na2CO3属于碱 7.某同学用下图所示装置进行 CO 与 Fe2O3 的反应,下列说法错误的是( )。 A.该实验装置中应增加尾气处理装置 B.加热前应先通入一段时间的 CO 以排尽装置内的空气 C.NaOH 溶液应改为 Ca(OH)2 溶液以检验产生的 CO2气体 D.反应后的固体是 Fe 和 Fe2O3 的混合物,可以采用加入盐酸并过滤的方法得到 Fe 8.下列实验方法不能达到目的的是( )。 选项 实验目的 实验方法 A 除去 O2 中少量的水蒸 气 将气体通过盛有足量浓硫酸的洗气瓶 B 鉴别浓盐酸和浓硫酸 打开瓶盖,利用扇动的方法闻气味 C 检验某溶液中是否含 有 Cl- 取样放入试管中,加入适量的 AgNO3 溶液和足量的 稀硝酸 D 分离溶液中的 Na2SO4 和 MgSO4 向混合溶液中加入过量的氢氧化钠溶液,搅拌、过 滤、洗涤,得滤液;再将滤渣放入烧杯中,加入适量的 稀硫酸 9.甲、乙、丙三种固体的溶解度曲线如右图所示,下列说法正确的是( )。 A.三种物质的溶解度:甲>乙>丙 B.t1 ℃时,溶质的质量分数:甲=乙 C.t2 ℃时,乙、丙的饱和溶液降温均有溶质析出 D.甲中混有少量乙时,可通过溶解、加热浓缩、冷却结晶的方法提纯 10.向 AgNO3 溶液中加入一定质量的 Zn 和 Cu 的混合粉末,充分反应后过滤,得到 滤渣和蓝色滤液。下列说法正确的是( )。 A.向滤渣中加入稀盐酸,可能有气泡产生 B.向滤液中加入稀盐酸,可能有沉淀产生 C.滤渣中一定有 Ag,一定无 Zn 和 Cu

D.滤液中一定有CuNO32,可能有ZnNO32和AgNO 二、填空题(共30分) 11.(9分)文化的传承、科技的发展、新材料的研发等都离不开化学。 (1)酒酿造的发酵过程属于 (填“物理”或“化学)变化。酒在汽化的过程 中,分子间的间隔 (2)“元宵花灯”是我国非物质文化遗产,现常采用PMMA(塑料亚克力)替代传统材 料制作灯具外壳。PMMA材料具有 的优点,属于 (填“无机物”或“有机物)。 (3)“膜分离技术”可使二氧化碳穿过分离膜被氨水吸收,生成的碳酸氢铵 NH4HCO3)可用作化肥。碳酸氢铵属于 (填“氨肥磷肥“钾肥” 或“复合肥料)。 12.(12分)酸、碱、盐在工农业生产、生活中应用广泛,请回答下列问题。 (1)硫酸是一种重要的酸,在稀释浓硫酸时,应 盐酸、硫酸等酸具有相似的化学性质,是因为它们在水中都能够解离出酸根离子 和H,硫酸在水中解离的化学表达式为 (2)酸碱中和反应在实际中应用广泛。某校化学实验室废液呈酸性,应选用 (填一种指示剂)试剂检验该废液。若直接排放该废液会导致环境污染,从经济可 行的角度考虑,应选用 来处理该废液。 (3)小苏打是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过 多的一种药剂,该反应的化学方程式为 (4)现有BaNO32溶液、稀硫酸、Na2CO3溶液、KOH溶液和CuSO4溶液。下 列选项中能够与上述物质发生复分解反应并有沉淀生成的物质是 A稀盐酸 B.烧碱溶液 C.硝酸铵溶液 上述反应的化学方程式为 13.(9分)A、B、C三种固体物质的溶解度曲线如图所示,按要求回答下列问题: 50 温度PC (1)温度为 ℃时,A、C溶解度相同。 (2)2℃时,把30gB物质加到50g水中,充分溶解后所得溶液的溶质质量分数 是 (3)℃时,将等质量的A、B、C三种物质的饱和溶液降温至1℃,所得三种溶 液中溶剂质量的大小关系是 (用“>“<”或“=”连接)。 三、实验探究题(共20分)
D.滤液中一定有 Cu(NO3)2,可能有 Zn(NO3)2 和 AgNO3 二、填空题(共 30 分) 11.(9 分)文化的传承、科技的发展、新材料的研发等都离不开化学。 (1)酒酿造的发酵过程属于 (填“物理”或“化学”)变化。酒在汽化的过程 中,分子间的间隔 。 (2)“元宵花灯”是我国非物质文化遗产,现常采用 PMMA(塑料亚克力)替代传统材 料制作灯具外壳。PMMA 材料具有 的优点,属于 (填“无机物”或“有机物”)。 (3)“膜分离技术”可使二氧化碳穿过分离膜被氨水吸收,生成的碳酸氢铵 (NH4HCO3)可用作化肥。碳酸氢铵属于 (填“氮肥”“磷肥”“钾肥” 或“复合肥料”)。 12.(12 分)酸、碱、盐在工农业生产、生活中应用广泛,请回答下列问题。 (1)硫酸是一种重要的酸,在稀释浓硫酸时,应 。 盐酸、硫酸等酸具有相似的化学性质,是因为它们在水中都能够解离出酸根离子 和 H+ ,硫酸在水中解离的化学表达式为 。 (2)酸碱中和反应在实际中应用广泛。某校化学实验室废液呈酸性,应选用 (填一种指示剂)试剂检验该废液。若直接排放该废液会导致环境污染,从经济可 行的角度考虑,应选用 来处理该废液。 (3)小苏打是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过 多的一种药剂,该反应的化学方程式为 。 (4)现有 Ba(NO3)2 溶液、稀硫酸、Na2CO3溶液、KOH 溶液和 CuSO4溶液。 下 列选项中能够与上述物质发生复分解反应并有沉淀生成的物质是 。 A.稀盐酸 B.烧碱溶液 C.硝酸铵溶液 上述反应的化学方程式为 。 13.(9 分)A、B、C 三种固体物质的溶解度曲线如图所示,按要求回答下列问题: (1)温度为 ℃时,A、C 溶解度相同。 (2)t2 ℃时,把 30 g B 物质加到 50 g 水中,充分溶解后所得溶液的溶质质量分数 是 。 (3)t3 ℃时,将等质量的 A、B、C 三种物质的饱和溶液降温至 t1 ℃,所得三种溶 液中溶剂质量的大小关系是 (用“>”“<”或“=”连接)。 三、实验探究题(共 20 分)

14.小明在市场看到,卖鱼的人将一勺白色粉末加入水中后,水中奄奄一息的鱼很 快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探 究。 【查阅资料】这种“白色粉末”的主要成分是过碳酸钠(化学式为N2CO4),常温下, 与水反应生成氧气。 【实验1】小明选用如图所示装置中的 (填字母)进行过碳酸钠与水 的反应并收集产生的气体,经检验该气体是氧气,检验方法是 【提出问题】过碳酸钠与水反应后得到的溶液M中溶质的成分是什么? 【作出猜想】根据过碳酸钠与水的组成做出三种猜想。 猜想一Na2CO3。 猜想二NaOH。 猜想三:NaCO3和NaOH. 【实验2】小明取溶液M,滴加CaC2溶液,观察到有白色沉淀生成,他认为白色沉 淀是CaCO3,溶液中一定含有Na2CO3。小刚提出质疑,产生的白色沉淀不一定是 CaCO3,他的理由是 【实验3】小刚取溶液M,滴加稀盐酸,观察到 证明溶液 中一定含有Na2CO3,从而否定了猜想二。Na2CO3与稀盐酸反应的化学方程式 为 【实验4】为进一步确定溶液M中是否含有NaOH,他们向溶质M中滴加CaC2 溶液至不再产生沉淀为止,取上层溶液,加入 无明显 现象,证明溶液中无NaOH溶液,猜想一正确。该实验中用CaCh溶液而不用饱和 石灰水的原因是 【反思拓展】(1)根据过碳酸钠的性质,保存时应注意防潮。 (2)检验A、B两种物质是否同时存在,一定要考虑二者性质互相干扰的问题。 四、计算题(共20分) 15.将含有可溶性杂质的某氯化镁样品3g溶于足量水中得到不饱和溶液,再向所 得溶液中逐滴滴入200g一定溶质质量分数的AgNO3溶液(杂质不含镁元素且不 与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关 系如右图所示。试计算: 多 .74 0100200 滴入硝酸银溶液的质量g (1)恰好完全反应时生成沉淀的质量为 g
14.小明在市场看到,卖鱼的人将一勺白色粉末加入水中后,水中奄奄一息的鱼很 快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探 究。 【查阅资料】这种“白色粉末”的主要成分是过碳酸钠(化学式为 Na2CO4),常温下, 与水反应生成氧气。 【实验 1】小明选用如图所示装置中的 (填字母)进行过碳酸钠与水 的反应并收集产生的气体,经检验该气体是氧气,检验方法是 。 【提出问题】过碳酸钠与水反应后得到的溶液 M 中溶质的成分是什么? 【作出猜想】根据过碳酸钠与水的组成做出三种猜想。 猜想一:Na2CO3。 猜想二:NaOH。 猜想三:Na2CO3 和 NaOH。 【实验 2】小明取溶液 M,滴加 CaCl2 溶液,观察到有白色沉淀生成,他认为白色沉 淀是 CaCO3,溶液中一定含有 Na2CO3。小刚提出质疑,产生的白色沉淀不一定是 CaCO3,他的理由是 。 【实验 3】小刚取溶液 M,滴加稀盐酸,观察到 ,证明溶液 中一定含有 Na2CO3,从而否定了猜想二。Na2CO3与稀盐酸反应的化学方程式 为 。 【实验 4】为进一步确定溶液 M 中是否含有 NaOH,他们向溶质 M 中滴加 CaCl2 溶液至不再产生沉淀为止,取上层溶液,加入 ,无明显 现象,证明溶液中无 NaOH 溶液,猜想一正确。该实验中用 CaCl2 溶液而不用饱和 石灰水的原因是 。 【反思拓展】(1)根据过碳酸钠的性质,保存时应注意防潮。 (2)检验 A、B 两种物质是否同时存在,一定要考虑二者性质互相干扰的问题。 四、计算题(共 20 分) 15.将含有可溶性杂质的某氯化镁样品 3 g 溶于足量水中得到不饱和溶液,再向所 得溶液中逐滴滴入 200 g 一定溶质质量分数的 AgNO3 溶液(杂质不含镁元素且不 与 AgNO3 溶液反应)。实验过程中,生成沉淀的质量与滴入 AgNO3溶液的质量关 系如右图所示。试计算: (1)恰好完全反应时生成沉淀的质量为 g

(2)样品中含镁元素的质量是多少?(计算结果精确到0.01g) (3)原硝酸银溶液中溶质的质量分数是多少?(计算结果精确到0.1%) 答案: 1.A2B3.C 4D氢氧化钠固体容易吸收空气中的水分,并与二氧化碳发生反应而变质,必须 密封保存,A正确;硝酸银见光易分解,所以必须密封保存在棕色试剂瓶中,B正确: 浓盐酸具有挥发性,必须密封保存,C正确:氨水具有挥发性,必须密封保存,D错 误。 5B位于氢前面的金属能置换出酸中的氢,把甲、乙、丙三种金属分别加入稀 硫酸中,甲、乙表面有气泡产生,丙无明显变化,说明甲、乙的金属活动性比氢强, 丙的金属活动性比氢弱,即活动性顺序为甲、乙>H>丙:位于前面的金属能把排在 它后面的金属从其盐溶液中置换出来,再把甲放入乙的硫酸盐溶液中,无明显现 象,说明甲的金属活动性比乙弱,故三种金属的活动性顺序是乙>甲>丙。故选B。 6.A向CaCl2与盐酸混合溶液中逐滴滴加Na2CO3溶液,碳酸钠先与盐酸反应生 成氯化钠、水和二氧化碳,盐酸反应完,再与氯化钙反应生成碳酸钙沉淀和氯化 钠,实验中C的数目保持不变,故A项正确:AB对应反应为碳酸钠与盐酸的反应, 反应物是酸和盐,不属于中和反应,故B项错误;BC对应反应是碳酸钠与氯化钙反 应生成碳酸钙沉淀和氯化钠,产生白色沉淀,故C项错误;CD表明N2CO3显碱性, 碳酸钠不属于碱,属于盐,故D项错误。 7.D 8D浓硫酸具有吸水性,且不与氧气反应,能除去杂质且没有引入新的杂质,符合 除杂原则,A实验方法能达到目的:打开瓶盖,利用扇动的方法闻气味,有刺激性气 味的是浓盐酸,无明显气味的是浓硫酸,可以鉴别,B实验方法能达到目的:取样放 入试管中,加入适量的AgNO3溶液和足量的稀硝酸,若产生白色沉淀,说明某溶液 中含有CI,C实验方法能达到目的:MgSO4能与过量的氢氧化钠溶液反应生成氢 氧化镁沉淀和硫酸钠,搅拌、过滤、洗涤,得滤液,滤液是硫酸钠和氢氧化钠的混 合溶液,不能分离出纯净的硫酸钠溶液,D实验方法不能达到目的。 9D在比较物质的溶解度时,需要指明温度,A错误;没有指明是否为饱和溶液,无 法比较溶质的质量分数,B错误;2℃时,乙的饱和溶液降温有溶质析出,丙的饱和 溶液降温不会析出晶体,C错误;甲物质的溶解度受温度变化影响较大,所以甲中 混有少量乙时,可通过溶解、加热浓缩、冷却结晶的方法提纯,D正确。 10.B由题意可知,向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,由于 金属活动性由强到弱的顺序为Zn>Cu>Ag,Zn首先置换AgNO3中的Ag,当Zn全 部反应完后,Cu可置换AgNO3中的Ag。充分反应后过滤,滤液为蓝色,说明Zn 全部参加了反应,滤渣中没有Zn,滤液中有ZnNO32、CuNO32,可能含有 AgNO3。由上述分析可知:滤渣中没有Zn,加入稀盐酸,不可能有气泡产生,A错 误;滤液中可能含有AgNO3,加入稀盐酸,可能有沉淀产生,B正确:滤渣中一定有
(2)样品中含镁元素的质量是多少?(计算结果精确到 0.01 g) (3)原硝酸银溶液中溶质的质量分数是多少?(计算结果精确到 0.1%) 答案: 1.A 2.B 3.C 4.D 氢氧化钠固体容易吸收空气中的水分,并与二氧化碳发生反应而变质,必须 密封保存,A 正确;硝酸银见光易分解,所以必须密封保存在棕色试剂瓶中,B 正确; 浓盐酸具有挥发性,必须密封保存,C 正确;氨水具有挥发性,必须密封保存,D 错 误。 5.B 位于氢前面的金属能置换出酸中的氢,把甲、乙、丙三种金属分别加入稀 硫酸中,甲、乙表面有气泡产生,丙无明显变化,说明甲、乙的金属活动性比氢强, 丙的金属活动性比氢弱,即活动性顺序为甲、乙>H>丙;位于前面的金属能把排在 它后面的金属从其盐溶液中置换出来,再把甲放入乙的硫酸盐溶液中,无明显现 象,说明甲的金属活动性比乙弱,故三种金属的活动性顺序是乙>甲>丙。故选 B。 6.A 向 CaCl2 与盐酸混合溶液中逐滴滴加 Na2CO3溶液,碳酸钠先与盐酸反应生 成氯化钠、水和二氧化碳,盐酸反应完,再与氯化钙反应生成碳酸钙沉淀和氯化 钠,实验中 Cl-的数目保持不变,故 A 项正确;AB 对应反应为碳酸钠与盐酸的反应, 反应物是酸和盐,不属于中和反应,故 B 项错误;BC 对应反应是碳酸钠与氯化钙反 应生成碳酸钙沉淀和氯化钠,产生白色沉淀,故 C 项错误;CD 表明 Na2CO3 显碱性, 碳酸钠不属于碱,属于盐,故 D 项错误。 7.D 8.D 浓硫酸具有吸水性,且不与氧气反应,能除去杂质且没有引入新的杂质,符合 除杂原则,A 实验方法能达到目的;打开瓶盖,利用扇动的方法闻气味,有刺激性气 味的是浓盐酸,无明显气味的是浓硫酸,可以鉴别,B 实验方法能达到目的;取样放 入试管中,加入适量的 AgNO3 溶液和足量的稀硝酸,若产生白色沉淀,说明某溶液 中含有 Cl- ,C 实验方法能达到目的;MgSO4 能与过量的氢氧化钠溶液反应生成氢 氧化镁沉淀和硫酸钠,搅拌、过滤、洗涤,得滤液,滤液是硫酸钠和氢氧化钠的混 合溶液,不能分离出纯净的硫酸钠溶液,D 实验方法不能达到目的。 9.D 在比较物质的溶解度时,需要指明温度,A 错误;没有指明是否为饱和溶液,无 法比较溶质的质量分数,B 错误;t2 ℃时,乙的饱和溶液降温有溶质析出,丙的饱和 溶液降温不会析出晶体,C 错误;甲物质的溶解度受温度变化影响较大,所以甲中 混有少量乙时,可通过溶解、加热浓缩、冷却结晶的方法提纯,D 正确。 10.B 由题意可知,向 AgNO3 溶液中加入一定质量的 Zn 和 Cu 的混合粉末,由于 金属活动性由强到弱的顺序为 Zn>Cu>Ag,Zn 首先置换 AgNO3 中的 Ag,当 Zn 全 部反应完后,Cu 可置换 AgNO3 中的 Ag。充分反应后过滤,滤液为蓝色,说明 Zn 全部参加了反应,滤渣中没有 Zn,滤液中有 Zn(NO3)2、Cu(NO3)2,可能含有 AgNO3。由上述分析可知:滤渣中没有 Zn,加入稀盐酸,不可能有气泡产生,A 错 误;滤液中可能含有 AgNO3,加入稀盐酸,可能有沉淀产生,B 正确;滤渣中一定有

Ag,一定无Zn,可能含有Cu,C错误;滤液中一定有CuNO32、ZnNO3h,可能有 AgNO3,D错误。 11.答案(1)化学变大 (2)耐高温有机物 (3)氮肥 12.答案:(1)将浓硫酸沿容器内壁缓慢注入,并用玻璃棒不断搅拌H2SO一 2H+S02 (2)紫色石蕊熟石灰[或:Ca(OH)2] (3)NaHCO3+HCI-NaCl+H2O+CO21 (4)B 2NaOH+CuSO-Na2SO4+Cu(OH)2 13.答案:(1)1(2)33.3%(3)C>B>A 解析(1)温度为1℃时,A、C的溶解度曲线相交,说明A、C的溶解度相同。 (2)№℃时,B的溶解度是50g,把30gB物质加到50g水中,最多可以溶解25gB, 充分溶解后所得溶液的溶质质量分数为5×100%33.3%。(3)归℃时,因为溶 75g 解度的大小是A>B>C,所以溶剂的大小是C>B>A;将等质量A、B、C三种物质 的饱和溶液降温至1℃,降温后,溶剂的质量不变,所得三种溶液中溶剂质量的大 小关系是C>B>A。 14.答案:【实验1】B、C将带火星的木条放入集气瓶内,木条复燃,证明是氧气 【实验2】氯化钙与氢氧化钠反应,生成微溶性的氢氧化钙 【实验3】有气泡产生Na2CO3+2HC一2NaC1+CO2↑+HO 【实验4】无色酚酞溶液碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化 钠,无法证明原溶液中是否含有氢氧化钠 解析:【实验1】过碳酸钠与水反应,属于固液常温型,故选用B装置作为气体发 生装置,根据题目可知生成氧气,选用C装置收集气体;氧气能支持燃烧,故检验方 法是将带火星的木条放入集气瓶内,木条复燃,证明是氧气。 【实验2】复分解反应的条件是有气体、沉淀或水生成,氯化钙与氢氧化钠反应, 若微溶性的氢氧化钙析出,也会导致有白色沉淀出现。 【实验3】碳酸钠与稀盐酸反应生成NaCl、CO2、H2O,据此书写化学方程式。 【实验4】由于碳酸钠和氢氧化钠均呈碱性,故要先检验碳酸钠的存在,同时要将 碳酸钠除去,然后通过滴加无色酚酞溶液来检验氢氧化钠的存在;该实验中用 CC2溶液而不用饱和石灰水,原因是碳酸钠能与氢氧化钙反应生成碳酸钙沉淀 和氢氧化钠,无法证明原溶液中是否含有氢氧化钠。 15.答案:(1)5.74 (2)0.48g (3)6.8% 解析(1)由图可知,恰好完全反应时生成沉淀的质量为5.74g。 (2)设氯化镁的质量为x,反应的硝酸银质量为y
Ag,一定无 Zn,可能含有 Cu,C 错误;滤液中一定有 Cu(NO3)2、Zn(NO3)2,可能有 AgNO3,D 错误。 11.答案:(1)化学 变大 (2)耐高温 有机物 (3)氮肥 12.答案:(1)将浓硫酸沿容器内壁缓慢注入,并用玻璃棒不断搅拌 H2SO4 2H++SO4 2- (2)紫色石蕊 熟石灰[或:Ca(OH)2] (3)NaHCO3+HCl NaCl+H2O+CO2↑ (4)B 2NaOH+CuSO4 Na2SO4+Cu(OH)2↓ 13.答案:(1)t1 (2)33.3% (3)C>B>A 解析:(1)温度为 t1 ℃时,A、C 的溶解度曲线相交,说明 A、C 的溶解度相同。 (2)t2 ℃时,B 的溶解度是 50 g,把 30 g B 物质加到 50 g 水中,最多可以溶解 25 g B, 充分溶解后所得溶液的溶质质量分数为25 g 75 g ×100%≈33.3%。 (3)t3 ℃时,因为溶 解度的大小是 A>B>C,所以溶剂的大小是 C>B>A;将等质量 A、B、C 三种物质 的饱和溶液降温至 t1 ℃,降温后,溶剂的质量不变,所得三种溶液中溶剂质量的大 小关系是 C>B>A。 14.答案:【实验 1】B、C 将带火星的木条放入集气瓶内,木条复燃,证明是氧气 【实验 2】氯化钙与氢氧化钠反应,生成微溶性的氢氧化钙 【实验 3】有气泡产生 Na2CO3+2HCl 2NaCl+CO2↑+H2O 【实验 4】无色酚酞溶液 碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化 钠,无法证明原溶液中是否含有氢氧化钠 解析:【实验 1】过碳酸钠与水反应,属于固液常温型,故选用 B 装置作为气体发 生装置,根据题目可知生成氧气,选用 C 装置收集气体;氧气能支持燃烧,故检验方 法是将带火星的木条放入集气瓶内,木条复燃,证明是氧气。 【实验 2】复分解反应的条件是有气体、沉淀或水生成,氯化钙与氢氧化钠反应, 若微溶性的氢氧化钙析出,也会导致有白色沉淀出现。 【实验 3】碳酸钠与稀盐酸反应生成 NaCl、CO2、H2O,据此书写化学方程式。 【实验 4】由于碳酸钠和氢氧化钠均呈碱性,故要先检验碳酸钠的存在,同时要将 碳酸钠除去,然后通过滴加无色酚酞溶液来检验氢氧化钠的存在;该实验中用 CaCl2 溶液而不用饱和石灰水,原因是碳酸钠能与氢氧化钙反应生成碳酸钙沉淀 和氢氧化钠,无法证明原溶液中是否含有氢氧化钠。 15.答案:(1)5.74 (2)0.48 g (3)6.8% 解析:(1)由图可知,恰好完全反应时生成沉淀的质量为 5.74 g。 (2)设氯化镁的质量为 x,反应的硝酸银质量为 y

MgCl2+2AgNO:2AgCIl+Mg(NO3)2 95 340 287 y 5.74g 95 287=5748 340 =8 x=1.9gJ=6.8g 样品中含镁元素的质量是19g酷048g: (3)原硝酸银溶液中溶质的质量分数是68三×100%=6.8%。 100g
MgCl2+2AgNO3 2AgCl↓+Mg(NO3)2 95 340 287 x y 5.74 g 95 287 = 𝑥 5.74 g 340 287 = 𝑦 5.74 g x=1.9 g y=6.8 g 样品中含镁元素的质量是 1.9 g× 24 95 =0.48 g。 (3)原硝酸银溶液中溶质的质量分数是6.8 g 100 g ×100%=6.8%