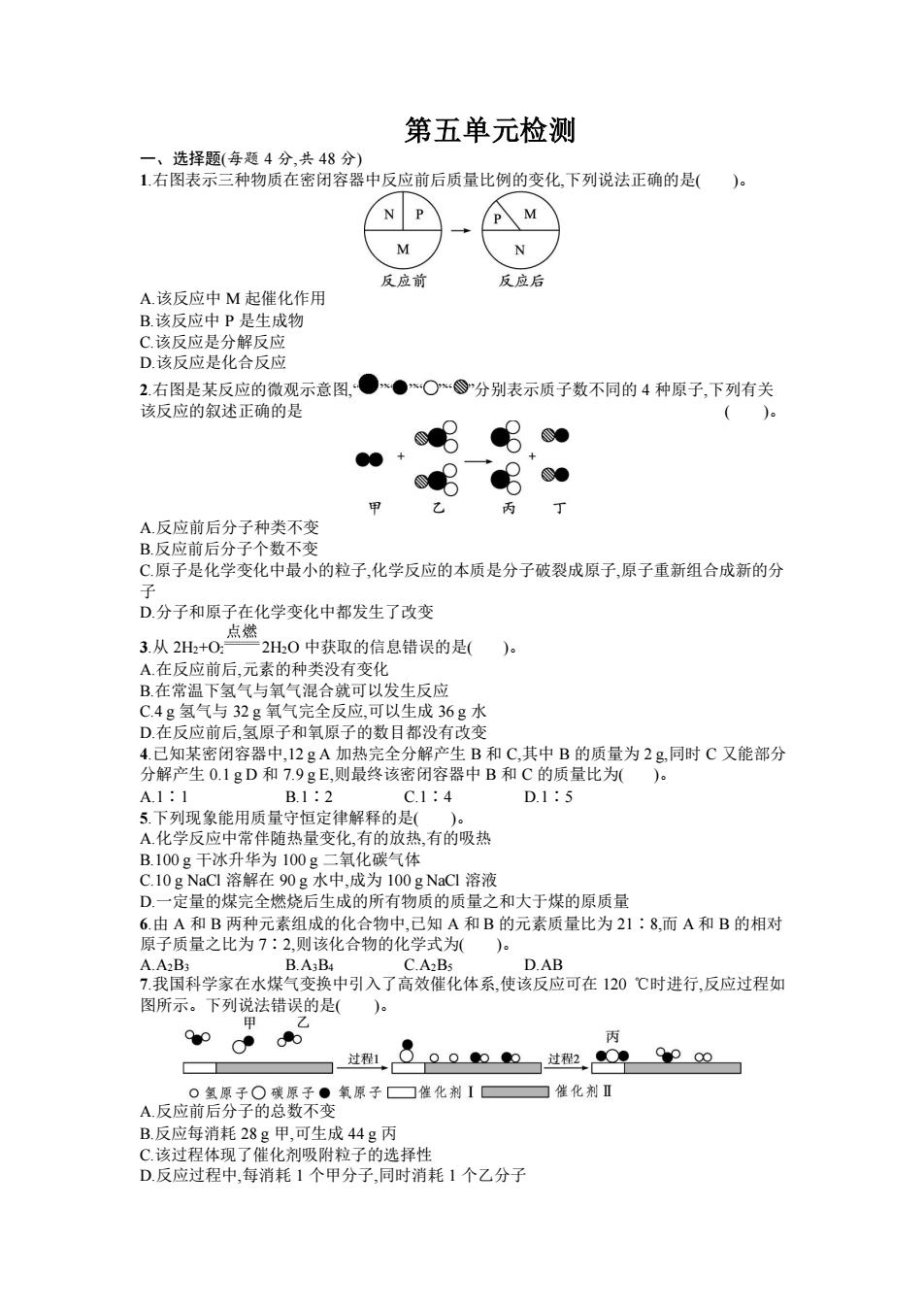
第五单元检测 一、选择题(每题4分,共48分) 1右图表示三种物质在密闭容器中反应前后质量比例的变化,下列说法正确的是()。 M 反应前 反应后 A.该反应中M起催化作用 B.该反应中P是生成物 C该反应是分解反应 D.该反应是化合反应 2右图是某反应的微观示意图,● ●*○分别表示质子数不同的4种原子,下列有关 该反应的叙述正确的是 () ● 丙 了 A.反应前后分子种类不变 B.反应前后分子个数不变 C.原子是化学变化中最小的粒子,化学反应的本质是分子破裂成原子,原子重新组合成新的分 子 D.分子和原子在化学变化中都发生了改变 点燃 3.从2H2+O:一2H20中获取的信息错误的是( )。 A.在反应前后,元素的种类没有变化 B在常温下氢气与氧气混合就可以发生反应 C.4g氢气与32g氧气完全反应,可以生成36g水 D.在反应前后,氢原子和氧原子的数目都没有改变 4.己知某密闭容器中,12gA加热完全分解产生B和C,其中B的质量为2g,同时C又能部分 分解产生0.1gD和7.9gE,则最终该密闭容器中B和C的质量比为()。 A.1:1 B.1:2 C.1:4 D.1:5 5.下列现象能用质量守恒定律解释的是()。 A化学反应中常伴随热量变化,有的放热,有的吸热 B.100g干冰升华为100g二氧化碳气体 C.10 g NaCl溶解在90g水中,成为100 g NaCl溶液 D.一定量的煤完全燃烧后生成的所有物质的质量之和大于煤的原质量 6.由A和B两种元素组成的化合物中,已知A和B的元素质量比为21:8,而A和B的相对 原子质量之比为7:2,则该化合物的化学式为( A.A2B3 B.A3B4 C.A2Bs D.AB 7.我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如 图所示。下列说法错误的是( 甲 9●p Cd0 丙 过程1 0000一过2,099P” 0氢原子○碳原子●氧原子☐催化剂I ☐催化剂Ⅱ A.反应前后分子的总数不变 B.反应每消耗28g甲,可生成44g丙 C.该过程体现了催化剂吸附粒子的选择性 D.反应过程中,每消耗1个甲分子,同时消耗1个乙分子
第五单元检测 一、选择题(每题 4 分,共 48 分) 1.右图表示三种物质在密闭容器中反应前后质量比例的变化,下列说法正确的是( )。 A.该反应中 M 起催化作用 B.该反应中 P 是生成物 C.该反应是分解反应 D.该反应是化合反应 2.右图是某反应的微观示意图,“ ”“ ”“ ”“ ”分别表示质子数不同的 4 种原子,下列有关 该反应的叙述正确的是 ( )。 A.反应前后分子种类不变 B.反应前后分子个数不变 C.原子是化学变化中最小的粒子,化学反应的本质是分子破裂成原子,原子重新组合成新的分 子 D.分子和原子在化学变化中都发生了改变 3.从 2H2+O2 2H2O 中获取的信息错误的是( )。 A.在反应前后,元素的种类没有变化 B.在常温下氢气与氧气混合就可以发生反应 C.4 g 氢气与 32 g 氧气完全反应,可以生成 36 g 水 D.在反应前后,氢原子和氧原子的数目都没有改变 4.已知某密闭容器中,12 g A 加热完全分解产生 B 和 C,其中 B 的质量为 2 g,同时 C 又能部分 分解产生 0.1 g D 和 7.9 g E,则最终该密闭容器中 B 和 C 的质量比为( )。 A.1∶1 B.1∶2 C.1∶4 D.1∶5 5.下列现象能用质量守恒定律解释的是( )。 A.化学反应中常伴随热量变化,有的放热,有的吸热 B.100 g 干冰升华为 100 g 二氧化碳气体 C.10 g NaCl 溶解在 90 g 水中,成为 100 g NaCl 溶液 D.一定量的煤完全燃烧后生成的所有物质的质量之和大于煤的原质量 6.由 A 和 B 两种元素组成的化合物中,已知 A 和 B 的元素质量比为 21∶8,而 A 和 B 的相对 原子质量之比为 7∶2,则该化合物的化学式为( )。 A.A2B3 B.A3B4 C.A2B5 D.AB 7.我国科学家在水煤气变换中引入了高效催化体系,使该反应可在 120 ℃时进行,反应过程如 图所示。下列说法错误的是( )。 A.反应前后分子的总数不变 B.反应每消耗 28 g 甲,可生成 44 g 丙 C.该过程体现了催化剂吸附粒子的选择性 D.反应过程中,每消耗 1 个甲分子,同时消耗 1 个乙分子

8.右图反映了某个化学反应里各物质质量与时间的变化关系,下列对此变化的描述中正确的 是() 十物质的质量g 1 一丙 0 时间/ A充分反应后,参加反应的乙的质量+丙的质量=甲的质量 B.物质甲的相对分子质量大于乙 C.此化学反应不遵守质量守恒定律 D此化学反应是分解反应 点燃 9.纯净物X在氧气中完全燃烧的化学方程式为X+2O CO2+2H2O。下列说法不正确的 是()。 A.该反应前后原子的种类发生改变B.X由C、H两种元素组成 C.该反应的生成物都是氧化物 D.X的化学式为CH 10.某同学从定量角度研究过氧化氢制取氧气的过程,对原实验进行了部分改进,增加了称量 操作。具体做法:取10%的过氧化氢和少量的二氧化锰放入气体发生装置,并对反应前后混 合物的质量进行称量,记录数据如下表所列。 质量 反应前 反应后 质量变化(不含容器质量)g 34.3 32.7 若反应后,过氧化氢分解完全且氧气全部逸出,该同学得出的结论中不合理的是 A.反应速率逐渐加快 B.最多得到氧气的质量为1.6g C.催化剂二氧化锰的质量为0.3g D.反应得到水和氧气的质量比为9:8 11.将10g高锰酸钾放入试管中进行加热,加热一段时间后,称得试管中残留固体的质量为9 g,则试管中残留固体的成分为()。 A.KMnO B.K2MnO4、MnO2 C.KMnO4、K2MnO4、MnO2 D.KMnO4、MnOz 12.为了测定液化气中丙烷(CHs)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个 封闭的容器中引燃,测得反应前后各物质的质量如下表所列。 质量 丙烷 氧气 水 二氧化碳 X 反应前质量/g 4.4 12.8 0 反应后质量/g 0 7.2 下列判断正确的是( )a A.表中a的值为5.6B.X可能是该反应的催化剂 C.X可能含有氢元素DX只含碳元素 二、填空题(共24分) 13.(8分)水是自然界的宝贵资源,人类离不开水。请回答下列有关水的问题。 (1)水是由 和 两种元素组成的。 (2)水常用作灭火,但是电路起火时用水扑灭往往会引起爆炸,其原因 是 (填化学方程式)。 14.(6分)柴油机尾气中的主要污染物是氮氧化物。某种尾气处理技术是利用氨气与氮氧化 物发生化学反应,降低污染物排放,其中 个反应的微观示意图如下图所示。 。一氢原子 催化剂 ●一氧原子 B D ⑧一氨原子 回答以下问题 (1)A中氮元素的化合价为
8.右图反映了某个化学反应里各物质质量与时间的变化关系,下列对此变化的描述中正确的 是( )。 A.充分反应后,参加反应的乙的质量+丙的质量=甲的质量 B.物质甲的相对分子质量大于乙 C.此化学反应不遵守质量守恒定律 D.此化学反应是分解反应 9.纯净物 X 在氧气中完全燃烧的化学方程式为 X+2O2 CO2+2H2O。下列说法不.正确的 是( )。 A.该反应前后原子的种类发生改变 B.X 由 C、H 两种元素组成 C.该反应的生成物都是氧化物 D.X 的化学式为 CH4 10.某同学从定量角度研究过氧化氢制取氧气的过程,对原实验进行了部分改进,增加了称量 操作。具体做法:取 10%的过氧化氢和少量的二氧化锰放入气体发生装置,并对反应前后混 合物的质量进行称量,记录数据如下表所列。 质 量 反应前 反应后 质量变化(不含容器质量)/g 34.3 32.7 若反应后,过氧化氢分解完全且氧气全部逸出,该同学得出的结论中不合理的是 ( )。 A.反应速率逐渐加快 B.最多得到氧气的质量为 1.6 g C.催化剂二氧化锰的质量为 0.3 g D.反应得到水和氧气的质量比为 9∶8 11.将 10 g 高锰酸钾放入试管中进行加热,加热一段时间后,称得试管中残留固体的质量为 9 g,则试管中残留固体的成分为( )。 A.KMnO4 B.K2MnO4 、MnO2 C.KMnO4、K2MnO4、MnO2 D.KMnO4、MnO2 12.为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个 封闭的容器中引燃,测得反应前后各物质的质量如下表所列。 质 量 丙烷 氧气 水 二氧化碳 X 反应前质量/g 4.4 12.8 0 0 0 反应后质量/g 0 0 7.2 4.4 a 下列判断正确的是( )。 A.表中 a 的值为 5.6 B.X 可能是该反应的催化剂 C.X 可能含有氢元素D.X 只含碳元素 二、填空题(共 24 分) 13.(8 分)水是自然界的宝贵资源,人类离不开水。请回答下列有关水的问题。 (1)水是由 和 两种元素组成的。 (2)水常用作灭火,但是电路起火时用水扑灭往往会引起爆炸,其原因 是 , (填化学方程式)。 14.(6 分)柴油机尾气中的主要污染物是氮氧化物。某种尾气处理技术是利用氨气与氮氧化 物发生化学反应,降低污染物排放,其中一个反应的微观示意图如下图所示。 回答以下问题: (1)A 中氮元素的化合价为
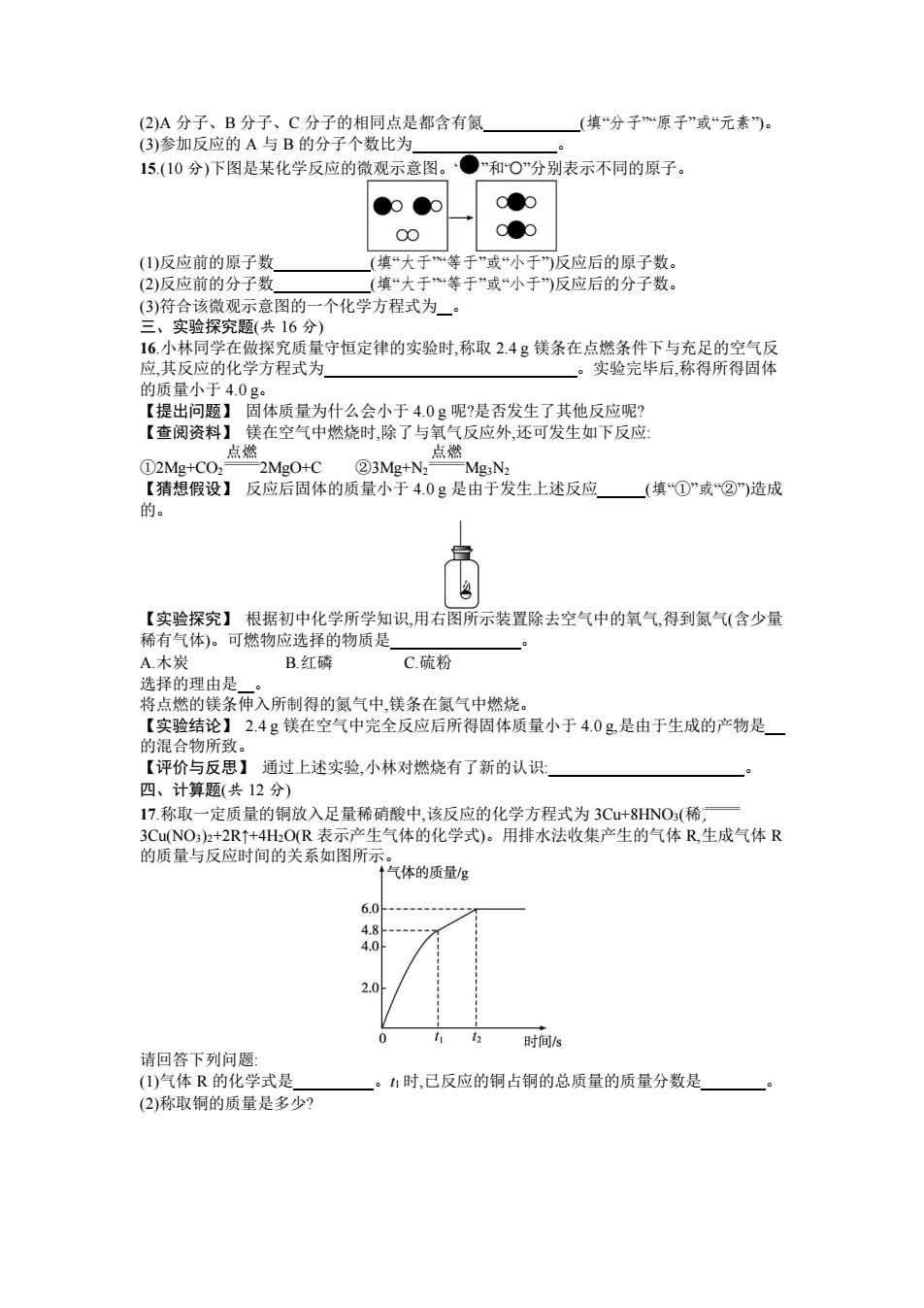
(2)A分子、B分子、C分子的相同点是都含有氮 (填“分子“原子”或“元素”。 (3)参加反应的A与B的分子个数比为 15.(10分)下图是某化学反应的微观示意图。‘●”和O”分别表示不同的原子。 C (1)反应前的原子数 (填“大于等于”或“小于”反应后的原子数。 (2)反应前的分子数 (填“大于*等于”或“小于”反应后的分子数。 (3)符合该微观示意图的一个化学方程式为。 三、实验探究题(共16分) 16.小林同学在做探究质量守恒定律的实验时,称取2.4g镁条在点燃条件下与充足的空气反 应,其反应的化学方程式为 。 实验完毕后,称得所得固体 的质量小于4.0g。 【提出问题】固体质量为什么会小于4.0g呢?是否发生了其他反应呢? 【查阅资料】镁在空气中燃烧时,除了与氧气反应外,还可发生如下反应: 点 点燃 ①2Mg+CO2 2Mg0+C ②3Mg+N2—MgN2 【猜想假设】反应后固体的质量小于4.0g是由于发生上述反应 (填“①”或“②造成 的。 【实验探究】根据初中化学所学知识,用右图所示装置除去空气中的氧气,得到氮气(含少量 稀有气体)。可燃物应选择的物质是 A.木炭 B红磷 C.硫粉 选择的理由是。 将点燃的镁条伸入所制得的氮气中,镁条在氮气中燃烧。 【实验结论】2.4g镁在空气中完全反应后所得固体质量小于4.0g,是由于生成的产物是 的混合物所致。 【评价与反思】通过上述实验,小林对燃烧有了新的认识: 四、计算题(共12分) 17.称取一定质量的铜放入足量稀硝酸中,该反应的化学方程式为3Cu+8HNO3(稀, 3CuNO3)2+2R+4HO(R表示产生气体的化学式)。用排水法收集产生的气体R生成气体R 的质量与反应时间的关系如图所示。 气体的质量g 6.0 4.8 4.0 2.0 0 时间s 请回答下列问题: (1)气体R的化学式是 。1时,己反应的铜占铜的总质量的质量分数是 (2)称取铜的质量是多少?
(2)A 分子、B 分子、C 分子的相同点是都含有氮 (填“分子”“原子”或“元素”)。 (3)参加反应的 A 与 B 的分子个数比为 。 15.(10 分)下图是某化学反应的微观示意图。“ ”和“ ”分别表示不同的原子。 (1)反应前的原子数 (填“大于”“等于”或“小于”)反应后的原子数。 (2)反应前的分子数 (填“大于”“等于”或“小于”)反应后的分子数。 (3)符合该微观示意图的一个化学方程式为 。 三、实验探究题(共 16 分) 16.小林同学在做探究质量守恒定律的实验时,称取 2.4 g 镁条在点燃条件下与充足的空气反 应,其反应的化学方程式为 。实验完毕后,称得所得固体 的质量小于 4.0 g。 【提出问题】 固体质量为什么会小于 4.0 g 呢?是否发生了其他反应呢? 【查阅资料】 镁在空气中燃烧时,除了与氧气反应外,还可发生如下反应: ①2Mg+CO2 2MgO+C ②3Mg+N2 Mg3N2 【猜想假设】 反应后固体的质量小于 4.0 g 是由于发生上述反应 (填“①”或“②”)造成 的。 【实验探究】 根据初中化学所学知识,用右图所示装置除去空气中的氧气,得到氮气(含少量 稀有气体)。可燃物应选择的物质是 。 A.木炭 B.红磷 C.硫粉 选择的理由是 。 将点燃的镁条伸入所制得的氮气中,镁条在氮气中燃烧。 【实验结论】 2.4 g 镁在空气中完全反应后所得固体质量小于 4.0 g,是由于生成的产物是 的混合物所致。 【评价与反思】 通过上述实验,小林对燃烧有了新的认识: 。 四、计算题(共 12 分) 17.称取一定质量的铜放入足量稀硝酸中,该反应的化学方程式为 3Cu+8HNO3(稀) 3Cu(NO3)2+2R↑+4H2O(R 表示产生气体的化学式)。用排水法收集产生的气体 R,生成气体 R 的质量与反应时间的关系如图所示。 请回答下列问题: (1)气体 R 的化学式是 。t1 时,已反应的铜占铜的总质量的质量分数是 。 (2)称取铜的质量是多少?

第五单元检测 1.D2.C3.B4.A5.D6B7.C8.D 9,A化学反应前后原子的种类不变,A错误根据反应的化学方程式X20点警 C02+2H2O,反应前碳、氢、氧原子个数分别为0、0、4反应后的生成物中碳、氢、氧原 子个数分别为1、4、4,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子 和4个氢原子构成,则物质X的化学式为CH,B、D正确:生成物为二氧化碳和水,均是 由两种元素组成的,且有一种是氧元素的化合物,均属于氧化物,C正确。 10.A11.C12.A 13.答案(1)氢氧(22H,C通电2H+0,t 2H,+0.点燃2H,0 14.答案(1)-3价(2)原子(3)2:3 15答案()等于(2)大于(32C0+0.点燃2C0, 点燃】 16.答案2Mg+0,2Mg0 【猜想假设】② 【实验探究】B红磷易与空气中的氧气反应且产物是固体 【实验结论】MgO、MgN2 【评价与反思】燃烧不一定非得在氧气中进行 17.答案(1)N080% (2)解:设称取铜的质量为x。 3Cu+8HNO,(稀,一3CuNO)2+2NO↑+4HO 192 60 6.0g 192=文 606.0g x=19.2g 答:称取铜的质量为192g
第五单元检测 1.D 2.C 3.B 4.A 5.D 6.B 7.C 8.D 9.A 化学反应前后原子的种类不变,A 错误;根据反应的化学方程式 X+2O2 CO2+2H2O,反应前碳、氢、氧原子个数分别为 0、0、4,反应后的生成物中碳、氢、氧原 子个数分别为 1、4、4,根据反应前后原子种类、数目不变,则每个 X 分子由 1 个碳原子 和 4 个氢原子构成,则物质 X 的化学式为 CH4,B、D 正确;生成物为二氧化碳和水,均是 由两种元素组成的,且有一种是氧元素的化合物,均属于氧化物,C 正确。 10.A 11.C 12.A 13.答案 (1)氢 氧 (2)2H2O 2H2↑+O2↑ 2H2+O2 2H2O 14.答案 (1)-3 价 (2)原子 (3)2∶3 15.答案 (1)等于 (2)大于 (3)2CO+O2 2CO2 16.答案 2Mg+O2 2MgO 【猜想假设】② 【实验探究】B 红磷易与空气中的氧气反应且产物是固体 【实验结论】MgO、Mg3N2 【评价与反思】燃烧不一定非得在氧气中进行 17.答案 (1)NO 80% (2)解:设称取铜的质量为 x。 3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O 192 60 x 6.0 g 192 60 = 𝑥 6.0 g x=19.2 g 答:称取铜的质量为 19.2 g