
第十一单元检测 一、选择题(每题3分,共30分) 1.下列选项中物质的俗名、化学式、类别、用途完全对应的是()。 A.纯碱Na2CO3碱制玻璃B.生石灰CaO氧化物补钙剂 C.食盐NaCI盐除铁锈 D.火碱NaOH碱制肥皂 2.下列化学肥料中属于磷肥的是()。 A.CO(NH2)2 B.KCI C.KNO3 D.Ca3(PO4)2 3.只用一种试剂可以区分NH4)2SO4、NH4CI、K2SO4这三种无色溶液,这种试剂 是()。 A.AgNO3溶液BBa(OH)h溶液 C.NaOH溶液D.盐酸 4.在pH=7的无色溶液中,下列离子可以大量共存的是( A.Nat、Ca2+、N03、C0 B.NH、Cu2+、Cr、S02 C.Ba2+、K+、OH、NO3 D.Na、Kt、NO3、CI 5.下列各组中的物质能发生反应,并且形成溶液的质量增大的是( )o A.碳酸钠溶液与稀盐酸 B.硫酸钠溶液与氯化钡溶液 C.大理石与稀盐酸 D.碳酸钠溶液与氢氧化钠溶液 6.化肥对提高农作物的产量有重要作用,下列有关化肥的说法不正确的是 () A.提倡农家肥与化肥综合利用 B.草木灰是一种农家肥,其主要成分中含有钾元素 C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿 D.常用作氨肥的化合物有尿素、碳酸氢铵等 7.借助括号内的试剂,不能将组内物质鉴别出来的是( A.固体:铁粉氧化铜木炭粉(稀硫酸) B.固体NaCl NaOH NH4NO3(水) C.溶液NaOH溶液Ca(OH)2溶液稀盐酸(CO2气体) D.溶液:KNO3溶液MgC2溶液稀盐酸(AgNO3溶液) 8.下列实验操作不能达到实验目的的是( ) 选项 实验目的 实验操作 鉴别NaOH和NaCI两种固体 分别加入少量水溶解 B 除去NaCI溶液中少量Na2SO4 先加入BaNO32溶液,后过滤 除去H2中少量的水蒸气 将混合气体通过装有浓硫酸的洗气瓶 鉴别化肥KCI和NH4CI 取样与熟石灰混合研磨,闻气味 9.右图中甲~戊是初中化学教材中的常见物质。甲、戊为氧化物且甲为黑色固体 乙、丙分别是酸和碱中的一种,丁是大理石的主要成分。图中“一”表示相连的物
第十一单元检测 一、选择题(每题 3 分,共 30 分) 1.下列选项中物质的俗名、化学式、类别、用途完全对应的是( )。 A.纯碱 Na2CO3 碱 制玻璃 B.生石灰 CaO 氧化物 补钙剂 C.食盐 NaCl 盐 除铁锈 D.火碱 NaOH 碱 制肥皂 2.下列化学肥料中属于磷肥的是( )。 A.CO(NH2)2 B.KCl C.KNO3 D.Ca3(PO4)2 3.只用一种试剂可以区分(NH4)2SO4、NH4Cl、K2SO4这三种无色溶液,这种试剂 是( )。 A.AgNO3 溶液 B.Ba(OH)2 溶液 C.NaOH 溶液 D.盐酸 4.在 pH=7 的无色溶液中,下列离子可以大量共存的是( )。 A.Na+、Ca2+、NO3 - 、CO3 2- B.NH4 +、Cu2+、Cl-、SO4 2- C.Ba2+、K+、OH-、NO3 - D.Na+、K+、NO3 - 、Cl- 5.下列各组中的物质能发生反应,并且形成溶液的质量增大的是( )。 A.碳酸钠溶液与稀盐酸 B.硫酸钠溶液与氯化钡溶液 C.大理石与稀盐酸 D.碳酸钠溶液与氢氧化钠溶液 6.化肥对提高农作物的产量有重要作用,下列有关化肥的说法不正确的是 ( )。 A.提倡农家肥与化肥综合利用 B.草木灰是一种农家肥,其主要成分中含有钾元素 C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿 D.常用作氮肥的化合物有尿素、碳酸氢铵等 7.借助括号内的试剂,不能将组内物质鉴别出来的是( )。 A.固体:铁粉 氧化铜 木炭粉 (稀硫酸) B.固体:NaCl NaOH NH4NO3 (水) C.溶液:NaOH 溶液 Ca(OH)2 溶液 稀盐酸 (CO2 气体) D.溶液:KNO3 溶液 MgCl2 溶液 稀盐酸 (AgNO3 溶液) 8.下列实验操作不能达到实验目的的是( )。 选项 实验目的 实验操作 A 鉴别 NaOH 和 NaCl 两种固体 分别加入少量水溶解 B 除去 NaCl 溶液中少量 Na2SO4 先加入 Ba(NO3)2 溶液,后过滤 C 除去 H2 中少量的水蒸气 将混合气体通过装有浓硫酸的洗气瓶 D 鉴别化肥 KCl 和 NH4Cl 取样与熟石灰混合研磨,闻气味 9.右图中甲~戊是初中化学教材中的常见物质。甲、戊为氧化物且甲为黑色固体, 乙、丙分别是酸和碱中的一种,丁是大理石的主要成分。图中“—”表示相连的物
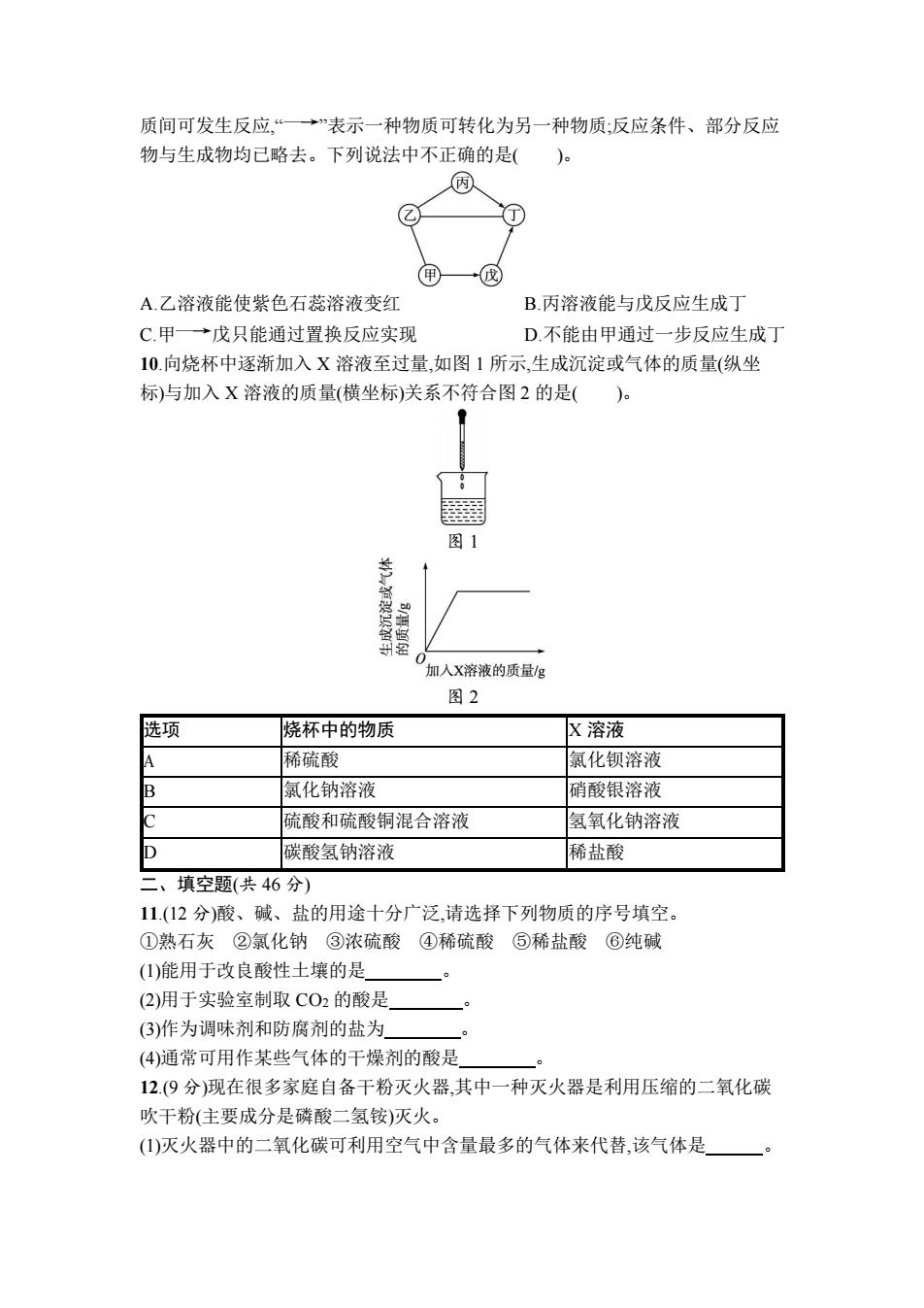
质间可发生反应,“*”表示一种物质可转化为另一种物质:反应条件、部分反应 物与生成物均已略去。下列说法中不正确的是( 因 乙 A.乙溶液能使紫色石蕊溶液变红 B.丙溶液能与戊反应生成丁 C甲→戊只能通过置换反应实现 D不能由甲通过一步反应生成丁 10.向烧杯中逐渐加入X溶液至过量,如图1所示,生成沉淀或气体的质量(纵坐 标)与加入X溶液的质量(横坐标)关系不符合图2的是()。 图1 加人X溶液的质量g 图2 选项 烧杯中的物质 X溶液 稀硫酸 氯化钡溶液 氯化钠溶液 硝酸银溶液 硫酸和硫酸铜混合溶液 氢氧化钠溶液 碳酸氢钠溶液 稀盐酸 二、填空题(共46分) 11.(12分)酸、碱、盐的用途十分广泛,请选择下列物质的序号填空。 ①熟石灰②氯化钠③浓硫酸 ④稀硫酸⑤稀盐酸⑥纯碱 (1)能用于改良酸性土壤的是 (2)用于实验室制取CO2的酸是 (3)作为调味剂和防腐剂的盐为 (4)通常可用作某些气体的干燥剂的酸是 12.(9分)现在很多家庭自备干粉灭火器,其中一种灭火器是利用压缩的二氧化碳 吹干粉(主要成分是磷酸二氢铵)灭火。 (1)灭火器中的二氧化碳可利用空气中含量最多的气体来代替,该气体是
质间可发生反应,“ ”表示一种物质可转化为另一种物质;反应条件、部分反应 物与生成物均已略去。下列说法中不正确的是( )。 A.乙溶液能使紫色石蕊溶液变红 B.丙溶液能与戊反应生成丁 C.甲 戊只能通过置换反应实现 D.不能由甲通过一步反应生成丁 10.向烧杯中逐渐加入 X 溶液至过量,如图 1 所示,生成沉淀或气体的质量(纵坐 标)与加入 X 溶液的质量(横坐标)关系不符合图 2 的是( )。 图 1 图 2 选项 烧杯中的物质 X 溶液 A 稀硫酸 氯化钡溶液 B 氯化钠溶液 硝酸银溶液 C 硫酸和硫酸铜混合溶液 氢氧化钠溶液 D 碳酸氢钠溶液 稀盐酸 二、填空题(共 46 分) 11.(12 分)酸、碱、盐的用途十分广泛,请选择下列物质的序号填空。 ①熟石灰 ②氯化钠 ③浓硫酸 ④稀硫酸 ⑤稀盐酸 ⑥纯碱 (1)能用于改良酸性土壤的是 。 (2)用于实验室制取 CO2 的酸是 。 (3)作为调味剂和防腐剂的盐为 。 (4)通常可用作某些气体的干燥剂的酸是 。 12.(9 分)现在很多家庭自备干粉灭火器,其中一种灭火器是利用压缩的二氧化碳 吹干粉(主要成分是磷酸二氢铵)灭火。 (1)灭火器中的二氧化碳可利用空气中含量最多的气体来代替,该气体是

(2)磷酸二氢铵NH4H2PO4)受热分解时吸收大量的热,并能在可燃物表面形成一层 玻璃状的覆盖层(主要成分为H3PO4),其灭火原理是 (用化学方程式表示)。 (3)报废灭火器中的NHH2PO4可作化肥,但不能作为 使用。 A.氮肥 B.磷肥 C.钾肥 D.复合肥料 (4)将磷酸二氢铵和氢氧化钙混合研磨就会发生反应,并可闻到刺激性气味闻到 的具有刺激性气味的气体是 ,它能使润湿的红色石蕊试纸变 色。 13.(6分)下表是部分物质的溶解性表(室温),利用表中提供的信息回答下列问题。 离子 OH- NO Cr S02 I+ 易溶、易挥发 易溶、易挥发 易溶 a 易溶 易溶 易溶 易溶 a2* 易溶 易溶 易溶 微溶 Ba2+ 易溶 易溶 易溶 难溶 (1)酸、碱、盐之间发生的复分解反应,其实质是它们的溶液中离子之间相互结合 生成沉淀、气体或水,否则反应就不能发生,则BaC2溶液与NaNO3溶液混合后, (填“能”或“不能”)发生复分解反应。 (2)其中一个有BaSO4生成的中和反应的化学方程式为 14.(4分)物质的鉴别、分离和提纯是重要的基本实验操作。 (1)鉴别氢氧化钠和碳酸钠两种溶液,不可选择 A.氯化钡溶液 B.硝酸钠溶液 C.稀硫酸 (2)除去硝酸钾溶液中混有的少量硫酸钾,可加入适量的硝酸钡溶液,充分反应后 过滤即可。该反应的化学方程式为 15.(15分)2022·贵州毕节中考)A~F是初中化学常见的物质,它们之间的转化关系 如图所示,图中“一”表示两种物质能发生化学反应,“→”表示两种物质间的转化 关系。 己知:Cu2(OH)2CO:→A+B+C,三者均为氧化物,反应前后各元素化合价均未改 变,D广泛用于玻璃、造纸、纺织和洗涤剂的生产等,农业上可用E、F等配制成 具有杀菌作用的波尔多液作为农药使用。回答下列问题。 (1)D的化学式为 (2)组成元素与B完全相同的另一种物质是 (填化学式)
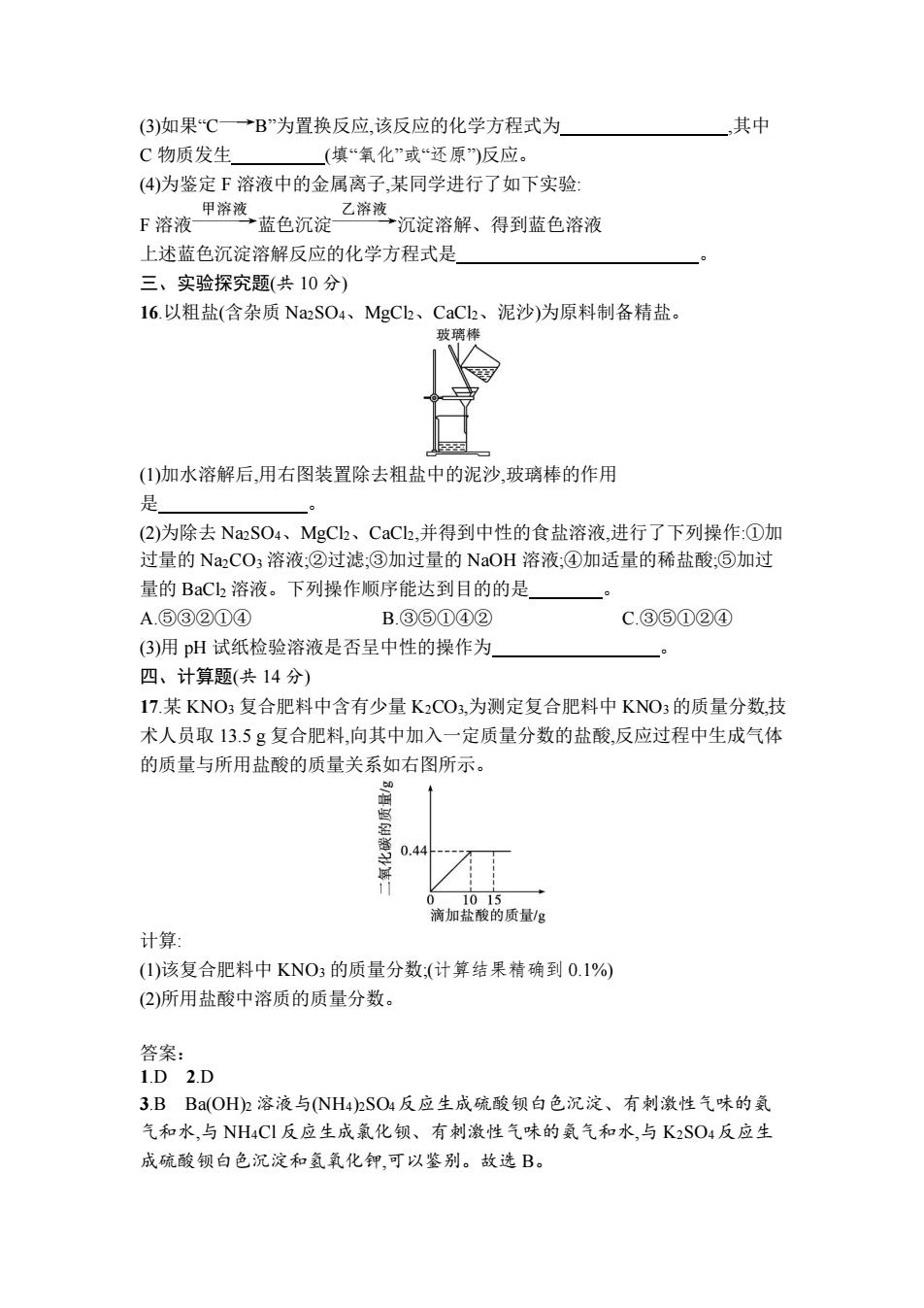
(2)磷酸二氢铵(NH4H2PO4)受热分解时吸收大量的热,并能在可燃物表面形成一层 玻璃状的覆盖层(主要成分为 H3PO4),其灭火原理是 (用化学方程式表示)。 (3)报废灭火器中的 NH4H2PO4 可作化肥,但不能作为 使用。 A.氮肥 B.磷肥 C.钾肥 D.复合肥料 (4)将磷酸二氢铵和氢氧化钙混合研磨就会发生反应,并可闻到刺激性气味,闻到 的具有刺激性气味的气体是 ,它能使润湿的红色石蕊试纸变 色。 13.(6 分)下表是部分物质的溶解性表(室温),利用表中提供的信息回答下列问题。 离子 OH- NO3 - Cl- SO4 2- H+ — 易溶、易挥发 易溶、易挥发 易溶 Na+ 易溶 易溶 易溶 易溶 Ca2+ 易溶 易溶 易溶 微溶 Ba2+ 易溶 易溶 易溶 难溶 (1)酸、碱、盐之间发生的复分解反应,其实质是它们的溶液中离子之间相互结合 生成沉淀、气体或水,否则反应就不能发生,则 BaCl2 溶液与 NaNO3 溶液混合后, (填“能”或“不能”)发生复分解反应。 (2)其中一个有 BaSO4 生成的中和反应的化学方程式为 。 14.(4 分)物质的鉴别、分离和提纯是重要的基本实验操作。 (1)鉴别氢氧化钠和碳酸钠两种溶液,不可选择 。 A.氯化钡溶液 B.硝酸钠溶液 C.稀硫酸 (2)除去硝酸钾溶液中混有的少量硫酸钾,可加入适量的硝酸钡溶液,充分反应后 过滤即可。该反应的化学方程式为 。 15.(15 分)(2022·贵州毕节中考)A~F 是初中化学常见的物质,它们之间的转化关系 如图所示,图中“—”表示两种物质能发生化学反应,“ ”表示两种物质间的转化 关系。 已知:Cu2(OH)2CO3 A+B+C,三者均为氧化物,反应前后各元素化合价均未改 变,D 广泛用于玻璃、造纸、纺织和洗涤剂的生产等,农业上可用 E、F 等配制成 具有杀菌作用的波尔多液作为农药使用。回答下列问题。 (1)D 的化学式为 。 (2)组成元素与 B 完全相同的另一种物质是 (填化学式)
(3)如果℃→B”为置换反应,该反应的化学方程式为 其中 C物质发生 (填“氧化”或“还原)反应。 (4)为鉴定F溶液中的金属离子,某同学进行了如下实验: F溶液 甲帝液,蓝色沉淀乙部液沉淀溶解、得到蓝色溶液 上述蓝色沉淀溶解反应的化学方程式是 三、实验探究题(共10分) 16.以粗盐(含杂质Na2SO4、MgC2、CaC2、泥沙)为原料制备精盐。 玻璃棒 --5 (1)加水溶解后,用右图装置除去粗盐中的泥沙,玻璃棒的作用 是」 (2)为除去Na2SO4、MgC2、CaC2,并得到中性的食盐溶液,进行了下列操作:①加 过量的Na2CO3溶液:②过滤,③加过量的NaOH溶液;④加适量的稀盐酸,⑤加过 量的BaC2溶液。下列操作顺序能达到目的的是 A.⑤③②①④ B.③⑤①④② C.③⑤①②④ (3)用pH试纸检验溶液是否呈中性的操作为 四、计算题(共14分) 17.某KNO3复合肥料中含有少量K2CO3,为测定复合肥料中KNO3的质量分数,技 术人员取13.5g复合肥料,向其中加入一定质量分数的盐酸,反应过程中生成气体 的质量与所用盐酸的质量关系如右图所示。 响 0.44 01015 滴加盐酸的质量/g 计算: (1)该复合肥料中KNO3的质量分数:(计算结果精确到0.1%) (2)所用盐酸中溶质的质量分数。 答案: 1.D2.D 3BB(OH)h溶液与(NH4)2SO4反应生成疏酸钡白色沉淀、有刺激性气味的氨 气和水,与NH4CI反应生成氯化钡、有刺激性气味的氨气和水,与K2SO4反应生 成硫酸钡白色沉淀和氢氧化钾,可以鉴别。故选B
(3)如果“C B”为置换反应,该反应的化学方程式为 ,其中 C 物质发生 (填“氧化”或“还原”)反应。 (4)为鉴定 F 溶液中的金属离子,某同学进行了如下实验: F 溶液 蓝色沉淀 沉淀溶解、得到蓝色溶液 上述蓝色沉淀溶解反应的化学方程式是 。 三、实验探究题(共 10 分) 16.以粗盐(含杂质 Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。 (1)加水溶解后,用右图装置除去粗盐中的泥沙,玻璃棒的作用 是 。 (2)为除去 Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,进行了下列操作:①加 过量的 Na2CO3 溶液;②过滤;③加过量的 NaOH 溶液;④加适量的稀盐酸;⑤加过 量的 BaCl2 溶液。下列操作顺序能达到目的的是 。 A.⑤③②①④ B.③⑤①④② C.③⑤①②④ (3)用 pH 试纸检验溶液是否呈中性的操作为 。 四、计算题(共 14 分) 17.某 KNO3 复合肥料中含有少量 K2CO3,为测定复合肥料中 KNO3的质量分数,技 术人员取 13.5 g 复合肥料,向其中加入一定质量分数的盐酸,反应过程中生成气体 的质量与所用盐酸的质量关系如右图所示。 计算: (1)该复合肥料中 KNO3 的质量分数;(计算结果精确到 0.1%) (2)所用盐酸中溶质的质量分数。 答案: 1.D 2.D 3.B Ba(OH)2 溶液与(NH4)2SO4反应生成硫酸钡白色沉淀、有刺激性气味的氨 气和水,与 NH4Cl 反应生成氯化钡、有刺激性气味的氨气和水,与 K2SO4反应生 成硫酸钡白色沉淀和氢氧化钾,可以鉴别。故选 B

4DD中四种离子能大量共存且是pH=7的无色溶液。A中Ca+和C0?会产生 白色沉淀,B中Cu2+显蓝色,C中含大量OH的溶液的pH>7。故选D。 5.C碳酸钠溶液与稀盐酸反应有二氧化碳气体产生,故反应后溶液质量减小,A 错误:硫酸钠溶液与氯化钡溶液反应后有硫酸钡白色沉淀生成,故反应后溶液质量 减小,B错误:大理石与稀盐酸反应虽然有二氧化碳气体生成,但反应前溶液只是 稀盐酸的质量,由于溶解的大理石的质量大于生成的二氧化碳的质量,所以溶液质 量增大,C正确:碳酸钠溶液与氢氧化钠溶液不反应,溶液质量不变,D错误。 6.C 7D稀硫酸能与铁粉反应生成氢气:稀硫酸能与氧化铜反应生成硫酸铜和水,会 观察到黑色粉末逐渐溶解,溶液变蓝:稀硫酸与木炭粉不反应,A不符合题意。 NaOH溶于水放热,使溶液的温度升高,NH4NO3溶于水吸热,使溶液的温度降 低:NaCI溶于水温度几乎无变化,B不符合题意。二氧化碳能使澄清石灰水变浑 浊,与NOH溶液反应生成碳酸钠和水,与稀盐酸不反应,再将剩余的两种溶液分 别滴加至变浑浊的石灰水中,能使石灰水变澄清的是稀盐酸,无明显变化的是氢氧 化钠溶液,C不符合题意。MgCh溶液、稀盐酸均能与硝酸银溶液反应生成氯化 银白色沉淀,KNO3溶液与AgNO3溶液不反应,不能出现三种明显不同的现象,D 符合题意。 8B氢氧化钠溶于水放出大量热,溶液的温度升高,氯化钠溶于水,溶液的温度基 本不变,A不符合题意:氯化钠与硝酸钡不反应,硫酸钠与硝酸钡反应生成硝酸钠 和硫酸钡沉淀,引入新的杂质,B符合题意;浓疏酸有吸水性,可作千燥剂,能千燥氢 气,C不符合题意;氯化铵中含有铵根离子,与熟石灰混合研磨,生成氨气,产生刺激 性气味,而氯化钾不能,D不符合题意。 9.C丁是大理石的主要成分,则丁是碳酸钙,根据甲、戊为氧化物且甲为黑色固 体,乙、丙分别是酸和碱中的一种及各物质间的转化关系可知,甲为氧化铜(或:四 氧化三铁),戊为二氧化碳,乙为酸,丙为氢氧化钙。乙溶液为酸溶液,能使紫色石蕊 溶液变红,A正确:氢氧化钙与二氧化碳反应生成碳酸钙,B正确;一氧化碳与氧化 铜(或:四氧化三铁)在加热条件下能生成二氧化碳,不属于置换反应,C错误:氧化 铜(或:四氧化三铁)无法通过一步反应生成碳酸钙,D正确。 10.C稀硫酸与氯化钡溶液反应生成白色沉淀硫酸钡和盐酸,因此把氯化钡溶液 滴入稀硫酸中立即产生白色沉淀,当稀硫酸完全反应后沉淀质量不再增大,A正 确:氯化钠溶液与硝酸银溶液反应生成白色沉淀氯化银和硝酸钠,因此把硝酸银溶 液滴入氯化钠溶液中立即产生白色沉淀,当氯化钠完全反应后沉淀质量不再增 大,B正确:硫酸和硫酸铜混合溶液中加入氢氧化钠溶液时,氢氧化钠先与硫酸反 应生成硫酸钠和水,后与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,因此把氢氧化钠 溶液滴入硫酸和硫酸铜混合溶液中时,不能立即产生沉淀,C错误;碳酸氢钠溶液 与稀盐酸反应生成氯化钠、水和二氧化碳,因此把稀盐酸滴入碳酸氢钠溶液中立 即产生气体,D正确
4.D D 中四种离子能大量共存且是 pH=7 的无色溶液。A 中 Ca2+和 CO3 2-会产生 白色沉淀,B 中 Cu2+显蓝色,C 中含大量 OH-的溶液的 pH>7。故选 D。 5.C 碳酸钠溶液与稀盐酸反应有二氧化碳气体产生,故反应后溶液质量减小,A 错误;硫酸钠溶液与氯化钡溶液反应后有硫酸钡白色沉淀生成,故反应后溶液质量 减小,B 错误;大理石与稀盐酸反应虽然有二氧化碳气体生成,但反应前溶液只是 稀盐酸的质量,由于溶解的大理石的质量大于生成的二氧化碳的质量,所以溶液质 量增大,C 正确;碳酸钠溶液与氢氧化钠溶液不反应,溶液质量不变,D 错误。 6.C 7.D 稀硫酸能与铁粉反应生成氢气;稀硫酸能与氧化铜反应生成硫酸铜和水,会 观察到黑色粉末逐渐溶解,溶液变蓝;稀硫酸与木炭粉不反应,A 不符合题意。 NaOH 溶于水放热,使溶液的温度升高;NH4NO3溶于水吸热,使溶液的温度降 低;NaCl 溶于水温度几乎无变化,B 不符合题意。二氧化碳能使澄清石灰水变浑 浊,与 NaOH 溶液反应生成碳酸钠和水,与稀盐酸不反应,再将剩余的两种溶液分 别滴加至变浑浊的石灰水中,能使石灰水变澄清的是稀盐酸,无明显变化的是氢氧 化钠溶液,C 不符合题意。MgCl2 溶液、稀盐酸均能与硝酸银溶液反应生成氯化 银白色沉淀,KNO3 溶液与 AgNO3溶液不反应,不能出现三种明显不同的现象,D 符合题意。 8.B 氢氧化钠溶于水放出大量热,溶液的温度升高,氯化钠溶于水,溶液的温度基 本不变,A 不符合题意;氯化钠与硝酸钡不反应,硫酸钠与硝酸钡反应生成硝酸钠 和硫酸钡沉淀,引入新的杂质,B 符合题意;浓硫酸有吸水性,可作干燥剂,能干燥氢 气,C 不符合题意;氯化铵中含有铵根离子,与熟石灰混合研磨,生成氨气,产生刺激 性气味,而氯化钾不能,D 不符合题意。 9.C 丁是大理石的主要成分,则丁是碳酸钙,根据甲、戊为氧化物且甲为黑色固 体,乙、丙分别是酸和碱中的一种及各物质间的转化关系可知,甲为氧化铜(或:四 氧化三铁),戊为二氧化碳,乙为酸,丙为氢氧化钙。乙溶液为酸溶液,能使紫色石蕊 溶液变红,A 正确;氢氧化钙与二氧化碳反应生成碳酸钙,B 正确;一氧化碳与氧化 铜(或:四氧化三铁)在加热条件下能生成二氧化碳,不属于置换反应,C 错误;氧化 铜(或:四氧化三铁)无法通过一步反应生成碳酸钙,D 正确。 10.C 稀硫酸与氯化钡溶液反应生成白色沉淀硫酸钡和盐酸,因此把氯化钡溶液 滴入稀硫酸中立即产生白色沉淀,当稀硫酸完全反应后沉淀质量不再增大,A 正 确;氯化钠溶液与硝酸银溶液反应生成白色沉淀氯化银和硝酸钠,因此把硝酸银溶 液滴入氯化钠溶液中立即产生白色沉淀,当氯化钠完全反应后沉淀质量不再增 大,B 正确;硫酸和硫酸铜混合溶液中加入氢氧化钠溶液时,氢氧化钠先与硫酸反 应生成硫酸钠和水,后与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,因此把氢氧化钠 溶液滴入硫酸和硫酸铜混合溶液中时,不能立即产生沉淀,C 错误;碳酸氢钠溶液 与稀盐酸反应生成氯化钠、水和二氧化碳,因此把稀盐酸滴入碳酸氢钠溶液中立 即产生气体,D 正确

11.答案:(1)①(2)⑤(3)②(4)③ 12.答案:(1)氮气(或N2) 2NH4HPO△HEPO4+NHt (3)C(4)氨气(或:NH3)蓝 解析:(1)空气中含量最多的气体是氮气。(2)磷酸二氢铵加热分解生成磷酸和氨 气,据此书写化学方程式。(3)磷酸二氢铵中含有磷元素和氨元素,不含钾元素 所以不能用作钾肥。(4)含铵根的盐能与熟石灰发生反应放出氨气,氨气溶于水 会生成氨水,氨水呈碱性,所以能使润湿的红色石蕊试纸变蓝色。 13.答案:(1)不能 (2)H2S04+Ba(OH)BaSO41+2H20 14.答案:(1)B (2)K2SO4+Ba(NO3)2一BaSO4↓+2KNO3 解析(1)氢氧化钠不与氯化钡反应,碳酸钠与氯化钡反应生成沉淀,可以鉴别两种 物质,A正确;氢氧化钠不与硝酸钠反应,碳酸钠不与硝酸钠反应,不可以鉴别两种 物质,B错误:氢氧化钠与稀硫酸反应无明显现象,碳酸钠与稀硫酸反应生成气体, 可以鉴别两种物质C正确。 (2)硫酸钾与硝酸钡发生复分解反应,生成硫酸钡沉 淀和硝酸钾。 15.答案:(1)Na2C03(2)H202 (3)CuO+H,△Cu+H0还原 (4)Cu(OH)2+2HCI一CuC2+2H2O(答案合理即可) 解析:(I)D是碳酸钠,化学式为Na2CO3。 (2)B是水,和水组成元素完全相同的另一种物质是过氧化氢,化学式为H2O2。 (3)置换反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物, 氧化铜与氢气在加热的条件下生成铜和水,满足置换反应的概念,该反应的化学方 程式为Cu0+H△Cu+H20,含氧化合物里面的氧被夺去的反应,叫做还原反应,该 反应中氧化铜失去氧,发生还原反应。 (4)硫酸铜可以与氢氧化钠反应生成氢氧化铜蓝色沉淀,氢氧化铜可以与稀盐酸反 应,生成氯化铜和水,所以蓝色氢氧化铜沉淀溶解反应的化学方程式可以为 Cu(OH)2+2HCl-CuCl2+2H2O. 16.答案:(1)引流(2)C (3)用洁净的玻璃棒蘸取少量溶液,滴在pH试纸上,将试纸显示的颜色与标准比色 卡对照,读取溶液的pH 解析(1)过滤时应该用玻璃棒引流,以防止浊液洒在过滤器外边。(2)除粗盐中 的硫酸钠、氯化镁、CC2、泥沙等杂质时,氢氧化钠用于除掉氯化镁,氯化钡用 于除掉硫酸钠,碳酸钠用于除掉氯化钙和过量的氯化钡,稀盐酸用于除掉过量的氢 氧化钠和碳酸钠。故选C。(3)用洁净的玻璃棒蘸取少量溶液,滴在pH试纸上, 将试纸显示的颜色与标准比色卡对照,读取溶液的pH
11.答案:(1)① (2)⑤ (3)② (4)③ 12.答案:(1)氮气(或:N2) (2)NH4H2PO4 H3PO4+NH3↑ (3)C (4)氨气(或:NH3) 蓝 解析:(1)空气中含量最多的气体是氮气。 (2)磷酸二氢铵加热分解生成磷酸和氨 气,据此书写化学方程式。 (3)磷酸二氢铵中含有磷元素和氮元素,不含钾元素, 所以不能用作钾肥。 (4)含铵根的盐能与熟石灰发生反应放出氨气,氨气溶于水 会生成氨水,氨水呈碱性,所以能使润湿的红色石蕊试纸变蓝色。 13.答案:(1)不能 (2)H2SO4+Ba(OH)2 BaSO4↓+2H2O 14.答案:(1)B (2)K2SO4+Ba(NO3)2 BaSO4↓+2KNO3 解析:(1)氢氧化钠不与氯化钡反应,碳酸钠与氯化钡反应生成沉淀,可以鉴别两种 物质,A 正确;氢氧化钠不与硝酸钠反应,碳酸钠不与硝酸钠反应,不可以鉴别两种 物质,B 错误;氢氧化钠与稀硫酸反应无明显现象,碳酸钠与稀硫酸反应生成气体, 可以鉴别两种物质,C 正确。 (2)硫酸钾与硝酸钡发生复分解反应,生成硫酸钡沉 淀和硝酸钾。 15.答案:(1)Na2CO3 (2)H2O2 (3)CuO+H2 Cu+H2O 还原 (4)Cu(OH)2+2HCl CuCl2+2H2O(答案合理即可) 解析:(1)D 是碳酸钠,化学式为 Na2CO3。 (2)B 是水,和水组成元素完全相同的另一种物质是过氧化氢,化学式为 H2O2。 (3)置换反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物, 氧化铜与氢气在加热的条件下生成铜和水,满足置换反应的概念,该反应的化学方 程式为 CuO+H2 Cu+H2O;含氧化合物里面的氧被夺去的反应,叫做还原反应,该 反应中氧化铜失去氧,发生还原反应。 (4)硫酸铜可以与氢氧化钠反应生成氢氧化铜蓝色沉淀,氢氧化铜可以与稀盐酸反 应,生成氯化铜和水,所以蓝色氢氧化铜沉淀溶解反应的化学方程式可以为 Cu(OH)2+2HCl CuCl2+2H2O。 16.答案:(1)引流 (2)C (3)用洁净的玻璃棒蘸取少量溶液,滴在 pH 试纸上,将试纸显示的颜色与标准比色 卡对照,读取溶液的 pH 解析:(1)过滤时应该用玻璃棒引流,以防止浊液洒在过滤器外边。 (2)除粗盐中 的硫酸钠、氯化镁、CaCl2、泥沙等杂质时,氢氧化钠用于除掉氯化镁,氯化钡用 于除掉硫酸钠,碳酸钠用于除掉氯化钙和过量的氯化钡,稀盐酸用于除掉过量的氢 氧化钠和碳酸钠。故选 C。 (3)用洁净的玻璃棒蘸取少量溶液,滴在 pH 试纸上, 将试纸显示的颜色与标准比色卡对照,读取溶液的 pH

17.答案:(1)89.8%(2)7.3% 解析:根据图像可知,生成二氧化碳的质量为0.44g。 设复合肥料中KNO3的质量分数为x,所用盐酸中溶质的质量分数为y。 2HC+K2CO:一2KC+H2O+CO2↑ 73138 44 10yg13.5g×(1-x) 0.44g 138=135g×1x 44 0.44g 73=108 440.44g 89.8% y=7.3%
17.答案:(1)89.8% (2)7.3% 解析:根据图像可知,生成二氧化碳的质量为 0.44 g。 设复合肥料中 KNO3 的质量分数为 x,所用盐酸中溶质的质量分数为 y。 2HCl+K2CO3 2KCl+H2O+CO2↑ 73 138 44 10y g 13.5 g×(1-x) 0.44 g 138 44 = 13.5 g×(1-𝑥) 0.44 g 73 44 = 10𝑦g 0.44 g x≈89.8% y=7.3%