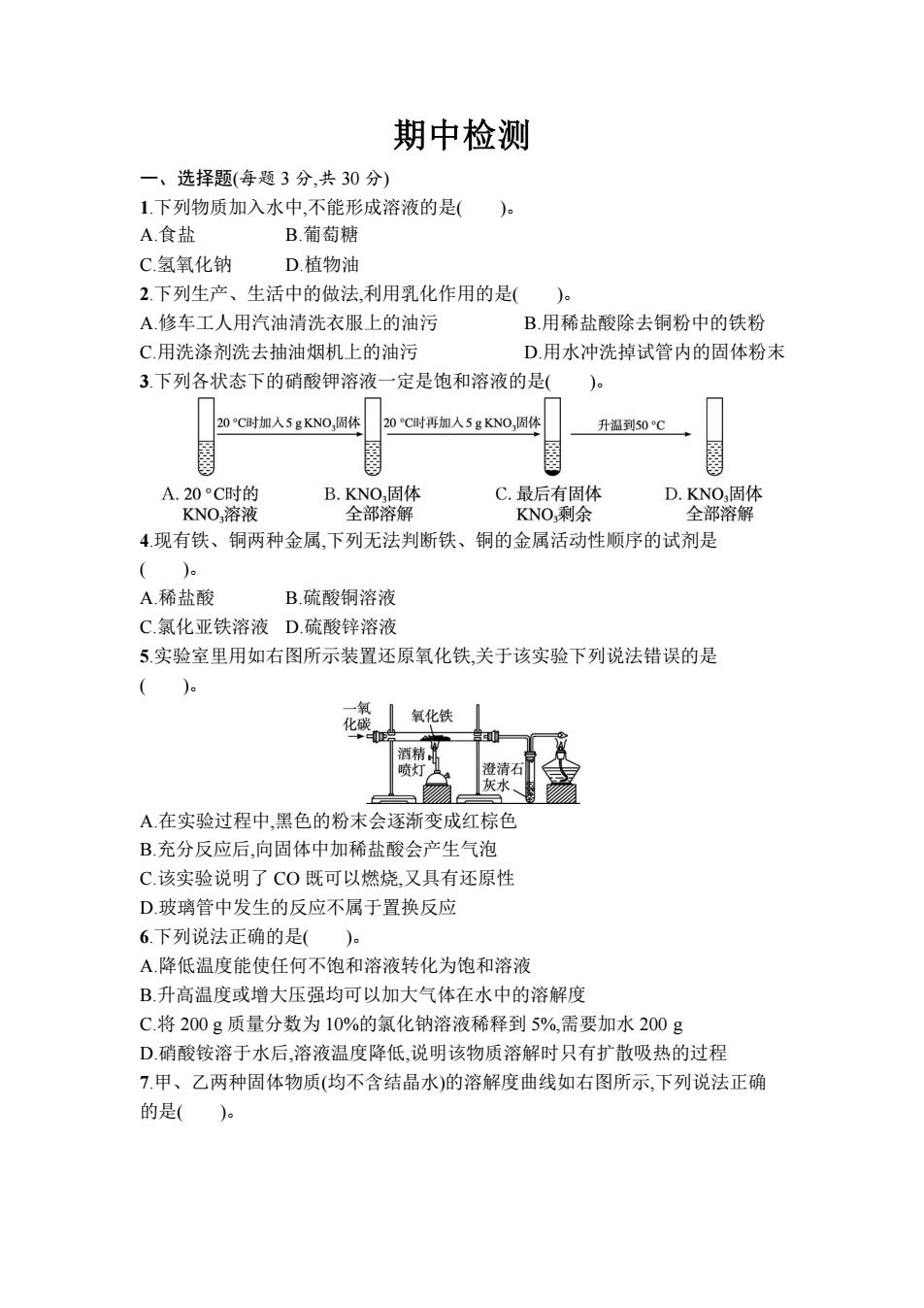
期中检测 一、选择题(每题3分,共30分) 1.下列物质加入水中,不能形成溶液的是( A.食盐 B.葡萄糖 C.氢氧化钠 D.植物油 2.下列生产、生活中的做法,利用乳化作用的是( A.修车工人用汽油清洗衣服上的油污 B.用稀盐酸除去铜粉中的铁粉 C.用洗涤剂洗去抽油烟机上的油污 D.用水冲洗掉试管内的固体粉末 3.下列各状态下的硝酸钾溶液一定是饱和溶液的是()。 20C时加入5gKNO,固体 20C时再加人5gKNO,固体 升温到50C A.20°C时的 B.KNO,固体 C.最后有固体 D.KNO固体 KNO,溶液 全部溶解 KNO剩余 全部溶解 4现有铁、铜两种金属,下列无法判断铁、铜的金属活动性顺序的试剂是 ()。 A稀盐酸 B.硫酸铜溶液 C.氯化亚铁溶液D.硫酸锌溶液 5.实验室里用如右图所示装置还原氧化铁,关于该实验下列说法错误的是 () 化碳 氧化铁 酒精, 喷灯 澄清石 灰水 A.在实验过程中,黑色的粉末会逐渐变成红棕色 B.充分反应后,向固体中加稀盐酸会产生气泡 C.该实验说明了CO既可以燃烧,又具有还原性 D玻璃管中发生的反应不属于置换反应 6.下列说法正确的是()。 A.降低温度能使任何不饱和溶液转化为饱和溶液 B.升高温度或增大压强均可以加大气体在水中的溶解度 C.将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水200g D.硝酸铵溶于水后,溶液温度降低,说明该物质溶解时只有扩散吸热的过程 7甲、乙两种固体物质(均不含结晶水)的溶解度曲线如右图所示,下列说法正确 的是()
期中检测 一、选择题(每题 3 分,共 30 分) 1.下列物质加入水中,不能形成溶液的是( )。 A.食盐 B.葡萄糖 C.氢氧化钠 D.植物油 2.下列生产、生活中的做法,利用乳化作用的是( )。 A.修车工人用汽油清洗衣服上的油污 B.用稀盐酸除去铜粉中的铁粉 C.用洗涤剂洗去抽油烟机上的油污 D.用水冲洗掉试管内的固体粉末 3.下列各状态下的硝酸钾溶液一定是饱和溶液的是( )。 4.现有铁、铜两种金属,下列无法判断铁、铜的金属活动性顺序的试剂是 ( )。 A.稀盐酸 B.硫酸铜溶液 C.氯化亚铁溶液 D.硫酸锌溶液 5.实验室里用如右图所示装置还原氧化铁,关于该实验下列说法错误的是 ( )。 A.在实验过程中,黑色的粉末会逐渐变成红棕色 B.充分反应后,向固体中加稀盐酸会产生气泡 C.该实验说明了 CO 既可以燃烧,又具有还原性 D.玻璃管中发生的反应不属于置换反应 6.下列说法正确的是( )。 A.降低温度能使任何不饱和溶液转化为饱和溶液 B.升高温度或增大压强均可以加大气体在水中的溶解度 C.将 200 g 质量分数为 10%的氯化钠溶液稀释到 5%,需要加水 200 g D.硝酸铵溶于水后,溶液温度降低,说明该物质溶解时只有扩散吸热的过程 7.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如右图所示,下列说法正确 的是( )

40 0 温度C A.1℃时,甲的溶解度大于乙的溶解度 B.2℃时,乙的饱和溶液升温或降温均会析出晶体 C.乙溶液从℃降温到1℃,乙溶液中的溶质质量分数会发生改变 D.3℃时,50g水中加入40g的甲物质充分溶解可得到90g甲的饱和溶液 8.某型号国产飞机机壳采用了先进的铝锂合金材料。己知金属锂(L)的活动性比 铝强,下列有关说法错误的是( A铝锂合金硬度大、密度小 B.铝在空气中,表面会形成致密的氧化膜 C锂能与盐酸反应,放出热量,生成氢气 D.锂能与氧气反应,生成的Li2O中Li显+2价 9.下表列出了不同温度时硝酸钾的溶解度,有关说法正确的是( e 温度/℃0 20 40 50 80 100 溶解度/g13.3 31.6 63.9 110 169 246 A.20℃时,100g水中溶解的硝酸钾越多,溶解度就越大 B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多 D.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小 10.利用钛白粉(TO2)生产海绵钛(T)的工艺流程如右图所示。已知镁能与氮气反 应,下列叙述不正确的是( )e 焦炭 Mg →海绵钛 C钛白粉 T五C分离 反应① 反应② MgCL☑电解Mg、C (800C A.反应①除生成TiC4以外,还生成一种可燃性气体,该气体应该是CO 高温 B.反应②的原理是TiCl4+2Mg一Ti+2MgCh C.反应②需在氩气环境中进行,目的是防止镁被氧化,不能用氮气来代替氩气 D.该工艺流程中可以循环使用的物质只有氯气 二、填空题(共30分) 11.(10分)如图为某小组探究金属化学性质时所做的四个实验,仔细分析后回答下 列问题
A.t1 ℃时,甲的溶解度大于乙的溶解度 B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体 C.乙溶液从 t3 ℃降温到 t1 ℃,乙溶液中的溶质质量分数会发生改变 D.t3 ℃时,50 g 水中加入 40 g 的甲物质充分溶解可得到 90 g 甲的饱和溶液 8.某型号国产飞机机壳采用了先进的铝锂合金材料。已知金属锂(Li)的活动性比 铝强,下列有关说法错误的是( )。 A.铝锂合金硬度大、密度小 B.铝在空气中,表面会形成致密的氧化膜 C.锂能与盐酸反应,放出热量,生成氢气 D.锂能与氧气反应,生成的 Li2O 中 Li 显+2 价 9.下表列出了不同温度时硝酸钾的溶解度,有关说法正确的是( )。 温度/℃ 0 20 40 60 80 100 溶解度/g 13.3 31.6 63.9 110 169 246 A.20 ℃时,100 g 水中溶解的硝酸钾越多,溶解度就越大 B.40 ℃时,100 g 硝酸钾饱和溶液中含有硝酸钾 63.9 g C.100 ℃的水能溶解的硝酸钾一定比 80 ℃的水能溶解的硝酸钾多 D.0 ℃的硝酸钾饱和溶液一定比 60 ℃的硝酸钾饱和溶液的溶质质量分数小 10.利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程如右图所示。已知镁能与氮气反 应,下列叙述不正确的是( )。 A.反应①除生成 TiCl4 以外,还生成一种可燃性气体,该气体应该是 CO B.反应②的原理是 TiCl4+2Mg Ti+2MgCl2 C.反应②需在氩气环境中进行,目的是防止镁被氧化,不能用氮气来代替氩气 D.该工艺流程中可以循环使用的物质只有氯气 二、填空题(共 30 分) 11.(10 分)如图为某小组探究金属化学性质时所做的四个实验,仔细分析后回答下 列问题
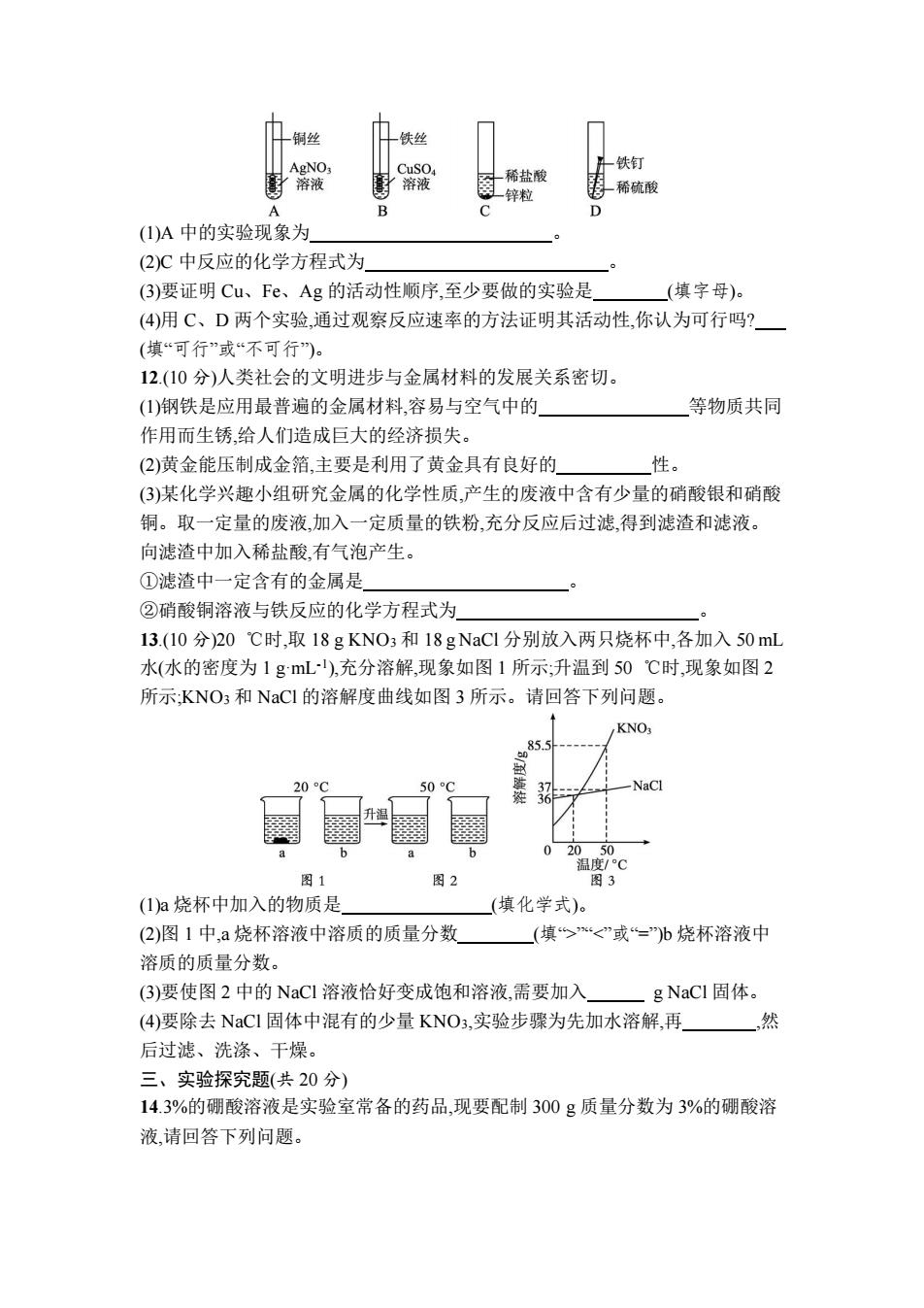
铜丝 铁丝 AgNO CuSO 铁钉 溶液 溶液 一稀盐酸 锌粒 }稀硫酸 A D (I)A中的实验现象为 (2)C中反应的化学方程式为 (3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是 (填字母)。 (4)用C、D两个实验,通过观察反应速率的方法证明其活动性,你认为可行吗? (填“可行”或“不可行)。 12.(10分)人类社会的文明进步与金属材料的发展关系密切。 (1)钢铁是应用最普遍的金属材料,容易与空气中的 等物质共同 作用而生锈,给人们造成巨大的经济损失。 (2)黄金能压制成金箔,主要是利用了黄金具有良好的 性。 (3)某化学兴趣小组研究金属的化学性质,产生的废液中含有少量的硝酸银和硝酸 铜。取一定量的废液,加入一定质量的铁粉,充分反应后过滤,得到滤渣和滤液。 向滤渣中加入稀盐酸,有气泡产生。 ①滤渣中一定含有的金属是 ②硝酸铜溶液与铁反应的化学方程式为 13.(10分)20℃时,取18gKNO3和18gNaC1分别放入两只烧杯中,各加入50mL 水(水的密度为1gmL),充分溶解,现象如图1所示;升温到50℃时,现象如图2 所示:KNO3和NaCI的溶解度曲线如图3所示。请回答下列问题。 KNO 85.5 20°C 50C 貂 NaCl 升温 6 02050 温度/C 图1 图2 图3 (1)a烧杯中加入的物质是 (填化学式)。 (2)图1中,ā烧杯溶液中溶质的质量分数 (填“><”或=)b烧杯溶液中 溶质的质量分数。 (3)要使图2中的NaCI溶液恰好变成饱和溶液,需要加入 g NaCl固体。 (4)要除去NaCI固体中混有的少量KNO3,实验步骤为先加水溶解,再. 然 后过滤、洗涤、干燥。 三、实验探究题(共20分) 14.3%的硼酸溶液是实验室常备的药品,现要配制300g质量分数为3%的硼酸溶 液,请回答下列问题
(1)A 中的实验现象为 。 (2)C 中反应的化学方程式为 。 (3)要证明 Cu、Fe、Ag 的活动性顺序,至少要做的实验是 (填字母)。 (4)用 C、D 两个实验,通过观察反应速率的方法证明其活动性,你认为可行吗? (填“可行”或“不可行”)。 12.(10 分)人类社会的文明进步与金属材料的发展关系密切。 (1)钢铁是应用最普遍的金属材料,容易与空气中的 等物质共同 作用而生锈,给人们造成巨大的经济损失。 (2)黄金能压制成金箔,主要是利用了黄金具有良好的 性。 (3)某化学兴趣小组研究金属的化学性质,产生的废液中含有少量的硝酸银和硝酸 铜。取一定量的废液,加入一定质量的铁粉,充分反应后过滤,得到滤渣和滤液。 向滤渣中加入稀盐酸,有气泡产生。 ①滤渣中一定含有的金属是 。 ②硝酸铜溶液与铁反应的化学方程式为 。 13.(10 分)20 ℃时,取 18 g KNO3 和 18 g NaCl 分别放入两只烧杯中,各加入 50 mL 水(水的密度为 1 g·mL-1 ),充分溶解,现象如图 1 所示;升温到 50 ℃时,现象如图 2 所示;KNO3 和 NaCl 的溶解度曲线如图 3 所示。请回答下列问题。 (1)a 烧杯中加入的物质是 (填化学式)。 (2)图 1 中,a 烧杯溶液中溶质的质量分数 (填“>”“<”或“=”)b 烧杯溶液中 溶质的质量分数。 (3)要使图 2 中的 NaCl 溶液恰好变成饱和溶液,需要加入 g NaCl 固体。 (4)要除去 NaCl 固体中混有的少量 KNO3,实验步骤为先加水溶解,再 ,然 后过滤、洗涤、干燥。 三、实验探究题(共 20 分) 14.3%的硼酸溶液是实验室常备的药品,现要配制 300 g 质量分数为 3%的硼酸溶 液,请回答下列问题
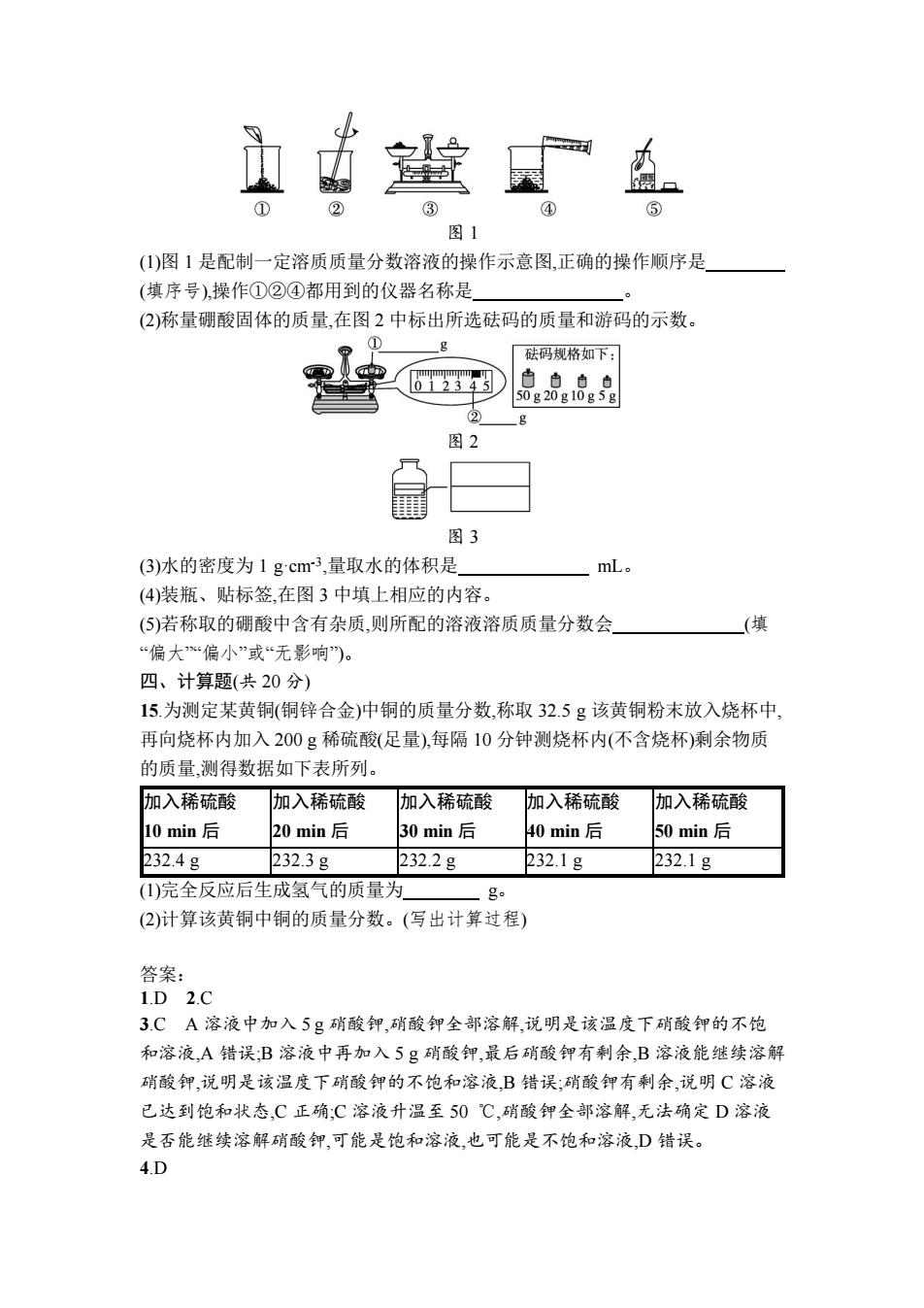
图1 (1)图1是配制一定溶质质量分数溶液的操作示意图,正确的操作顺序是 (填序号),操作①②④都用到的仪器名称是 (2)称量硼酸固体的质量,在图2中标出所选砝码的质量和游码的示数。 砝码规格如下: 白由白白 50g20g10g5g ② 图2 图3 (3)水的密度为1gcm3,量取水的体积是 mL. (4)装瓶、贴标签,在图3中填上相应的内容。 (⑤)若称取的硼酸中含有杂质,则所配的溶液溶质质量分数会 (填 “偏大偏小”或“无影响”)。 四、计算题(共20分) 15.为测定某黄铜(铜锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中, 再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质 的质量,测得数据如下表所列。 加入稀硫酸 加入稀硫酸 加入稀硫酸 加入稀硫酸 加入稀硫酸 10min后 20min后 30min后 40min后 50min后 232.4g 232.3g 232.2g 232.1g 232.1g (1)完全反应后生成氢气的质量为 g (2)计算该黄铜中铜的质量分数。(写出计算过程) 答案: 1.D2.C 3CA溶液中加入5g硝酸钾,硝酸钾全部溶解,说明是该温度下硝酸钾的不饱 和溶液,A错误;B溶液中再加入5g硝酸钾,最后硝酸钾有剩余,B溶液能继续溶解 硝酸钾,说明是该温度下硝酸钾的不饱和溶液,B错误:硝酸钾有剩余,说明C溶液 已达到饱和状态,C正确:C溶液升温至50℃,硝酸钾全部溶解,无法确定D溶液 是否能继续溶解硝酸钾,可能是饱和溶液,也可能是不饱和溶液,D错误。 4.D
图 1 (1)图 1 是配制一定溶质质量分数溶液的操作示意图,正确的操作顺序是 (填序号),操作①②④都用到的仪器名称是 。 (2)称量硼酸固体的质量,在图 2 中标出所选砝码的质量和游码的示数。 图 2 图 3 (3)水的密度为 1 g·cm-3 ,量取水的体积是 mL。 (4)装瓶、贴标签,在图 3 中填上相应的内容。 (5)若称取的硼酸中含有杂质,则所配的溶液溶质质量分数会 (填 “偏大”“偏小”或“无影响”)。 四、计算题(共 20 分) 15.为测定某黄铜(铜锌合金)中铜的质量分数,称取 32.5 g 该黄铜粉末放入烧杯中, 再向烧杯内加入 200 g 稀硫酸(足量),每隔 10 分钟测烧杯内(不含烧杯)剩余物质 的质量,测得数据如下表所列。 加入稀硫酸 10 min 后 加入稀硫酸 20 min 后 加入稀硫酸 30 min 后 加入稀硫酸 40 min 后 加入稀硫酸 50 min 后 232.4 g 232.3 g 232.2 g 232.1 g 232.1 g (1)完全反应后生成氢气的质量为 g。 (2)计算该黄铜中铜的质量分数。(写出计算过程) 答案: 1.D 2.C 3.C A 溶液中加入 5 g 硝酸钾,硝酸钾全部溶解,说明是该温度下硝酸钾的不饱 和溶液,A 错误;B 溶液中再加入 5 g 硝酸钾,最后硝酸钾有剩余,B 溶液能继续溶解 硝酸钾,说明是该温度下硝酸钾的不饱和溶液,B 错误;硝酸钾有剩余,说明 C 溶液 已达到饱和状态,C 正确;C 溶液升温至 50 ℃,硝酸钾全部溶解,无法确定 D 溶液 是否能继续溶解硝酸钾,可能是饱和溶液,也可能是不饱和溶液,D 错误。 4.D

5.A在加热条件下,一氧化碳与氧化铁反应生成了铁和二氧化碳,红棕色固体变 黑,A错误:生成的铁与稀盐酸会产生气泡,B正确:在该实验中,一氧化碳将氧化铁 还原成铁,又能被点燃,说明了一氧化碳既有可燃性,又有还原性,C正确:在玻璃管 中发生的反应是一氧化碳与氧化铁在加热时反应生成了二氧化碳和铁,在该反应 中反应物是两种化合物,不属于置换反应D正确。 6.C溶解度随温度升高而减小的物质(如氢氧化钙),通过降低温度的方法不能使 不饱和溶液转化为饱和溶液,A错误:升高温度,减小了气体在水中的溶解度,B错 误:根据稀释前后溶质的质量不变,设加水的质量为x,200g×10%=(200g+x)×5%, 解得x=200g,C正确:硝酸铵溶于水后,溶液温度降低,说明该物质溶解时扩散吸热 大于水合放热,D错误。 7.B由溶解度曲线可知,1℃时,乙的溶解度大于甲的溶解度,A错误;2℃时,乙 的溶解度最大,故乙的饱和溶液升温或降温均会析出晶体,B正确:乙溶液从3℃ 降温到1℃,其溶解度不变,溶质的质量分数不变,C错误;3℃时,甲的溶解度为 40g,即该温度时,40g甲溶解在100g水中恰好形成饱和溶液,那么5℃时,50g 水中加入40g的甲物质只能溶解20g甲,得到的溶液的质量为70g,D错误。 8D由题意可知,某型号国产飞机机壳采用了先进的铝锂合金材料,说明铝锂合 金硬度大、密度小,A正确:铝在空气中,表面会形成致密的氧化膜,所以铝的耐腐 蚀性强,B正确:由题意可知,锂(L)的活动性比铝强,所以锂能与盐酸反应,放出热 量,生成氢气,C正确:在L2O中,由于氧显-2价,可推出Li显+1价,D错误。 9.D温度不变,物质的溶解度不变,A错误;40℃时,硝酸钾的溶解度为63.9g,即 40℃时,100g水中能溶解63.9g硝酸钾形成饱和溶液,那么40℃时,100g硝酸 钾饱和溶液中含有的硝酸钾小于63.9g,B错误;由于没有确定溶剂的质量,故 100℃的水能溶解的硝酸钾不一定比80℃的水能溶解的硝酸钾多,C错误:0℃ 的硝酸钾的溶解度小于60℃时的溶解度,故0℃的硝酸钾饱和溶液的溶质质量 分数一定比60℃的硝酸钾饱和溶液的溶质质量分数小,D正确。 10D反应①除生成TCL4以外,还生成一种可燃性气体,根据质量守恒定律,化学 反应前后元素的种类不变,故该气体应该是CO,A正确;反应②的原理是金属镁置 换钛,B正确:因为镁能与氨气反应,故不能用氮气来代替氩气,C正确:该工艺流程 中可以循环使用的物质为氯气和镁,D错误。 11.答案:(1)紫红色的铜丝表面附着一层银白色固体,溶液变为蓝色(2)Zn+2HCI 一ZnC2+H2↑(3)A、B(4)不可行 解析:(1)由于在金属活动性顺序中铜的活动性大于银的活动性,所以铜能与硝酸 银溶液发生置换反应生成硝酸铜和银,硝酸铜的水溶液为蓝色,银为银白色,故紫 红色的铜丝表面附着一层银白色固体,溶液变为蓝色。(2)图C中是锌与稀盐酸 的反应,锌的活动性在氢的前面,所以锌与稀盐酸可以反应生成氢气。(3)用于 证明铁、铜、银的金属活动性顺序的实验是A、B,因为由A知铜能置换出硝酸
5.A 在加热条件下,一氧化碳与氧化铁反应生成了铁和二氧化碳,红棕色固体变 黑,A 错误;生成的铁与稀盐酸会产生气泡,B 正确;在该实验中,一氧化碳将氧化铁 还原成铁,又能被点燃,说明了一氧化碳既有可燃性,又有还原性,C 正确;在玻璃管 中发生的反应是一氧化碳与氧化铁在加热时反应生成了二氧化碳和铁,在该反应 中反应物是两种化合物,不属于置换反应,D 正确。 6.C 溶解度随温度升高而减小的物质(如氢氧化钙),通过降低温度的方法不能使 不饱和溶液转化为饱和溶液,A 错误;升高温度,减小了气体在水中的溶解度,B 错 误;根据稀释前后溶质的质量不变,设加水的质量为 x,200 g×10%=(200 g+x)×5%, 解得 x=200 g,C 正确;硝酸铵溶于水后,溶液温度降低,说明该物质溶解时扩散吸热 大于水合放热,D 错误。 7.B 由溶解度曲线可知,t1 ℃时,乙的溶解度大于甲的溶解度,A 错误;t2 ℃时,乙 的溶解度最大,故乙的饱和溶液升温或降温均会析出晶体,B 正确;乙溶液从 t3 ℃ 降温到 t1 ℃,其溶解度不变,溶质的质量分数不变,C 错误;t3 ℃时,甲的溶解度为 40 g,即该温度时,40 g 甲溶解在 100 g 水中恰好形成饱和溶液,那么 t3 ℃时,50 g 水中加入 40 g 的甲物质只能溶解 20 g 甲,得到的溶液的质量为 70 g,D 错误。 8.D 由题意可知,某型号国产飞机机壳采用了先进的铝锂合金材料,说明铝锂合 金硬度大、密度小,A 正确;铝在空气中,表面会形成致密的氧化膜,所以铝的耐腐 蚀性强,B 正确;由题意可知,锂(Li)的活动性比铝强,所以锂能与盐酸反应,放出热 量,生成氢气,C 正确;在 Li2O 中,由于氧显-2 价,可推出 Li 显+1 价,D 错误。 9.D 温度不变,物质的溶解度不变,A 错误;40 ℃时,硝酸钾的溶解度为 63.9 g,即 40 ℃时,100 g 水中能溶解 63.9 g 硝酸钾形成饱和溶液,那么 40 ℃时,100 g 硝酸 钾饱和溶液中含有的硝酸钾小于 63.9 g,B 错误;由于没有确定溶剂的质量,故 100 ℃的水能溶解的硝酸钾不一定比 80 ℃的水能溶解的硝酸钾多,C 错误;0 ℃ 的硝酸钾的溶解度小于 60 ℃时的溶解度,故 0 ℃的硝酸钾饱和溶液的溶质质量 分数一定比 60 ℃的硝酸钾饱和溶液的溶质质量分数小,D 正确。 10.D 反应①除生成 TiCl4 以外,还生成一种可燃性气体,根据质量守恒定律,化学 反应前后元素的种类不变,故该气体应该是 CO,A 正确;反应②的原理是金属镁置 换钛,B 正确;因为镁能与氮气反应,故不能用氮气来代替氩气,C 正确;该工艺流程 中可以循环使用的物质为氯气和镁,D 错误。 11.答案:(1)紫红色的铜丝表面附着一层银白色固体,溶液变为蓝色 (2)Zn+2HCl ZnCl2+H2↑ (3)A、B (4)不可行 解析:(1)由于在金属活动性顺序中铜的活动性大于银的活动性,所以铜能与硝酸 银溶液发生置换反应生成硝酸铜和银,硝酸铜的水溶液为蓝色,银为银白色,故紫 红色的铜丝表面附着一层银白色固体,溶液变为蓝色。 (2)图 C 中是锌与稀盐酸 的反应,锌的活动性在氢的前面,所以锌与稀盐酸可以反应生成氢气。 (3)用于 证明铁、铜、银的金属活动性顺序的实验是 A、B,因为由 A 知铜能置换出硝酸

银中的银,说明活动性铜>银,B中的铁能置换出疏酸铜中的铜,说明活动性铁>铜, 所以可得活动性铁>铜>银。(4)因为所用酸的种类不同,不能证明其活动性。 12.答案:(1)氧气、水 (2)延展 (3)①铁、铜、银 2Fe+Cu(NO3)2Cu+Fe(NO3)2 13.答案:(1)KNO3(2)K(3)0.5(4)降温 解析(1)20℃时,氯化钠的溶解度大于硝酸钾的溶解度。取18gKNO3和18g NaCI分别放入两只烧杯中,各加入50mL水,充分溶解,a烧杯底部有固体剩余,则 a烧杯中加入的物质是KNO3。(2)图1中,溶剂质量相等,a烧杯中的溶质质量 小于b烧杯中的溶质质量,所以烧杯溶液中溶质的质量分数小于b烧杯溶液中 溶质的质量分数。(3)50℃时,氯化钠的溶解度是37g,所以要使图2中的NaCI 溶液恰好变成饱和溶液,需要加入0.5gNC1固体。(4)硝酸钾的溶解度受温度 变化影响较大,所以除去NCI固体中混有的少量KNO3,应采用降低温度的方 法。 14.答案:(1)⑤③①④②烧杯(2)①5②4(3)291(4)硼酸3%(5)偏小 解析(1)配制一定溶质质量分数溶液的操作步骤为计算、称量、溶解、转移、装 瓶贴签,正确的操作顺序是⑤③①④②:操作①②④都用到的仪器是烧杯。(2) 溶质质量=溶液质量×溶质的质量分数,配制300g质量分数为3%的硼酸溶液,所 需硼酸固体的质量为300g×3%=9g,故选用5g的砝码,游码拨到4g处即可。 (3)需要水的质量为300g-9g=291g,即291L。(4)标签中所填内容是溶液的 名称、溶质的质量分数。(⑤)称取的硼酸中含有杂质,则所配溶液的溶质质量分 数会偏小。 15答案:(1)0.4 (2)解:设参加反应的锌的质量为x。 Zn+H2SO—ZnSO4+H2↑ 65 2 x 0.4g x=13g 该黄铜中铜的质量分数为2513邑×100%-60% 32.5g
银中的银,说明活动性铜>银,B 中的铁能置换出硫酸铜中的铜,说明活动性铁>铜, 所以可得活动性铁>铜>银。 (4)因为所用酸的种类不同,不能证明其活动性。 12.答案:(1)氧气、水 (2)延展 (3)①铁、铜、银 ②Fe+Cu(NO3)2 Cu+Fe(NO3)2 13.答案:(1)KNO3 (2)< (3)0.5 (4)降温 解析:(1)20 ℃时,氯化钠的溶解度大于硝酸钾的溶解度。取 18 g KNO3 和 18 g NaCl 分别放入两只烧杯中,各加入 50 mL 水,充分溶解,a 烧杯底部有固体剩余,则 a 烧杯中加入的物质是 KNO3。 (2)图 1 中,溶剂质量相等,a 烧杯中的溶质质量 小于 b 烧杯中的溶质质量,所以 a 烧杯溶液中溶质的质量分数小于 b 烧杯溶液中 溶质的质量分数。 (3)50 ℃时,氯化钠的溶解度是 37 g,所以要使图 2 中的 NaCl 溶液恰好变成饱和溶液,需要加入 0.5 g NaCl 固体。 (4)硝酸钾的溶解度受温度 变化影响较大,所以除去 NaCl 固体中混有的少量 KNO3,应采用降低温度的方 法。 14.答案:(1)⑤③①④② 烧杯 (2)①5 ②4 (3)291 (4)硼酸 3% (5)偏小 解析:(1)配制一定溶质质量分数溶液的操作步骤为计算、称量、溶解、转移、装 瓶贴签,正确的操作顺序是⑤③①④②;操作①②④都用到的仪器是烧杯。 (2) 溶质质量=溶液质量×溶质的质量分数,配制 300 g 质量分数为 3%的硼酸溶液,所 需硼酸固体的质量为 300 g×3%=9 g,故选用 5 g 的砝码,游码拨到 4 g 处即可。 (3)需要水的质量为 300 g-9 g=291 g,即 291 mL。 (4)标签中所填内容是溶液的 名称、溶质的质量分数。 (5)称取的硼酸中含有杂质,则所配溶液的溶质质量分 数会偏小。 15.答案:(1)0.4 (2)解:设参加反应的锌的质量为 x。 Zn+H2SO4 ZnSO4+H2↑ 65 2 x 0.4 g 65 2 = 𝑥 0.4 g x=13 g 该黄铜中铜的质量分数为32.5 g-13 g 32.5 g ×100%=60%