
学习要求 第三章 3.1 溶液的通性 3.2 水溶液中的单相 水化学 离子平衡 与水污染 3.3难溶电解质的多相 离子平衡 讲授:6~7课时 3.4 胶体与界面化学 通化 习题讨论:1课时 18967 帽动 越回
水化学 与水污染 学习要求 3.1 溶液的通性 3.2 水溶液中的单相 离子平衡 3.3 难溶电解质的多相 离子平衡 讲授:6~7课时 3.4 胶体与界面化学 习题讨论:1课时 第三章

学习要求 各晷晷光 1.了解溶液的通性。 2.明确酸碱的近代概念、酸碱的解离 平衡和缓冲溶液的概念,能进行同离 子效应及溶液pH的有关计算。 3.初步掌握溶度积和溶解度的基本计 算,了解溶度积规则及其应用。 2025/2/15 上页 下页 2
2025/2/15 2 学习要求 1.了解溶液的通性。 2.明确酸碱的近代概念、酸碱的解离 平衡和缓冲溶液的概念,能进行同离 子效应及溶液pH的有关计算。 3.初步掌握溶度积和溶解度的基本计 算,了解溶度积规则及其应用

3.1溶液的通性 名兴名名晷名名晷云晷兴名兴关 o3.1溶液的通性 3.1.1非电解质溶液的通性 3.1.2电解质溶液的通性 2025/2/15 上页 下页 返回
2025/2/15 3 3.1 溶液的通性 3.1 溶液的通性 3.1.1 非电解质溶液的通性 3.1.2 电解质溶液的通性

3.1溶液的通性 各晷晷光 3.1.1非电解质溶液的通性 难挥发的非电解质稀溶液的性质 (溶液的蒸气压下降、沸点上升、凝固 点下降和溶液渗透压)与一定量溶剂中 所溶解溶质的物质的量成正比。 2025/2/15 上页 下页
2025/2/15 4 3.1 溶液的通性 3.1.1 非电解质溶液的通性 难挥发的非电解质稀溶液的性质 (溶液的蒸气压下降、沸点上升、凝固 点下降和溶液渗透压)与一定量溶剂中 所溶解溶质的物质的量成正比

3.1溶液的通性 区区兴客名名名晷居炎 1、蒸气压下降 稀溶液蒸气压下降的实验 数小时后 卸 纯水糖水 说明溶液的蒸气压小于纯溶剂的蒸气压。 2025/2/15 上页 下页
2025/2/15 5 1. 蒸气压下降 稀溶液蒸气压下降的实验 说明溶液的蒸气压小于纯溶剂的蒸气压。 3.1 溶液的通性
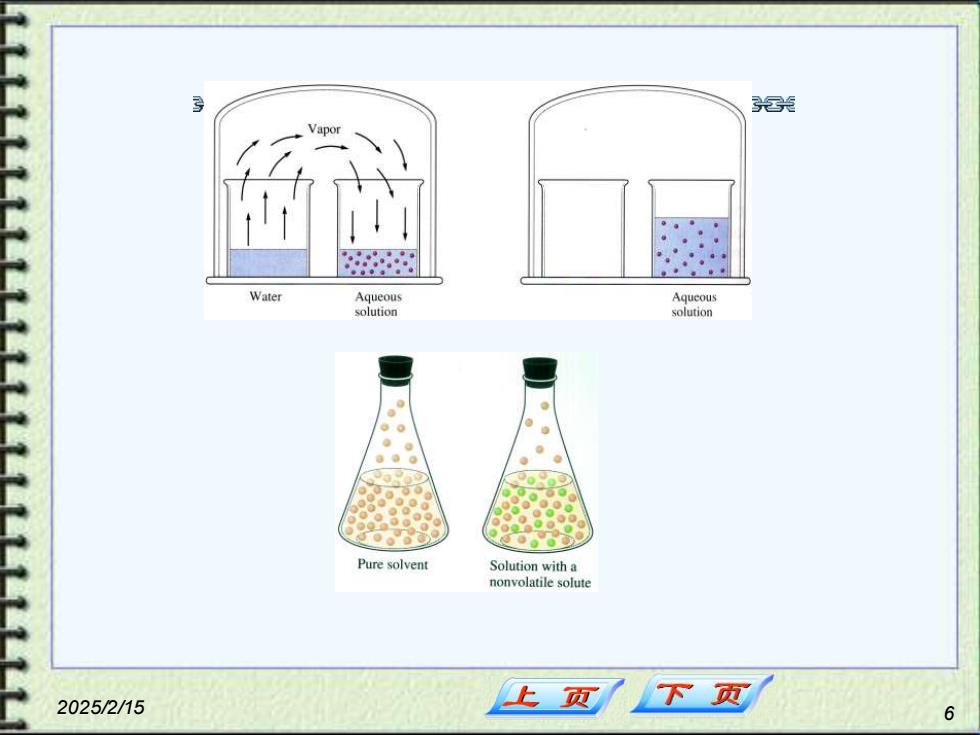
兴 Vapor Water Aqueous Aqucous solution solution Pure sol小vent Solution with a nonvolatile solute 2025/2/15 下页
2025/2/15 6

3.1溶液的通性 各起晷兴 口拉乌尔定律 △P= nB PA △P=xP 结论:溶液的蒸气压比纯溶剂低,溶液浓度 越大,蒸气压下降越多。 2025/2/15 上页 下页
2025/2/15 7 3.1 溶液的通性 拉乌尔定律 B n PA xBPA 结论: 溶液的蒸气压比纯溶剂低,溶液浓度 越大,蒸气压下降越多

2、沸点上升和凝固点下降 溶液的蒸气压总是低于纯溶制的蒸气压导致溶 液的沸点升高和凝固点下降。 △Tbp-kbpm △Tp-kpm 2025/2/15 上页 下页 8
2025/2/15 8 2. 沸点上升和凝固点下降 溶液的蒸气压总是低于纯溶剂的蒸气压导致溶 液的沸点升高和凝固点下降。 △Tbp=kbpm △Tfp=kfpm
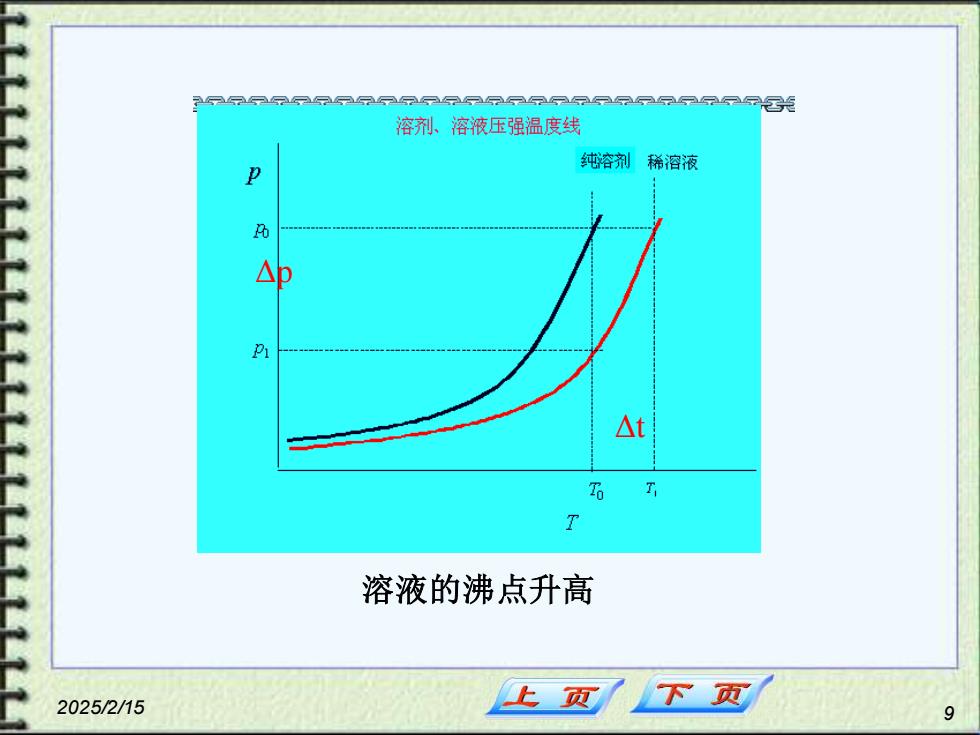
溶剂、溶液压强温度线 纯溶剂稀溶液 西 △p P △t 溶液的沸点升高 2025/2/15 上页 下页 9
2025/2/15 9 溶液的沸点升高 Δt Δp
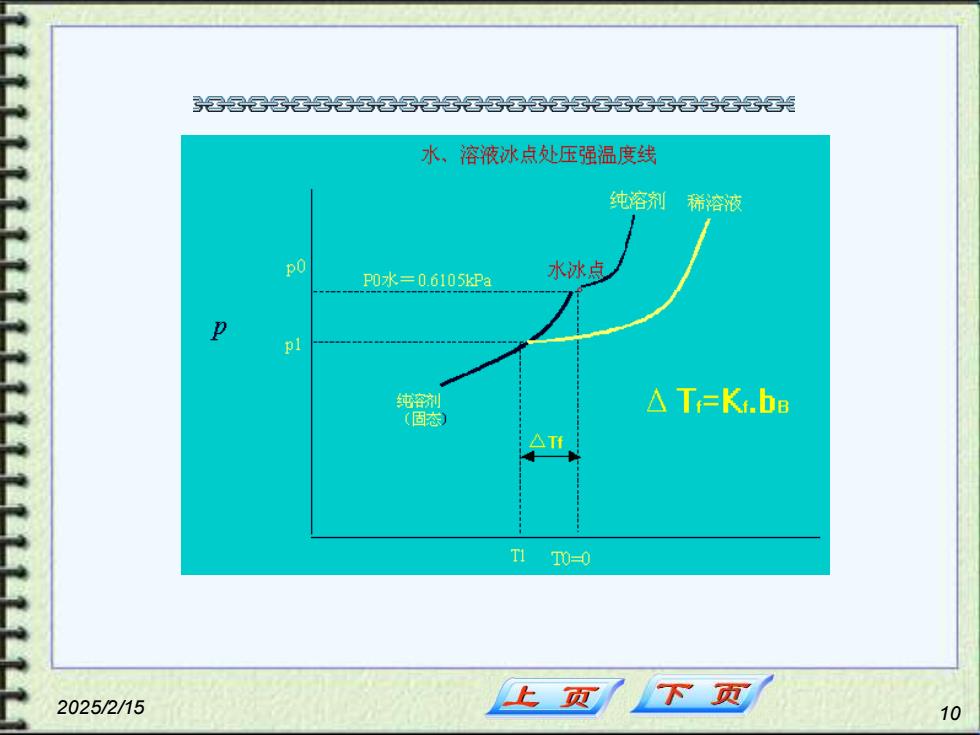
各晷晷光 水、溶液冰点处压强温度线 纯溶剂稀容液 P0水=06105kPa 水冰点 pl 纯容剂 △TeK.bB T0=0 2025/2/15 上页 下页 10
2025/2/15 10