
第4章难溶电解质的 沉淀溶解平衡
第4章 难溶电解质的 沉淀溶解平衡

第一节难溶强电解质的沉淀溶解平衡 第二节沉淀溶解平衡的移动 第三节沉淀溶解平衡在药学中的应用
第一节 难溶强电解质的沉淀溶解平衡 第二节 沉淀溶解平衡的移动 第三节 沉淀溶解平衡在药学中的应用

5 第1节难溶强电解质的沉淀溶解平衡 一、溶度积常数 二、溶度积与溶解度的关系
5 第1节 难溶强电解质的沉淀溶解平衡 一、 溶度积常数 二、溶度积与溶解度的关系

一.溶度积常数Ksp 溶解 AgCl(s) Ag(aq)+C(aq) 沉淀 K a(Ag").a(Cr) a(AgCl) K=Ksp =[Ag"][CI] K称为难溶电解质的溶度积常数,简称溶度积(表示为K。)
一 . 溶度积常数Ksp AgCl (s) Ag + (aq) + Cl - (aq) 溶解 沉淀 (Ag ) (Cl ) (AgCl) a a K a + − = sp K K [Ag ][Cl ] + − = = K 称为难溶电解质的溶度积常数,简称溶度积(表示为 Ksp )

Ag2Cro4 (s)-2Ag*(aq)Cro42(aq) Ksp=[Ag打2[CrO42] 难溶强电解质溶解后一步完全电离 不考虑分步电离
难溶强电解质溶解后一步完全电离 不考虑分步电离 Ag2CrO4 (s) ⇌ 2Ag+ (aq) + CrO4 2- (aq) Ksp =[Ag+ ] 2 [CrO4 2- ]

·AmBn型 ·AmBn(s)、三mAnt(aq)+nBm-(aq) Ksp =[Ant]m[Bm-] 该式表明,在标准态和一定温度下,难溶强电解质的 饱和溶液中各离子浓度幂的乘积为一常数
• AmBn型 • AmBn(s) mAn+(aq) + nBm- (aq) Ksp = [An+] m[Bm- ] n 该式表明,在标准态和一定温度下,难溶强电解质的 饱和溶液中各离子浓度幂的乘积为一常数

二.溶度积和溶解度的关系 (一)AB型难溶强电解质 AgCl (s)=Ag"(aq)Cl(ag) Smol溶解在L中S S 溶解度S:平衡时溶液中溶质分子的 浓度,单位为molL。 有时S以gL形式给出 “难溶”通常指S<0.01g/100gH20
二. 溶度积和溶解度的关系 有时S以g/L形式给出 “难溶”通常指S < 0.01 g/100g H2O 溶解度S: 平衡时溶液中溶质分子的 浓度, 单位为 mol/L。 AgCl (s) ⇌ Ag+ (aq) + Cl- (aq) S mol溶解在1L中 S S (一) AB型难溶强电解质
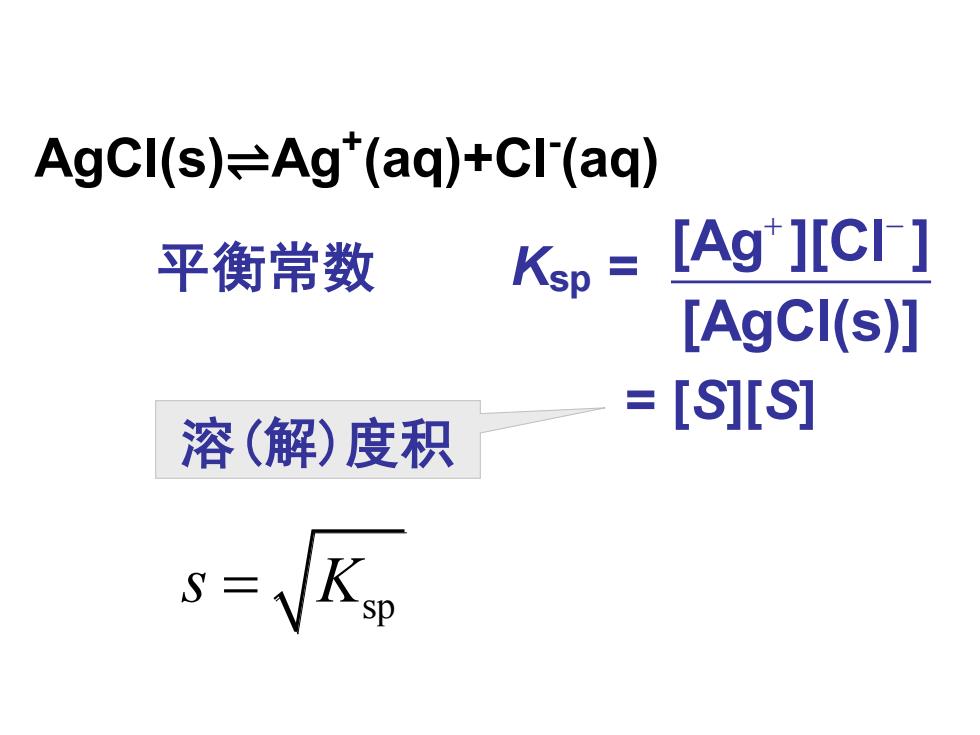
AgCI(s)=Ag"(aq)+Cl(aq) 平衡常数 Ksp [Ag"][CI] [AgCI(s)] =[S][S] 溶(解)度积 S=1
AgCl(s)⇌Ag+ (aq)+Cl- (aq) 平衡常数 Ksp = = [S][S] + − [Ag ][Cl ] [AgCl(s)] 溶(解)度积 sp s K =

例4-1已知298K时,AgCI的Kn为1.77×10-10,计 算它的溶解度。 ·解在AgC的饱和溶液中存在如下沉淀溶解 平衡: AgCl (s)-Ag+(aq)+Cl-(aq) Ks =[Ag"][CI ·设其溶解度为smoL-1, Kp=s2=1.77×10-10 s=V1.77×10-10molL=1.33×10-5mol.L
例4-1 已知298K时,AgCl的Ksp为 1.77×10-10,计 算它的溶解度。 • 解 在AgCl的饱和溶液中存在如下沉淀溶解 平衡: • AgCl (s) Ag+(aq) + Cl−(aq) • 设其溶解度为s mol·L-1, sp K [Ag ][Cl ] + − = 2 10 sp 10 -1 5 -1 1.77 10 1.77 10 mol L 1.33 10 mol L K s s − − − = = = =

(二)AB(或AB,)型难溶强电解质 ·A2B(S) 2A+(aq)+B2-(aq) ·平衡浓度/(moL-1) 2s S Kp=[A+]2[B2-]=(2s)2×s=4s3 S= 4
(二) A2B(或AB2)型难溶强电解质 • A2B(s) 2 A+ (aq) + B2− (aq) • 平衡浓度/ (mol·L-1) 2s s • Ksp 2 2 2 3 [A ] [B ] (2 ) 4 s s s + − = = = sp 3 4 K s =