
第7章 共价健与分子结构 §7.1价键理论 ☒ §7.2杂化轨道理论 园 §7.3价层电子对互斥理论 §7.4分子轨道理论 §7.5分子间力和氢键 §7.6晶体结构与性质
第7章 共价健与分子结构 §7.1价键理论 §7.3价层电子对互斥理论 §7.4分子轨道理论 §7.5分子间力和氢键 §7.2 杂化轨道理论 §7.6晶体结构与性质

除稀有气体可以单原子稳定 存在。其他物质均以分子或晶体 形式存在。由原子按一定方式组 合,原子或离子间以作用力化学 键组合,形成内部结构一一一决定分 子的性质及分子间的作用力一一一物 质的性质
除稀有气体可以单原子稳定 存在,其他物质均以分子或晶体 形式存在,由原子按一定方式组 合,原子或离子间以作用力化学 键组合,形成内部结构-决定分 子的性质及分子间的作用力-物 质的性质

第七章共价健分子结构 7.1价键理论 1916年路易斯提出经典的共价键理论。 认为:原子结合成分子时,是由成键原子双方 各自提供外层单电子组成共用电子对吸引两个 原子核,共用电子对形成后,使每个原子的电 子组态都达到稀有气体的8电子稳定结构即八 隅律,把这种由“共用电子对”维系的化学作 用力称为共价键
第七章 共价键分子结构 1916年路易斯提出经典的共价键理论。 认为:原子结合成分子时,是由成键原子双方 各自提供外层单电子组成共用电子对吸引两个 原子核,共用电子对形成后,使每个原子的电 子组态都达到稀有气体的8电子稳定结构即八 隅律,把这种由“共用电子对”维系的化学作 用力称为共价键。 7.1 价键理论
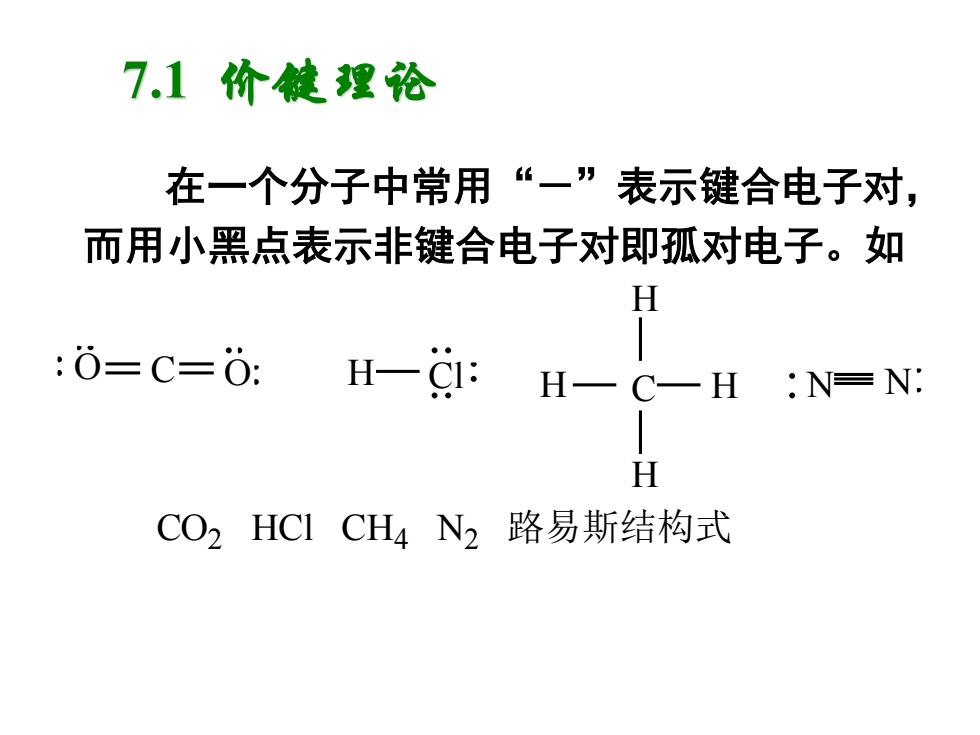
7.1价健理论 在一个分子中常用“一”表示键合电子对, 而用小黑点表示非键合电子对即孤对电子。如 H :0=C=0: / H-C1: H一C一H:N=N: H CO2HC1CH4N2路易斯结构式
在一个分子中常用“-”表示键合电子对, 而用小黑点表示非键合电子对即孤对电子。如 O C O H Cl C H H H H N N CO2 HCl CH4 N2 路易斯结构式 7.1 价键理论
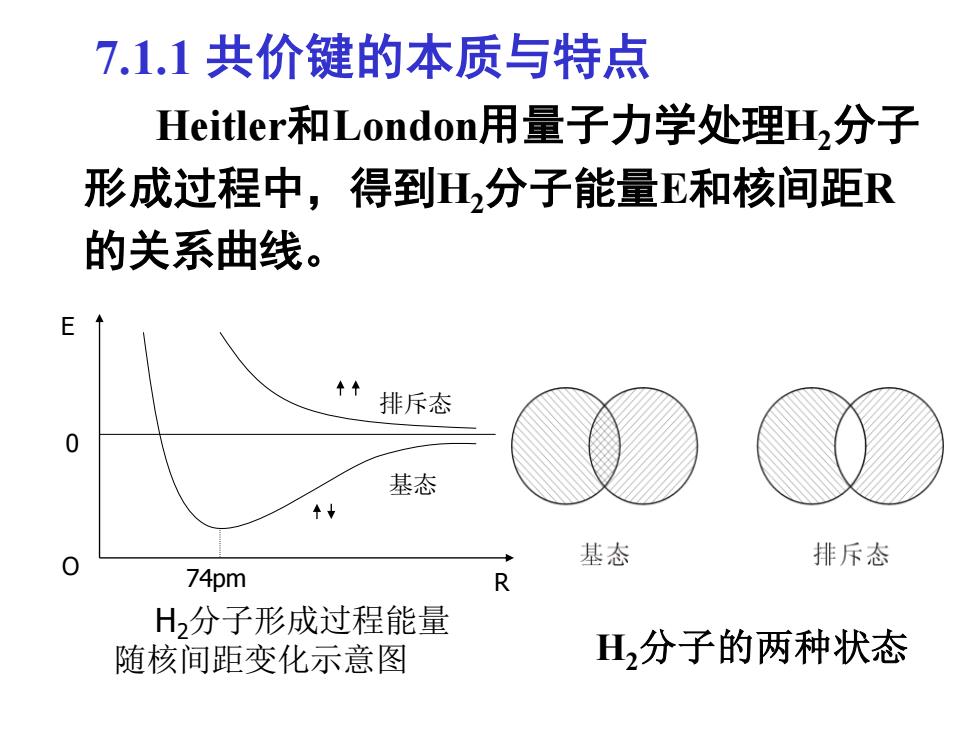
7.1.1共价键的本质与特点 Heitler和London)用量子力学处理H,分子 形成过程中,得到H2分子能量E和核间距R 的关系曲线。 排斥态 基态 基态 排斥态 74pm R H2分子形成过程能量 随核间距变化示意图 H,分子的两种状态
7.1.1 共价键的本质与特点 Heitler和London用量子力学处理H2分子 形成过程中,得到H2分子能量E和核间距R 的关系曲线。 H2分子的两种状态 排斥态 基态 0 O R E 74pm H2分子形成过程能量 随核间距变化示意图

7.1.2价能理论的基本要点 两个氢原子电子自旋方式相反,靠近、重叠, 核间形成一个电子概率密度较大的区域,系统能 量降低,形成氢分子。 (1)电子配对原理: 原子中有未成对电子,这样当两个原子相互 靠近时,自旋方向相反的单电子的原子轨道才可 能相互重叠,形成稳定的共价键
(1)电子配对原理: 原子中有未成对电子,这样当两个原子相互 靠近时,自旋方向相反的单电子的原子轨道才可 能相互重叠,形成稳定的共价键。 7.1.2 价键理论的基本要点 两个氢原子电子自旋方式相反,靠近、重叠, 核间形成一个电子概率密度较大的区域,系统能 量降低,形成氢分子

7.1.2价健理论的基本要点 当两个电子配对成键后,结合的第三个 电子必和已成键的二电子之一自旋方向相同, 而受到强烈的排斥。 原子在基态时,核外价电子层上未成对电 子数是一定的,所形成共价键的数目也是一 定的,因此,一个原子可能形成的共价键数 目等于该原子价电子层中未成对电子数。如 HCl、O2、N2等
当两个电子配对成键后,结合的第三个 电子必和已成键的二电子之一自旋方向相同, 而受到强烈的排斥。 原子在基态时,核外价电子层上未成对电 子数是一定的,所形成共价键的数目也是一 定的,因此,一个原子可能形成的共价键数 目等于该原子价电子层中未成对电子数。如 HCl、O2、N2等。 7.1.2 价键理论的基本要点

7.1.2价健理论的基存要点 (2)最大重叠原理 共价键的形成总是尽可能地实现原子轨 道的最大重叠,重叠越多,形成的共价键越 牢固。 (3)对称性匹配 为实现原子轨道的最大重叠,二原子形 成共价键时,总是尽可能地沿着一定的方向 成键
(2)最大重叠原理 共价键的形成总是尽可能地实现原子轨 道的最大重叠,重叠越多,形成的共价键越 牢固。 (3)对称性匹配 为实现原子轨道的最大重叠,二原子形 成共价键时,总是尽可能地沿着一定的方向 成键。 7.1.2 价键理论的基本要点

7.1.3共价健的特征与美型 1.共价键的特征 ()饱和性 一个电子只能与一个自旋方向相反的电子 配对成键,第三者难于插足。 一个原子可能形成的共价键数目等于该原 子价电子层中未成对电子数。 (2)方向性 原子轨道在空间有一定的伸展方向,只有沿 着原子轨道的伸展方向重叠,才有可能实现原 子轨道的最大重叠,才能形成稳定的共价键
7.1.3 共价键的特征与类型 (1)饱和性 一个电子只能与一个自旋方向相反的电子 配对成键,第三者难于插足。 1. 共价键的特征 一个原子可能形成的共价键数目等于该原 子价电子层中未成对电子数。 原子轨道在空间有一定的伸展方向,只有沿 着原子轨道的伸展方向重叠,才有可能实现原 子轨道的最大重叠, 才能形成稳定的共价键。 (2) 方向性

7.12共价健的特征与美型 2.共价键的类型 (1)σ键: 原子轨道沿着键轴的方向,轨道的伸展方向和 键轴方向一致,以“头碰头”的方式重叠。 特征:实现了原子轨道的最大重叠;重叠部分沿核 间联线键轴对称分布,∴.σ键较牢固。 共价单键都是σ键
(1)σ键: 原子轨道沿着键轴的方向,轨道的伸展方向和 键轴方向一致,以“头碰头”的方式重叠。 特征:实现了原子轨道的最大重叠;重叠部分沿核 间联线键轴对称分布,∴σ键较牢固。 共价单键都是σ键。 2. 共价键的类型 7.1.2 共价键的特征与类型