
第二章原子的结构和性质 2.5元素周期表与元素周期性质 CTOAETNE nEPNOANYECKOTO 3AKOHA △M.MEH△EAEEBA 本节主要内容: A0非9 9双=6869 9466 2.5.1元素周期表 2.5.2原子结构参数 2.5.3原子的电离能 2.5.4电子亲和能 2.5.5电负性 2.5.6相对论效应对元素周期性质的影响
1 本节主要内容: 2.5.1 元素周期表 2.5.2 原子结构参数 2.5.3 原子的电离能 2.5.4 电子亲和能 2.5.5 电负性 2.5.6 相对论效应对元素周期性质的影响 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 1

第二章原子的结构和性质 2.5元素周期与原苏周期性质 2.5.1元素周期表 元素周期表:按照原子序数、原子的电子结构和元素 性质的周期性将已发现的元素排列而成的一种表。在 其中,性质相似的元素按一定的规律周期性的出现。 ★周期号数等于电子层数 ★各周期元素数目等于相应能级组中原子轨道所容 纳的电子总数 ★主族元素的族号数等于原子最外层电子数 ★结构分区: s区一nsl-2 p区一ns2pl-6 d区一(n-1)d-10ns-2(Pd无s电子) f区-(n-2)f-l4(n-1)d0-2ns2 2
2 ★ 周期号数等于电子层数 ★ 各周期元素数目等于相应能级组中原子轨道所容 纳的电子总数 ★ 主族元素的族号数等于原子最外层电子数 ★ 结构分区: s区— ns 1-2 p区— ns 2 np 1-6 d区— (n-1)d1-10ns 1-2 (Pd无s电子) f区— (n-2)f1-14(n-1)d0-2ns 2 元素周期表:按照原子序数、原子的电子结构和元素 性质的周期性将已发现的元素排列而成的一种表。在 其中,性质相似的元素按一定的规律周期性的出现。 第二章 原子的结构和性质 2.5元素周期与原苏周期性质 2.5.1 元素周期表 2

元索表 ▣x IA 图例 0 恢复缺省设置 2 He 1 口碱金属 口非金属 口过渡金属 1.008IIA 口碱土金属 口卤族元素 口调系金属 工IA IVA VA 江A y红IA4.003 Be 口主族金属 03 口稀有气体 口钢家金属 F10 Ne 硼碳 氧 氟 氖 5.941.012 10.8112.0114.016.009.0020.18 11 Na12 Mg 注:表示放时性元素,*表示人造元素。 13 A114 Si15 P16 S17 C118 Ar 镁 铝硅 磷 硫 氯 22.9924.31IIIB IVB VB VIB VIIB VIII IB IIB26.9828.0930.9732.0735.4539.95 19 K20 Ca21 Sc22 Ti23 V24 Cr25 Mn26 Fe27 Co28 Ni 29 Cu30 Zn31 Ga32 Ge33 As34 Se35 Br36 Kr 钾 钙 钛 钒铭锰铁钻 镍铜锌 9.1040.0814.9647.8750.9452.0054.9455.8558.9358.6933.5535.3939.7272.6174.9278.969.9033.80 37 R638 Sr39 Y40 Zx41 Nb42 Mo43 Te44 Ru45 Rh46 Pd47 Ag48 Cd49 In50 Sn51 Sb52 Te53 I54 Xe 铆 锶钇 锆铌钼锝#钉铑钯银镉铟锡 碘 氙 85.4737.6238.91日1.2232.9195.94[98]101.1102.9l06.407.9112.4114.8118.7121.8127.6127.9131.3 55 Cs56 Ba 72 Hf73 Ta74 W75 Re76 0s77 Ir78 Pt79 Au80 Hg81 T182 Pb83 Bi84 PoB5 At86 Rn 铯 钡 铪 钽钨 铼锇铱 铂 金 铊铅 # 破# 132.9137.3 78.5180.9183.8186.2190.2192.2195.1197.0200.6204.4207.2209.0 [210] [210] 222 B7 F:88 Ra 钠系 104 105 106 107 108 109 110111112 114 1I6 118 方 铺# Rf Db S2种* Bh种* ]Hs种* Mt#* n种*uu种*nb* Uug# uo 【223 226] [261] [262] [263] [264] [265]288] [289][272][277] [285] [289] [293] 57 La58 Ce59 PrB0 NdB1 PmB2 Sm83 Eu64 GdB5 Tb66 Dy67 Ho88 Er69 Tm70 Yb71 Lu 铜系 铈 错 0# 铕 铥 138.9h40.1140.9h44.2145]l50.4152.0l57.3158.9162.5164.9hB7.3168.9h73.0l75.0 89 Ac90 The1 PaB2 U93 Np94 Pu95 Am96 Cm37 Bk38 CE99 Es100Fm101Md102No103Lx 钢系 # #鞋# 抽#锋#杯#镅#*锔#*锫#*铜*锿#*锁#* 初#* #* 227] 232.031.0238.0[237][244][243][247][247][251][252][257][258] [259J[260
3

发现元素周期律的 门捷列夫(1834一1907) 1869年, 在对物质、元素的广泛研究中,关于 各种元素的性质的资料,积累日愈丰 富,但是这些资料却是繁杂纷乱的, 人们很难从中获得清晰的认识。整理 这些资料,概括这些感性知识,从中 摸索总结出规律,这是摆在当对化学 家面前一个急待解决的课题,同时也 是科学和生产发展的必然要求。在这 样的科学背景下,从事元素分类工作 和寻找元素之间内在联系的许多化学 家,经过长期的共同努力,取得了一 系列研究成果,其中 最辉煌的成就是俄国化学家 门捷列夫和德国化学家迈尔 先后发现的化学元素周期律
4 1869年, 在对物质、元素的广泛研究中,关于 各种元素的性质的资料,积累日愈丰 富,但是这些资料却是繁杂纷乱的, 人们很难从中获得清晰的认识。整理 这些资料,概括这些感性知识,从中 摸索总结出规律,这是摆在当对化学 家面前一个急待解决的课题,同时也 是科学和生产发展的必然要求。在这 样的科学背景下,从事元素分类工作 和寻找元素之间内在联系的许多化学 家,经过长期的共同努力,取得了一 系列研究成果,其中 发现元素周期律的 门捷列夫(1834一1907) 4 最辉煌的成就是俄国化学家 门捷列夫和德国化学家迈尔 先后发现的化学元素周期律

第二章原子的结构和性质 2.5元素周期表与元素周期性质 ?=/ He 0 n=2 Li Be Ne n=3 Fe P Co Na Ar Cu Sc Zn 7=年 Gd Tb Eu Tc Ru Sm As Se Rh Ho Pm Nb K Br Pd Nd Ga Kr Aq Tm Pr Cd Yb Ce =5 Cm Bk Am 0 Pu Te Es Np Ta Sn Rb Sr In Xe Au Pa La Ha No Th Lr Po 110 Ha Pb Ba At Rf Rn Ac 113 116 117 t+S 7=F 115☐ Fr Ra 118 114■ m 刀=B 。120121
5 第二章 原子的结构和性质 2.5元素周期表与元素周期性质

第二章原子的结构和性质 2.5元素周期表与元素周期性质 元素的原子半径变化 70.9 .0 0, 027237.307000.070.671 18 As B Cu Zn Ga 255 /Sr 阳9 Cr MnFo Co Ni 12 20,3 14.0 30 382 Y 0.00.308.03&70200.5610,3 Cd n Sn Ba Nb Mo Tc Ru Rh Pd Ag 172 18.3 213 3.4 10,90.478888428.529,0m102 14.1 Bi Lu Hr Pb Ta W Re os Ir Pt Au Hg
6 元素的原子半径变化 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 6
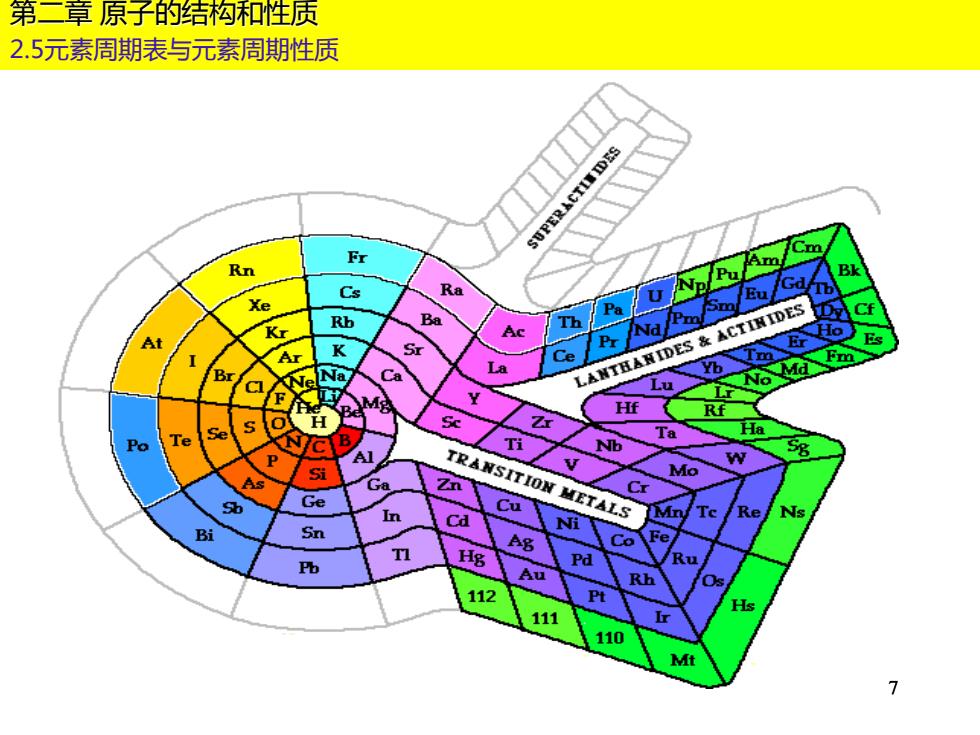
第二章原子的结构和性质 2.5元素周期表与元素周期性质 SUPERACTL靠DS Fr Rn Cs Ra INp/Pa Am/Cm Xe Pa Kr Rb Ba Ac h At Ar K Sr Ce 6 s Br Ca La 亿AW丑A数EDEs&AC工DES C Lu No Md Fm Y Hf Rf Z Se Ta Ha Nb P Al As Si TRANSITION METALS Mo Ga Zn Cr Sb Ge Cu In Cd Mn Re Ns Bi Sn Ni Co Fe T Pb Hg Pd /Ru Au Rh Os 112 Pt Hs 111 110 Mt 7
7 第二章 原子的结构和性质 2.5元素周期表与元素周期性质

第二章原子的结构和性质 2.5元素周期表与元素周期性质 2.5.2原子结构参数 表示原子性质的原子结构参数可分两类: 1.一类是和气态自由原子的性质相关联,如原 子的电离能、电子亲和能、原子光谱线的波 长等,它们和别的原子无关,数值单一。 2.另一类是指化合物中表征原子性质的参数。如 原子半径、电负性等,同一种原子在不同条件 下有不同数值。 8
8 1.一类是和气态自由原子的性质相关联,如原 子的电离能、电子亲和能、原子光谱线的波 长等,它们和别的原子无关,数值单一。 2.5.2 原子结构参数 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 2. 另一类是指化合物中表征原子性质的参数。如 原子半径、电负性等,同一种原子在不同条件 下有不同数值。 表示原子性质的原子结构参数可分两类: 8

第二章原子的结构和性质 2.5元素周期表与元素周期性质 元素性质的周期性 1.有效核电荷Z 元素原子序数增加时,原子有效电荷呈现周期性变化。 同一周期:短周期:从左到右,Z显著增加。 长周期:从左到右,前半部分Z增加不多,后半部分显著增加。 同一族:从上到下,乙增加,但不显著。 Ne 10 20 30 0 图8-20有效核电荷的周期性变化
1.有效核电荷Z* 元素原子序数增加时,原子有效电荷Z *呈现周期性变化。 同一周期:短周期:从左到右,Z *显著增加。 长周期:从左到右,前半部分Z *增加不多,后半部分显著增加。 同一族:从上到下,Z *增加,但不显著。 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 元素性质的周期性

第二章原子的结构和性质 2.5元素周期表与元素周期性质 2.原子半径 假定原子是球形,能够较准确测定相邻原子的核间距,根据原 子的不同存在形式可将原子半径分为: ★金属半径:相邻两个金属原子核间距的一半。 ★共价半径:同种元素的两个原子以共价单键结合时,原子核间距离的一半。 ★van der Waals半径:以分子间力结合的两个同种原子核间距的一半。 原子半径减小 巴 ⑧ P ,a) 2 原子半径增加 033 o 76
第二章 原子的结构和性质 2.5元素周期表与元素周期性质 2.原子半径 假定原子是球形,能够较准确测定相邻原子的核间距,根据原 子的不同存在形式可将原子半径分为: ★ 金属半径:相邻两个金属原子核间距的一半。 ★ 共价半径:同种元素的两个原子以共价单键结合时,原子核间距离的一半。 ★ van der Waals 半径:以分子间力结合的两个同种原子核间距的一半