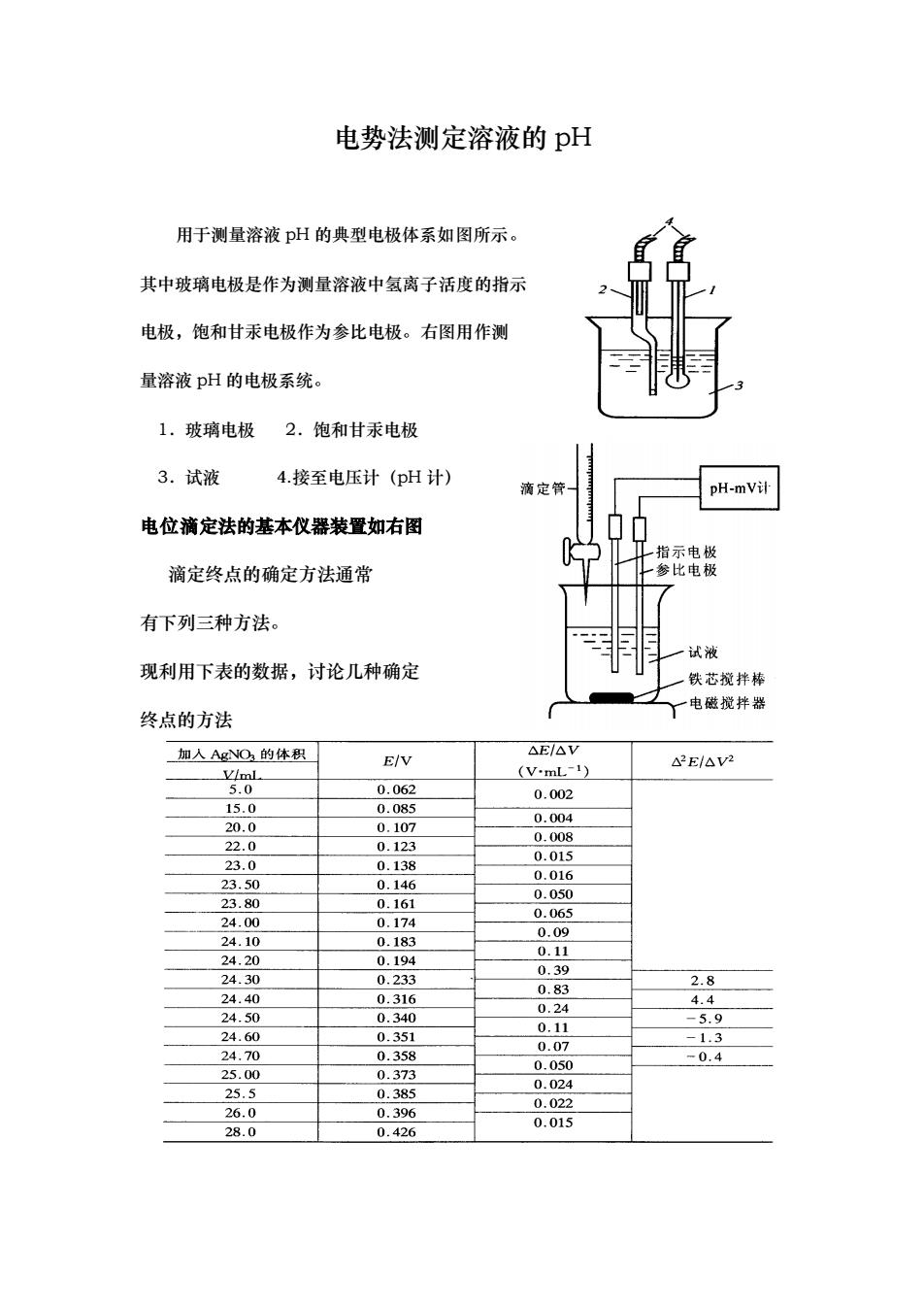
电势法测定溶液的pH 用于测量溶液pH的典型电极体系如图所示。 其中玻璃电极是作为测量溶液中氢离子活度的指示 电极,饱和甘汞电极作为参比电极。右图用作测 量溶液pH的电极系统。 1.玻璃电极2.饱和甘汞电极 3.试液 4接至电压计(pH计) 滴定管 pH-mVil 电位滴定法的基本仪器装置如右图 滴定终点的确定方法通常 参比电松 有下列三种方法。 试液 现利用下表的数据,讨论几种确定 一铁芯搅拌棒 终点的方法 丫电磁授拌器 加人AgNO,的体积 AE/△V E/V 0.062 0.002 150 0.08 22.0 0.123 80 230 0.138 0.015 0.019 0.065 24.00 0.174 24.19 0.183 0.09 0.233 039 2430 2 0 0,83 0316 4.9 0.2 246 0351 24.70 0.358 0.07 0.4 0.050 25.0 26.0 0.022 0.015 28.0 0.426
电势法测定溶液的 pH 用于测量溶液 pH 的典型电极体系如图所示。 其中玻璃电极是作为测量溶液中氢离子活度的指示 电极,饱和甘汞电极作为参比电极。右图用作测 量溶液 pH 的电极系统。 1.玻璃电极 2.饱和甘汞电极 3.试液 4.接至电压计(pH 计) 电位滴定法的基本仪器装置如右图 滴定终点的确定方法通常 有下列三种方法。 现利用下表的数据,讨论几种确定 终点的方法
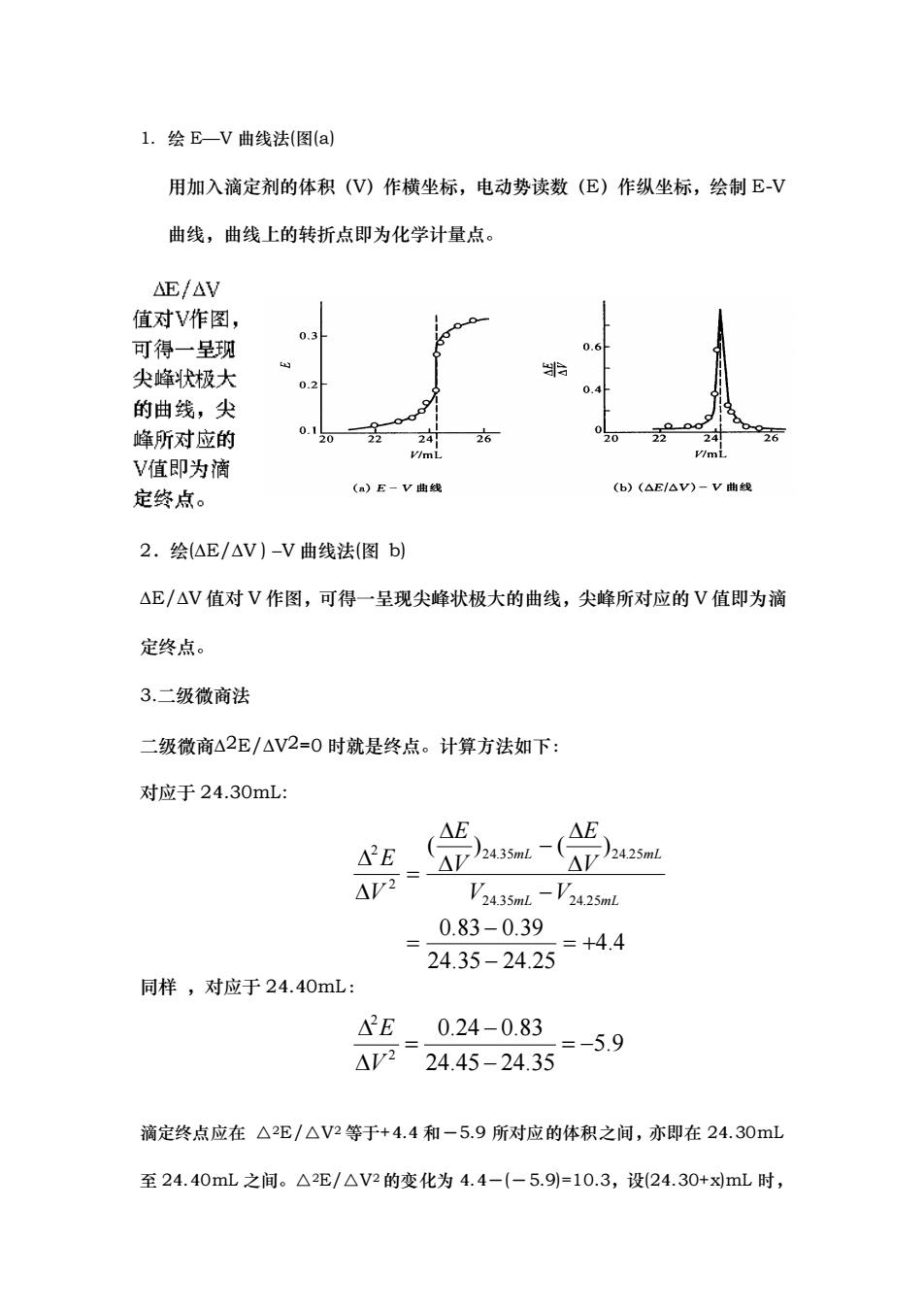
L.绘E-V曲线法(图(a 用加入滴定剂的体积(V)作横坐标,电动势读数(E)作纵坐标,绘制E-V 曲线,曲线上的转折点即为化学计量点。 AE/△V 值对V作图, 可得一呈现 尖峰状极大 0 的曲线,尖 峰所对应的 V值即为滴 (b)(△E/aV)-V曲 定终点。 (a)E-V曲线 2.绘△E/△V)-V曲线法(图b) △E/△V值对V作图,可得一呈现尖峰状极大的曲线,尖峰所对应的V值即为滴 定终点。 3.二级微商法 二级微商△2E/△V2=0时就是终点。计算方法如下: 对应于24.30mL: AE 42E 4P2 AV)2435mL.- AV)2425mL V3435mL-'2425mL 0.83-0.39 =+4.4 24.35-24.25 同样,对应于24.40mL: 2E0.24-0.83 △7-24.45-24.35 =-5.9 滴定终点应在△2E/△V2等于+4.4和-5.9所对应的体积之间,亦即在24.30mL 至24.40mL之间。△2E/△V2的变化为4.4-(-5.9=10.3,设(24.30+xmL时
1. 绘 E—V 曲线法(图(a) 用加入滴定剂的体积(V)作横坐标,电动势读数(E)作纵坐标,绘制 E-V 曲线,曲线上的转折点即为化学计量点。 2.绘(ΔE/ΔV ) –V 曲线法(图 b) ΔE/ΔV 值对 V 作图,可得一呈现尖峰状极大的曲线,尖峰所对应的 V 值即为滴 定终点。 3.二级微商法 二级微商Δ2E/ΔV2=0 时就是终点。计算方法如下: 对应于 24.30mL: 同样 ,对应于 24.40mL: 滴定终点应在 △2E/△V2 等于+4.4 和-5.9 所对应的体积之间,亦即在 24.30mL 至 24.40mL 之间。△2E/△V2 的变化为 4.4-(-5.9)=10.3,设(24.30+x)mL 时, 4.4 24.35 24.25 0.83 0.39 ( ) ( ) 24.35 24.25 24.35 24.25 2 2 = + − − = − − = mL mL mL mL V V V E V E V E 5.9 24.45 24.35 0.24 0.83 2 2 = − − − = V E
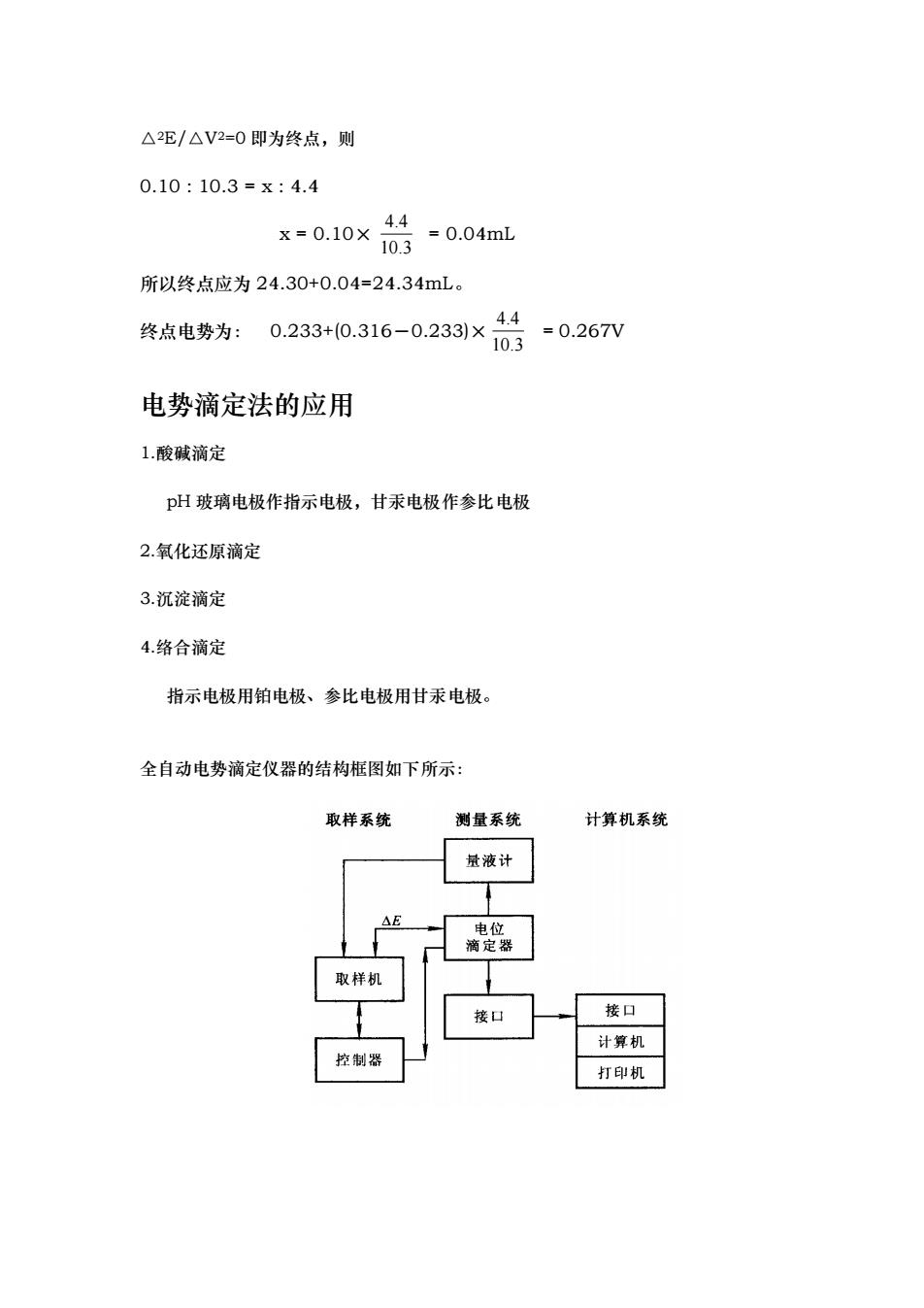
△2E/△V2=0即为终点,则 0.10:10.3=x:4.4 *=0.10x号-004mL 所以终点应为24.30+0.04=24.34mL。 终点电势为: 0.233+10.316-0.233×44 =0.267V 10.3 电势滴定法的应用 1.酸碱滴定 pH玻璃电极作指示电极,甘汞电极作参比电极 2.氧化还原滴定 3.沉淀滴定 4.络合滴定 指示电极用铂电极、参比电极用甘汞电极 全自动电势滴定仪器的结构框图如下所示: 取样系统 测量系统 计算机系统 量液计 机 接口 计算机 控制器 打印机
△2E/△V2=0 即为终点,则 0.10 : 10.3 = x : 4.4 x = 0.10× = 0.04mL 所以终点应为 24.30+0.04=24.34mL。 终点电势为: 0.233+(0.316-0.233)× = 0.267V 电势滴定法的应用 1.酸碱滴定 pH 玻璃电极作指示电极,甘汞电极作参比电极 2.氧化还原滴定 3.沉淀滴定 4.络合滴定 指示电极用铂电极、参比电极用甘汞电极。 全自动电势滴定仪器的结构框图如下所示: 4.4 10.3 4.4 10.3