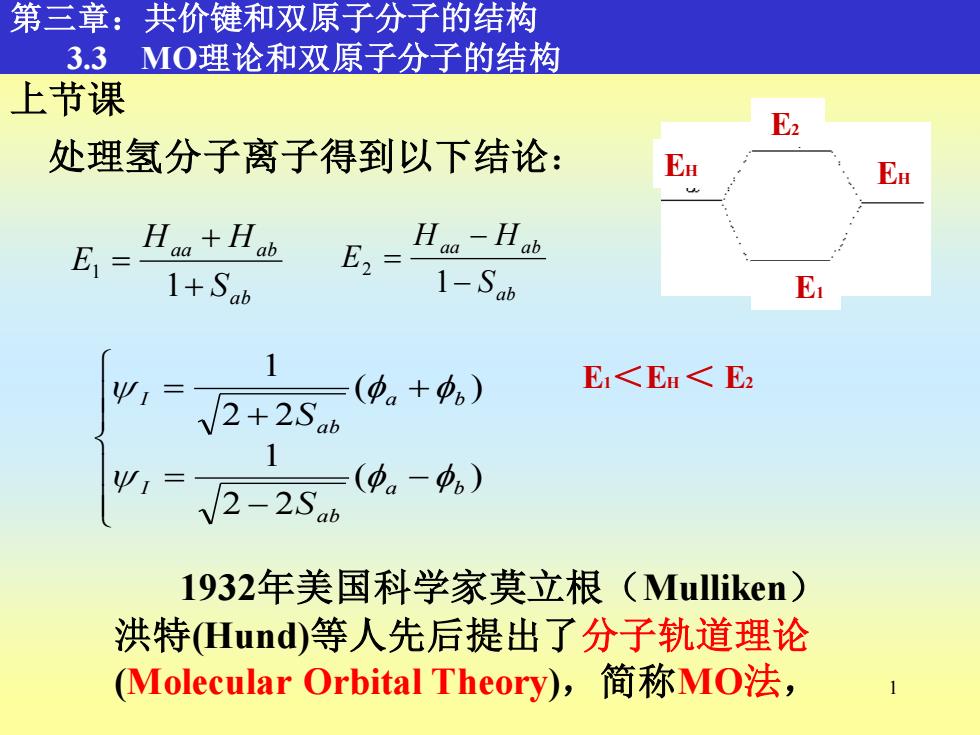
第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构 上节课 E2 处理氢分子离子得到以下结论: Ea Ea E=月+H 1+Sab E2= Haa-Hab 1-Sab E Ψ1= (中。+中) E<E<E2 √2+2Sab 2-2Sab (φ。-中。) 1932年美国科学家莫立根(Mulliken) 洪特Hund)等人先后提出了分子轨道理论 (Molecular Orbital Theory),简称MO法
1 1932年美国科学家莫立根(Mulliken) 洪特(Hund)等人先后提出了分子轨道理论 (Molecular Orbital Theory),简称MO法, 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 E1 E2 EH EH E1<EH < E2 上节课 处理氢分子离子得到以下结论: − − = + + = ( ) 2 2 1 ( ) 2 2 1 a b a b I a b a b I S S ab aa ab S H H E + + = 1 1 ab aa ab S H H E − − = 1 2

第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构分子轨道理论的基本要点 1、分子轨道理论的基本观点是把分子看作 一个整体,其中电子不再从属于某一个原子 而是在整个分子的势场范围内运动。 正如在原子中每个电子的运动状态可用波 函数(业)来描述那样,分子中每个电子的 运动状态也可用相应的波函数来描述
2 1、分子轨道理论的基本观点是把分子看作 一个整体,其中电子不再从属于某一个原子 而是在整个分子的势场范围内运动。 正如在原子中每个电子的运动状态可用波 函数(ψ)来描述那样,分子中每个电子的 运动状态也可用相应的波函数来描述。 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点

第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构分子轨道理论的基本要点 2、分子轨道是由分子中原子的原子轨道线性组合而成, 简称LCAO(linear combination of atomic orbitals的缩写) 组合形成的分子轨道数目与组合前的原子轨道数目相等。 如两个原子轨道Ψ,和w线性组合后形成两个分子轨道Ψ和Ψ2 Ψ1=C1Ψa+C2Ψb Ψ2=C1ΨaC2Ψb 这种组合和杂化轨道不同,杂化轨道是同一原子内部能 量相近的不同类型的轨道重新组合,而分子轨道却是由不同 原子提供的原子轨道的线性组合。 原子轨道用s、p、d、f.表示, 分子轨道则用σ、π、δ.表示。 3
3 2、分子轨道是由分子中原子的原子轨道线性组合而成, 简称LCAO (linear combination of atomic orbitals的缩写)。 组合形成的分子轨道数目与组合前的原子轨道数目相等。 如两个原子轨道ψa和ψb线性组合后形成两个分子轨道ψ1和ψ2 ψ1 =c1ψa +c2ψb ψ2=c1ψa - c2ψb 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 这种组合和杂化轨道不同,杂化轨道是同一原子内部能 量相近的不同类型的轨道重新组合,而分子轨道却是由不同 原子提供的原子轨道的线性组合。 原子轨道用s、p、d、f.表示, 分子轨道则用σ、π、δ.表示

第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构 分子轨道理论的基本要点 3、原子轨道线性组合成分子轨道后,分子轨 道中能量高于原来的原子轨道者称为反键轨道, 能量低于原来的原子轨道者称为成键轨道。 E2 o-B Ea Ea E
4 3、原子轨道线性组合成分子轨道后,分子轨 道中能量高于原来的原子轨道者称为反键轨道, 能量低于原来的原子轨道者称为成键轨道。 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 E1 E2 EH EH
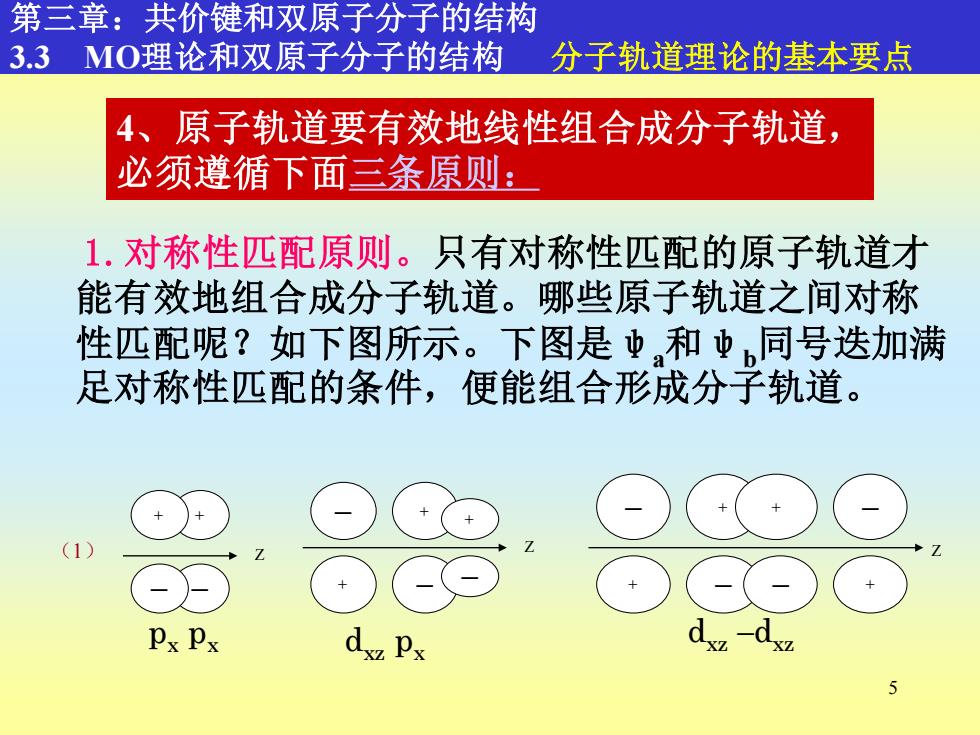
第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构 分子轨道理论的基本要点 4、原子轨道要有效地线性组合成分子轨道, 必须遵循下面三条原则: 1.对称性匹配原则。只有对称性匹配的原子轨道才 能有效地组合成分子轨道。哪些原子轨道之间对称 性匹配呢?如下图所示。下图是中和虫同号迭加满 足对称性匹配的条件,便能组合形成分子轨道。 Px Px XZ 5
5 1.对称性匹配原则。只有对称性匹配的原子轨道才 能有效地组合成分子轨道。哪些原子轨道之间对称 性匹配呢?如下图所示。下图是ψa和ψb同号迭加满 足对称性匹配的条件,便能组合形成分子轨道。 4、原子轨道要有效地线性组合成分子轨道, 必须遵循下面三条原则: 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 + — Z + — (1) px px — + + — + — Z dxz px — + + — + — — + Z dxz –dxz
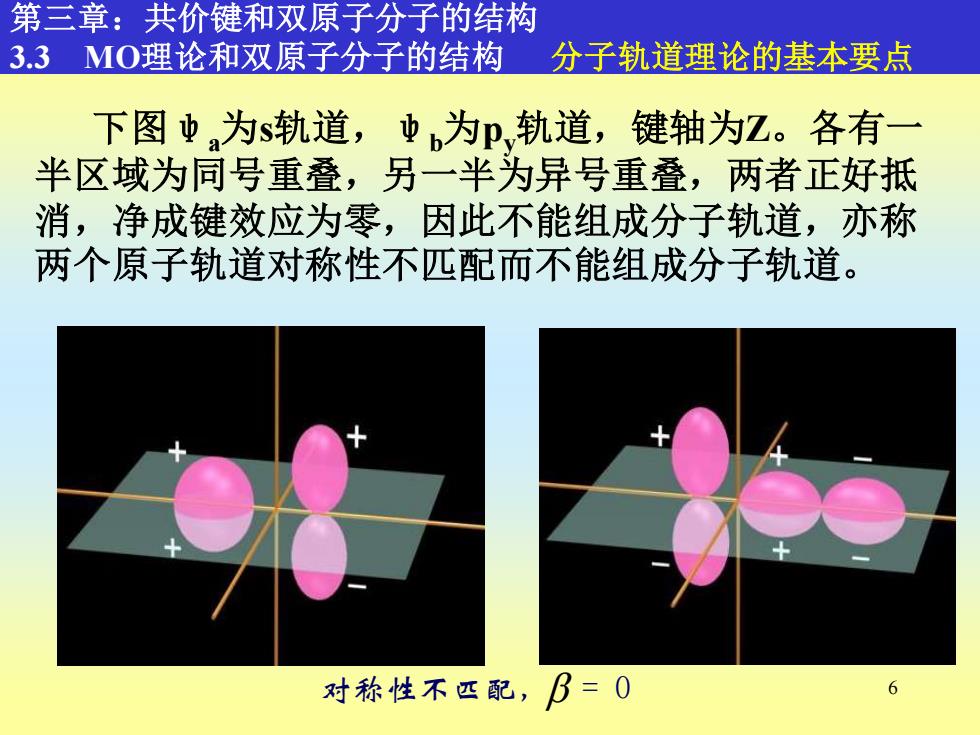
第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构 分子轨道理论的基本要点 下图业为s轨道,为p轨道,键轴为Z。各有一 半区域为同号重叠,另一半为异号重叠,两者正好抵 消,净成键效应为零,因此不能组成分子轨道,亦称 两个原子轨道对称性不匹配而不能组成分子轨道。 对称性不匹配,B=0 6
6 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 下图ψa为s轨道,ψb为py轨道,键轴为Z。各有一 半区域为同号重叠,另一半为异号重叠,两者正好抵 消,净成键效应为零,因此不能组成分子轨道,亦称 两个原子轨道对称性不匹配而不能组成分子轨道。 对称性不匹配, = 0
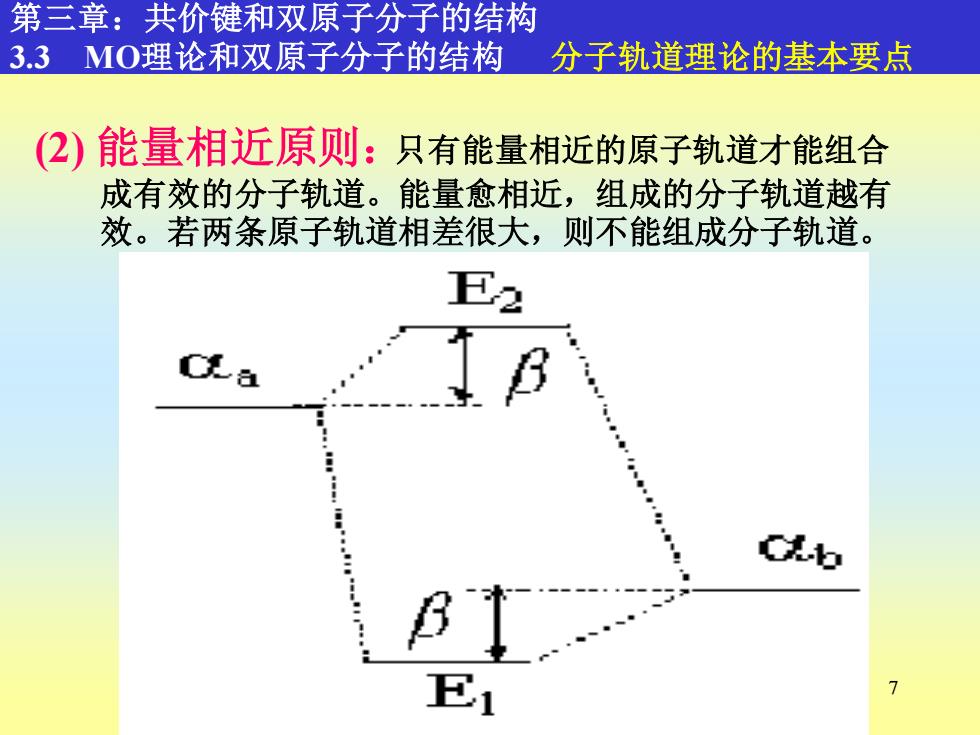
第三章:共价键和双原子分子的结构 33MO理论和双原子分子的结构分子轨道理论的基本要点 (2)能量相近原则:只有能量相近的原子轨道才能组合 成有效的分子轨道。能量愈相近,组成的分子轨道越有 效。若两条原子轨道相差很大,则不能组成分子轨道。 E2 B Cb : B 7
7 只有能量相近的原子轨道才能组合 成有效的分子轨道。能量愈相近,组成的分子轨道越有 效。若两条原子轨道相差很大,则不能组成分子轨道。 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 (2) 能量相近原则:
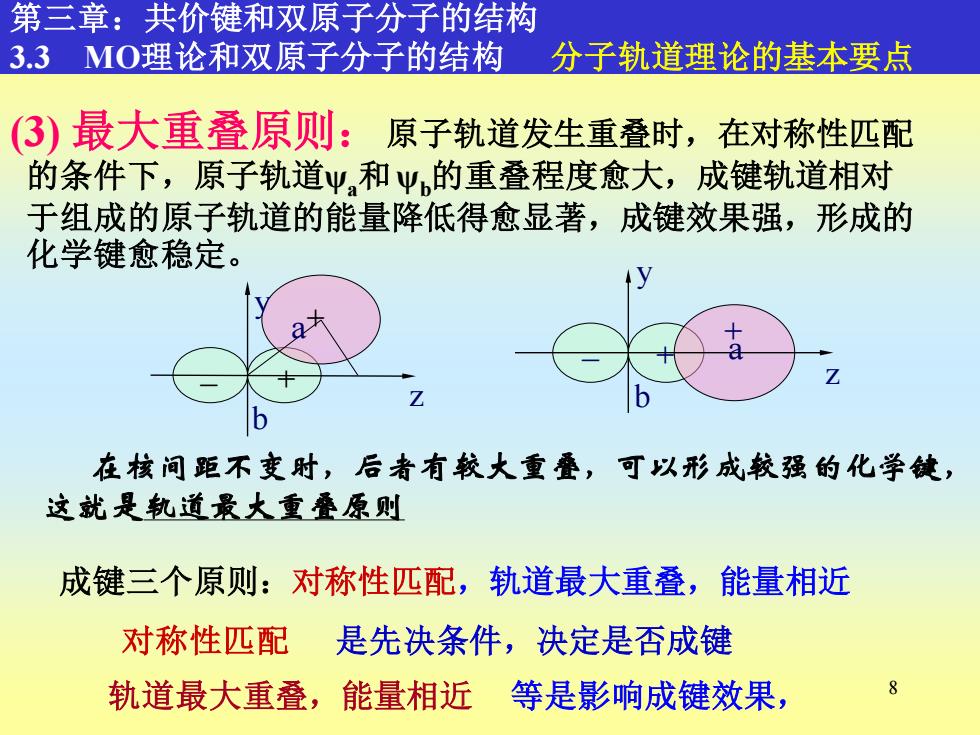
第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构 分子轨道理论的基本要点 (3)最大重叠原则:原子轨道发生重叠时,在对称性匹配 的条件下,原子轨道Ψ,和Ψ的重叠程度愈大,成键轨道相对 于组成的原子轨道的能量降低得愈显著,成键效果强,形成的 化学键愈稳定。 a 在核间距不变时,后者有较大重叠,可以形成较强的化学键, 这就是轨道景大重叠原则 成键三个原则:对称性匹配,轨道最大重叠, 能量相近 对称性匹配 是先决条件,决定是否成键 轨道最大重叠,能量相近 等是影响成键效果, 8
8 原子轨道发生重叠时,在对称性匹配 的条件下,原子轨道ψa和ψb的重叠程度愈大,成键轨道相对 于组成的原子轨道的能量降低得愈显著,成键效果强,形成的 化学键愈稳定。 (3) 最大重叠原则: 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 成键三个原则:对称性匹配,轨道最大重叠,能量相近 对称性匹配 是先决条件,决定是否成键 轨道最大重叠,能量相近 等是影响成键效果, b + _ y z +a a + + _ y z b 在核间距不变时,后者有较大重叠,可以形成较强的化学键, 这就是轨道最大重叠原则
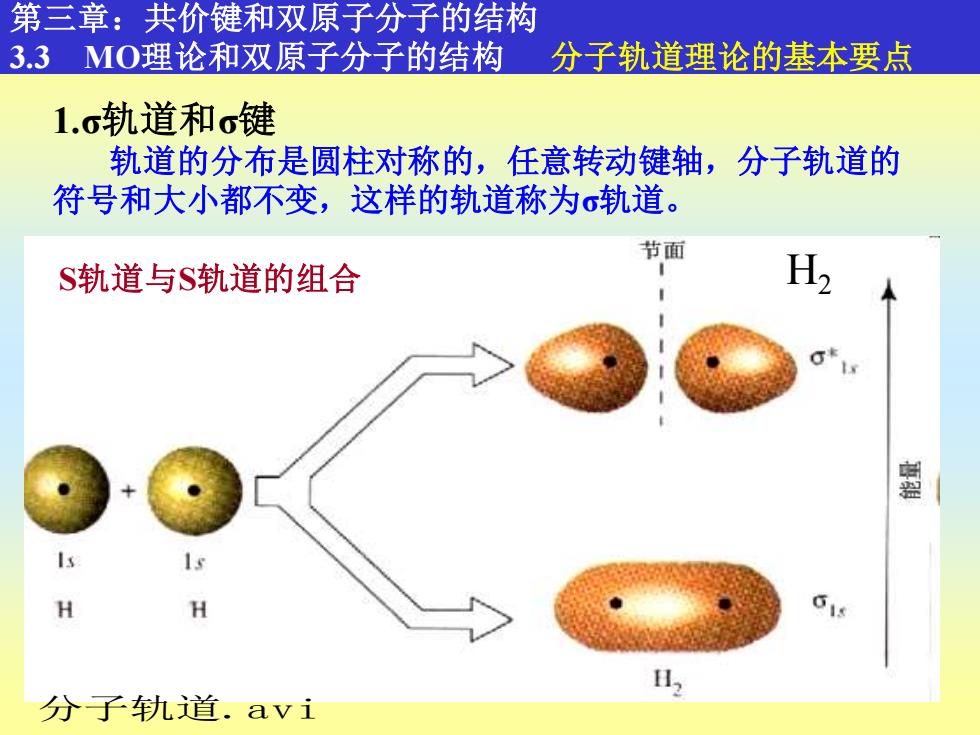
第三章:共价键和双原子分子的结构 3.3MO理论和双原子分子的结构 分子轨道理论的基本要点 1.c轨道和o键 轨道的分布是圆柱对称的,任意转动键轴,分子轨道的 符号和大小都不变,这样的轨道称为σ轨道。 节面 S轨道与S轨道的组合 H2 墨 H H 6 分子轨道.avi
9 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 1.σ轨道和σ键 轨道的分布是圆柱对称的,任意转动键轴,分子轨道的 符号和大小都不变,这样的轨道称为σ轨道。 S轨道与S轨道的组合 H2 分子轨道.avi
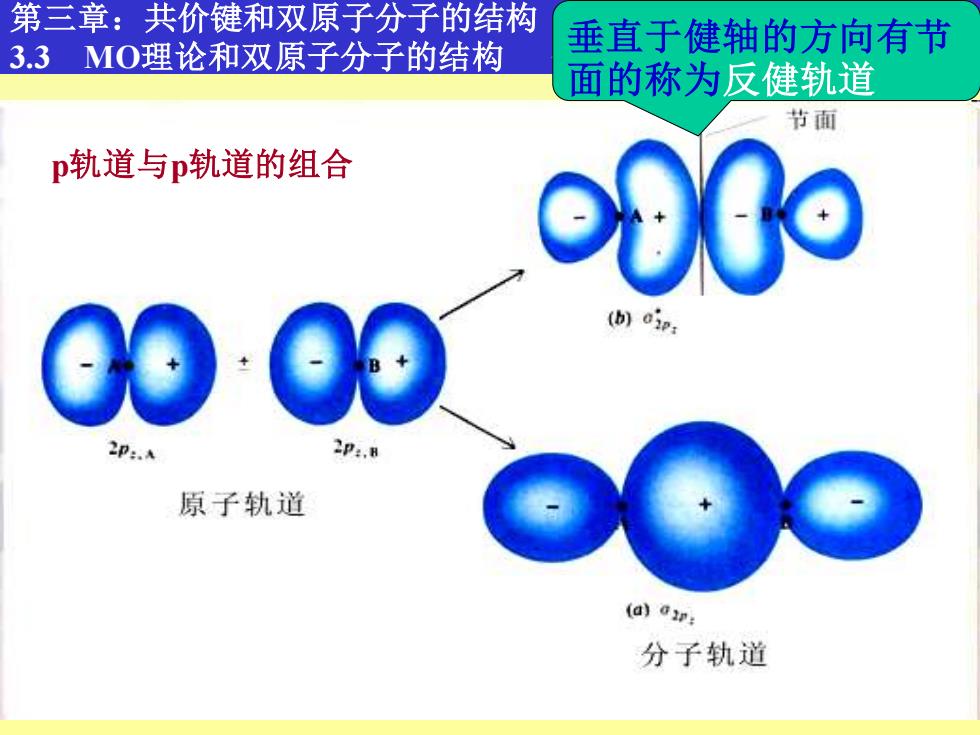
第三章:共价键和双原子分子的结构 垂直于健轴的方向有节 3.3MO理论和双原子分子的结构 面的称为反健轨道 节面 p轨道与p轨道的组合 000 (b)oip p:.A p:. 原子轨道 (a)ar: 分子轨道
10 第三章:共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 分子轨道理论的基本要点 p轨道与p轨道的组合 垂直于健轴的方向有节 面的称为反健轨道