
分新化零电子散常 新最大零化零化工季院 第六章配位滴定法 配位滴定法是以配位反应为基础的滴定分析方法。本章主要内容是以EDTA为滴定剂的配位滴 定方法。配合物在分析化学中有广泛的应用,在定性分析、光度分析、分离和掩蔽等方面都涉及到配 合物的形成,因此需要了解有关的化学平衡问题及其处理方法。配位反应也是路易士酸碱反应,它与 酸碱滴定反应有许多相似之处,但更复杂。这是因为在水溶液中配位反应受到各种因素的影响,例如 酸度、其它配位剂、共存阳离子等,这些因素直接影响了配位反应的完全程度。为了处理上述因素影 响配位平衡的复杂关系,并能进行定量的计算,引入了副反应系数及条件稳定常数的计算公式。这样 处理问题的方法使复杂配位平衡关系的计算大为简化,计算的结果与实际的反应情况比较接近。这种 简便的处理方法也广泛地应用于涉及复杂平衡的其它体系,因此本章也是分析化学的重要基础之一。 §6.1概述 配合物结构的共同特征是都具有中心体,在中心体周围排列者数目不等的配体。中心体所键合的 配位原子数目称为配位数。配合物可以是中性分子,可以是配合阳离子,如C0(NHk2,C(HO 等,或者是配合阴离子,如F©(CN。”,CuC12等。配合物具有一定的立体构型。 根据配位体可提供的配位原子数目不同,可将其与金属离子形成的配合物分成两类。 6.1.1简单配合物 1定义:若一个配位体只含有一个可提供电子对的配位原子,称其为单基配位体,如CN°,CI等。 它与金属离子配合时,每一个单基配位体与中心离子之间只形成一个配位健,此时形成的配合物称为 简单配合物。若金属离子的配位数为,则一个金属离子将与n个配位体结合,形成M物,也称为 简单配合物。 2.性质:简单配合物不稳定。 与多元酸相类似,简单配合物是逐级形成的,也是逐级离解的,一般相邻两级稳定常数相差不大, 而且形成的配合物多数不稳定。 如:Cu2+与单基配位体NH的反应: Cu2++NH;===Cu(NH3)2* K1=104.18 Cu(NH3)++NH;===Cu(NH3)22 K=10348 Cu(NH3)22*+NH3==Cu(NH3)32 K3=10287 Cu(NH):2*+NH;-Cu(NHs) K4=102 正是因为这一性质限制了简单配合物在滴定分析中的应用,仅作为掩蔽剂、显色剂和指示剂,而 作为滴定剂的只有以CN为络合剂的氰量法和以Hg为中心离子的汞量法具有一些实际意义。 如:①以AgNO标准溶液测定氯化物,反应如下: 2CN+AgAg(CN)2 此反应的累积稳定常数为: [Ag(CN), K。AgN导-0
分析化学电子教案 新疆大学化学化工学院 第 1 页 第六章 配位滴定法 配位滴定法是以配位反应为基础的滴定分析方法。本章主要内容是以 EDTA 为滴定剂的配位滴 定方法。配合物在分析化学中有广泛的应用,在定性分析、光度分析、分离和掩蔽等方面都涉及到配 合物的形成,因此需要了解有关的化学平衡问题及其处理方法。配位反应也是路易士酸碱反应,它与 酸碱滴定反应有许多相似之处,但更复杂。这是因为在水溶液中配位反应受到各种因素的影响,例如 酸度、其它配位剂、共存阳离子等,这些因素直接影响了配位反应的完全程度。为了处理上述因素影 响配位平衡的复杂关系,并能进行定量的计算,引入了副反应系数及条件稳定常数的计算公式。这样 处理问题的方法使复杂配位平衡关系的计算大为简化,计算的结果与实际的反应情况比较接近。这种 简便的处理方法也广泛地应用于涉及复杂平衡的其它体系,因此本章也是分析化学的重要基础之一。 §6.1 概述 配合物结构的共同特征是都具有中心体,在中心体周围排列着数目不等的配体。中心体所键合的 配位原子数目称为配位数。配合物可以是中性分子,可以是配合阳离子,如 Co(NH3)6 2+,Cu(H2O)4 2+ 等,或者是配合阴离子,如 Fe(CN)6 3-,CuCl4 2-等。配合物具有一定的立体构型。 根据配位体可提供的配位原子数目不同,可将其与金属离子形成的配合物分成两类。 6.1.1 简单配合物 ⒈定义:若一个配位体只含有一个可提供电子对的配位原子,称其为单基配位体,如 CN-,Cl-等。 它与金属离子配合时,每一个单基配位体与中心离子之间只形成一个配位键,此时形成的配合物称为 简单配合物。若金属离子的配位数为 n,则一个金属离子将与 n 个配位体结合,形成 MIn 物,也称为 简单配合物。 ⒉性质:简单配合物不稳定。 与多元酸相类似,简单配合物是逐级形成的,也是逐级离解的,一般相邻两级稳定常数相差不大, 而且形成的配合物多数不稳定。 如:Cu2+与单基配位体 NH3 的反应: Cu2+ + NH3 === Cu(NH3) 2+ K1=104.18 Cu(NH3) 2+ + NH3 === Cu(NH3)2 2+ K2=103.48 Cu(NH3)2 2+ + NH3 === Cu(NH3)3 2+ K3=102.87 Cu(NH3)3 2+ + NH3 === Cu(NH3)4 2+ K4=102.11 正是因为这一性质限制了简单配合物在滴定分析中的应用,仅作为掩蔽剂、显色剂和指示剂,而 作为滴定剂的只有以 CN-为络合剂的氰量法和以 Hg2+为中心离子的汞量法具有一些实际意义。 如:①以 AgNO3 标准溶液测定氰化物,反应如下: 2CN- +Ag+===[Ag(CN)2] - 此反应的累积稳定常数为: 2 21.1 2 [Ag(CN) ] 10 [Ag ][CN ] K − + − 稳 = =

安前他零电子最素 新最大季化零化工季院 相当稳定。当滴定到计量点时,稍过量的Ag与Ag(CN2结合生成白色AgCN沉淀,使溶液变 浑浊而指示终点。 Ag+Ag(CN)ˉ=2AgCN↓(白色) ②以Hg+溶液作滴定剂,二苯胺基脲作指示剂,滴定C,反应如下: Hg2*+2CI-===HgCl2 生成的HgC2是解离度很小的配合物,称为拟盐或假盐。过量的汞盐与指示剂形成兰紫色的整合 物以指示终点的到达。 6.1.2整合物 1,定义:配位体含有两个或两个以上可提供电子对的配位原子,称其为多基配位体。多基配位体 是在配位滴定中应用最多的配位剂。由于多基配位能提供两个或两个以上的配位原子,它与金属子 位时可以形成环状的配合物,环状的配合物亦称为整合物。 2.性质:稳定性高。 整合物要比同种原子所形成的非整合剂配位的配合物稳定得多。整合物稳定性与成环的数目有 关,当配位原子相同时,成环越多,整合物越稳定,一般是五元环或六元环的整合物最稳定。多基配 位体中含有多个配位原子,它与金属离子配位时,需要较少的配位体,甚至仅与一个配位体配合,这 样就减少甚至避免了分级配位的现象:而且,有的螯合剂对金属离子具有一定的选择性,这些特点对 于应用整合反应进行滴定分析是有利的。因此,在配位滴定中,广泛应用的是有机整合剂。配位滴定 反应通常为配位剂与金属离子的反应。 3.分类 化学分析中,重要的螯合剂,主要有以下几种类型 )“O0型”整合剂 这类整合剂以两个氧原子为键合原子,例如羟基酸、多元酸、多元醇、多元酚等。它们通过氧原 子(硬碱)与金属离子键合,能与硬酸型阳离子形成稳定的整合物。(如酒石酸与A的整合反应P) (②)“NN型”螯合剂 这类螯合剂,如各种有机胺类或含氨杂环化合物等,通过氨原子(中间碱)与金属离子相键合,能 与中间酸和一部分软酸型的阳离子形成稳定的整合物(如1,10一邻二氨菲与F©+生成的整合物P。 (3)“NO型”整合剂 很多金属离子易与螯合剂中的氧原子形成配位键,也有很多离子易与整合剂中的氮原子形成配位 键。如果在同一配体中,既有氧原子,又有氨原子,则必须具有很强的整合能力,可形成NO型稳定 整合物。同时具有氨氮和羧基的氨羧化合物就是这一类整合剂,就称为“O型”整合剂。如氨羧络 合剂、羟基喹啉和一些邻羟基偶氮染料等,通过氧原子(硬碱)和氮原子(中间碱)与金属离子相健合, 能与许多硬酸、软酸和中间酸的阳离子形成稳定的整合物(如8一羟基隆啉与A+的整合物反应P)。 ()含硫整合剂 第2页
分析化学电子教案 新疆大学化学化工学院 第 2 页 相当稳定。当滴定到计量点时,稍过量的 Ag+与 Ag(CN)2 -结合生成白色 AgCN 沉淀,使溶液变 浑浊而指示终点。 Ag++Ag(CN)2 - ===2AgCN↓(白色) ②以 Hg2+溶液作滴定剂,二苯胺基脲作指示剂,滴定 Cl-,反应如下: Hg2++2Cl- ===HgCl2 生成的 HgCl2 是解离度很小的配合物,称为拟盐或假盐。过量的汞盐与指示剂形成兰紫色的螯合 物以指示终点的到达。 6.1.2 螯合物 ⒈ 定义:配位体含有两个或两个以上可提供电子对的配位原子,称其为多基配位体。多基配位体 是在配位滴定中应用最多的配位剂。由于多基配位能提供两个或两个以上的配位原子,它与金属子配 位时可以形成环状的配合物,环状的配合物亦称为螯合物。 ⒉ 性质:稳定性高。 螯合物要比同种原子所形成的非螯合剂配位的配合物稳定得多。螯合物稳定性与成环的数目有 关,当配位原子相同时,成环越多,螯合物越稳定,一般是五元环或六元环的螯合物最稳定。多基配 位体中含有多个配位原子,它与金属离子配位时,需要较少的配位体,甚至仅与一个配位体配合,这 样就减少甚至避免了分级配位的现象;而且,有的螯合剂对金属离子具有一定的选择性,这些特点对 于应用螯合反应进行滴定分析是有利的。因此,在配位滴定中,广泛应用的是有机螯合剂。配位滴定 反应通常为配位剂与金属离子的反应。 ⒊ 分类 化学分析中,重要的螯合剂,主要有以下几种类型 ⑴“OO 型”螯合剂 这类螯合剂以两个氧原子为键合原子,例如羟基酸、多元酸、多元醇、多元酚等。它们通过氧原 子(硬碱)与金属离子键合,能与硬酸型阳离子形成稳定的螯合物。(如洒石酸与 Al3+的螯合反应 P88) ⑵“NN 型”螯合剂 这类螯合剂,如各种有机胺类或含氮杂环化合物等,通过氮原子(中间碱)与金属离子相键合,能 与中间酸和一部分软酸型的阳离子形成稳定的螯合物(如 1,10—邻二氮菲与 Fe3+生成的螯合物 P89)。 ⑶“NO 型”螯合剂 很多金属离子易与螯合剂中的氧原子形成配位键,也有很多离子易与螯合剂中的氮原子形成配位 键。如果在同一配体中,既有氧原子,又有氮原子,则必须具有很强的螯合能力,可形成 NO 型稳定 螯合物。同时具有氨氮和羧基的氨羧化合物就是这一类螯合剂,就称为“NO 型”螯合剂。如氨羧络 合剂、羟基喹啉和一些邻羟基偶氮染料等,通过氧原子(硬碱)和氮原子(中间碱)与金属离子相键合, 能与许多硬酸、软酸和中间酸的阳离子形成稳定的螯合物(如 8-羟基喹啉与 Al3+的螯合物反应 P89)。 ⑷含硫螯合剂

女新化季血子最素 新最大零化季化工季院 含硫螯合剂可分为“SS型”、“SO型”和“SN型”等。 由两个硫原子(软碱)作键合原子的“SS型”整合剂,能与软 酸和一部分中间酸型阳离子形成稳定的整合物,通常多形成较稳 定的四原子环螯合物。 “S0型”和“SN型”整合剂能与许多种阳离子形成整合物, 通常形成较稳定的五原子环整合物。 6.1.3常用的氨羧配位剂 在配位滴定法中常用的氨羧配位剂是以氨基二乙酸基团 HOOCH-C NCHCH2-N HOOCHC [一N(CH2COOH2]为基体的有机配位剂(螯合剂。如:乙二胺四乙酸简称(EDTA) 还有:环己烷二胺四乙酸(CyDTA 乙二醇二乙醚二胺四乙酸(EGTA) 乙二胺四丙酸(EDP) 上述这些氨羧配位剂都具有氢基二乙酸基团[一N(CH2COOH2]或氨基二丙酸基团[一N(CH2 CH2C0OH2],都具有配位能力很强的氨氨、羧氧两种配位原子,是在配位滴定中应用最多的配位剂 其中,乙二胺四乙酸应用的最广泛 6.1.4氨羧配位剂的特点: 1.配位能力强:具有氨氨和羧氧两种配位原子: 2.与金属离子可形成多个五元或六元环: 3.配合物的稳定性很高 4.1:1配位:计算简便 5.配合物水溶性好。 6.1.5配合物在溶液中的离解平衡 在络合反应中,络合物的形成和离解,同处于相对的平衡状态中。其平衡常数,常以形成常数或 稳定常数来表示。 如:金属离子(M)与配位剂(L)可以发生下面的配位反应:M+L一ML Ke西 第3页
分析化学电子教案 新疆大学化学化工学院 第 3 页 含硫螯合剂可分为“SS 型”、“SO 型”和“SN 型”等。 由两个硫原子(软碱)作键合原子的“SS 型”螯合剂,能与软 酸和一部分中间酸型阳离子形成稳定的螯合物,通常多形成较稳 定的四原子环螯合物。 “SO 型”和“SN 型”螯合剂能与许多种阳离子形成螯合物, 通常形成较稳定的五原子环螯合物。 6.1.3 常用的氨羧配位剂 在配位滴定法中常用的氨羧配位剂是以氨基二乙酸基团 [—N(CH2COOH)2]为基体的有机配位剂(螯合剂)。如: 乙二胺四乙酸 简称 (EDTA ) 还有:环己烷二胺四乙酸(CyDTA) 乙二醇二乙醚二胺四乙酸 (EGTA) 乙二胺四丙酸(EDTP) 上述这些氨羧配位剂都具有氨基二乙酸基团[—N(CH2COOH)2]或氨基二丙酸基团[—N(CH2 CH2COOH)2],都具有配位能力很强的氨氮、羧氧两种配位原子,是在配位滴定中应用最多的配位剂, 其中,乙二胺四乙酸应用的最广泛 6.1.4 氨羧配位剂的特点: 1. 配位能力强;具有氨氮和羧氧两种配位原子; 2. 与金属离子可形成多个五元或六元环; 3. 配合物的稳定性很高; 4. 1∶1 配位;计算简便; 5. 配合物水溶性好。 6.1.5 配合物在溶液中的离解平衡 在络合反应中,络合物的形成和离解,同处于相对的平衡状态中。其平衡常数,常以形成常数或 稳定常数来表示。 如:金属离子(M)与配位剂(L)可以发生下面的配位反应:M+L==ML [ ] [ ][ ] ML K M L 稳 =

安前他唇电子藏素 新最大香化零化工号院 M+L=ML k品 ML+L=ML2 [ML] Ke.-[MLILI MLn+L=MLn [ML,] Ka.=M-l而 K稳·K2.Ka 配合物的稳定性用其稳定常数K稳米表示。K稳越大,表示配合物的稳定性越高,配位反应进行得 就越完全。金属离子(M)与配位剂(L)还可以发生多级配位反应生成ML,是由M和L逐级配 位形成的。在配位平衡的计算中,为了计算和表述上的方便,常使用紫积稳定常数,用符号B表示。 其定义为: 则,第一级累积稳定常数: Ak"tn A=KgK=M而 [ML] 第二级累积稳定常数 . [ML] 第n级累积稳定常数 B.=KeKe.=IMILF 最后一级累积稳定常数B。又称为总稳定常数。 §6.2EDTA与金属离子的配合物及其稳定性 一、EDTA的性质 乙二胺四乙酸(ethylene diamine tetraacetic acid),简称:EDTA或EDTA酸,用EDTA(H4Y)表示。 HOOCH,C CH2COOH N-CH2-CH2-N HOOCHC CH2COOH 第4页
分析化学电子教案 新疆大学化学化工学院 第 4 页 配合物的稳定性用其稳定常数 K 稳 来表示。K 稳越大,表示配合物的稳定性越高,配位反应进行得 就越完全。金属离子(M)与配位剂(L)还可以发生多级配位反应生成 MLn,是由 M 和 L 逐级配 位形成的。在配位平衡的计算中,为了计算和表述上的方便,常使用累积稳定常数,用符号β表示。 其定义为: 则,第一级累积稳定常数: 第二级累积稳定常数 . . . . . . 第 n 级累积稳定常数 最后一级累积稳定常数βn 又称为总稳定常数。 §6.2 EDTA 与金属离子的配合物及其稳定性 一、EDTA 的性质 乙二胺四乙酸( ethylene diamine tetraacetic acid ) ,简称: EDTA 或 EDTA 酸,用 EDTA ( H4Y) 表示。 [ ] [ ][ ] ML K M L = 稳1 2 [ ] [ ][ ] ML K ML L = 稳2 1 [ ] [ ][ ] n n ML K ML L − = 稳n K K K • 稳1 稳2 稳n [ ] [ ][ ] ML K M L = = 1 1 稳 [ ] [ ][ ] ML K K M L = • = 1 2 2 2 稳 稳 2 [ ] [ ][ ] ML K K K M L = • = 1 2 n n n 稳 稳 稳 n M+L=ML ML+L=ML2 MLn-1+L=MLn

安前化厚电子最素 新最大零化零化工号院 1、一般特性 EDTA为一个多元酸,可用H4Y表示,当H4Y溶于水时,若溶液的酸度很高,H4Y可以再接受两个 质子(H),形成H6Y2+,因此,EDTA相当于六元酸,存在六级离解平衡: H6Y2*≥Ht+H5Y K=HY1=10 HY"1 4。 HsY*≥Ht+HY K.=H1-10o [H,Y*] K。=1020 K。,=10267 K,=10616 K.=HY1-103 HY3H+Y4 [HY3] 2.EDTA在水中的溶解度: 在22C时,EDTA在水中的溶解度很小:0.02g100mL水,也难溶于酸和一般的有机溶剂,但易 溶于氨溶液和苛性碱溶液中,生成相应的盐。所以在应用EDTA时,常用EDTA二钠盐 Na2H2Y2H2O,一般将其二钠盐也简称为EDTA或EDTA二钠盐,EDTA二钠盐在水中的溶解度比 较大:在22℃时,EDTA二钠盐在水中的溶解度为11.1g/100mL水,饱和水溶液的浓度约为0.3 mol-L-I,pH约为4.5。 3、EDTA在水溶液中存在形式 当HY溶解于酸性很强的溶液时,它的两个羟基可再接受H而形成H。Y2,这样质子化的EDTA 就相当于六元酸,有6级离解平衡。在任何水溶液当它们的分布分数与溶液的pH有关。P1%,图5-) 可见,只有在pH>12时,才主要以Y形式存在,在EDTA与金属离子形成的络合物中,以Y与 金属离子形成的络合物最为稳定。因此溶液的酸中,已质子化了的EDTA总是以H6Y2、H6Y、HY、 HY、H2Y2、HY、Y4等7种型体存在。 r器 -Ht」 * -H+ +后r后* 第5页
分析化学电子教案 新疆大学化学化工学院 第 5 页 1、一般特性 EDTA 为一个多元酸,可用 H4Y 表示,当 H4Y 溶于水时,若溶液的酸度很高,H4Y 可以再接受两个 质子(H+),形成 H6Y2+,因此,EDTA 相当于六元酸,存在六级离解平衡: ······ 2. EDTA 在水中的溶解度: 在 22℃时, EDTA 在水中的溶解度很小:0.02 g /100 mL 水,也难溶于酸和一般的有机溶剂,但易 溶于氨溶液和苛性碱溶液中,生成相应的盐。所以在应用 EDTA 时,常用 EDTA 二钠盐 Na2H2Y·2H2O ,一般将其二钠盐也简称为 EDTA 或 EDTA 二钠盐,EDTA 二钠盐在水中的溶解度比 较大:在 22℃时, EDTA 二钠盐在水中的溶解度为 11.1 g / 100 mL 水,饱和水溶液的浓度约为 0.3 mol·L-1,pH 约为 4.5。 3、EDTA 在水溶液中存在形式 当 H4Y 溶解于酸性很强的溶液时,它的两个羟基可再接受 H +而形成 H6Y2-,这样质子化的 EDTA 就相当于六元酸,有 6 级离解平衡。在任何水溶液当它们的分布分数与溶液的 pH 有关。(P106,图 5-1) 可见,只有在 pH>12 时,才主要以 Y4-形式存在,在 EDTA 与金属离子形成的络合物中,以 Y4-与 金属离子形成的络合物最为稳定。因此溶液的酸中,已质子化了的 EDTA 总是以 H6Y2+、H5Y+、H4Y、 H3Y-、H2Y2-、HY3-、Y4- 等 7 种型体存在。 H6Y2+ H+ + H5Y+ 5 0.9 2 6 [ ][ ] 10 [ ] a H H Y K H Y + + − + = = 1 4 1.6 5 [ ][ ] 10 [ ] a H H Y K H Y + − + = = 2 2.67 10 K a − = 4 6.16 10 K a − = 5 HY3- H+ + Y4- 4 10.26 3 [ ][ ] 10 [ ] a H Y K HY + − − − = = 6 H5Y+ H+ + H4Y 2.0 10 K a − = 3

安前他零电子最素 新最大香化零化工号院 度便成为影响“金属一EDTA”络合物稳定性的一个重要因素。 二EDTA与金属高子的配合物 1、EDTA与金属离子形成配合物具有以下特点: (1)几乎与所有的金属离子络合 EDTA具有广泛的配位性能,几乎能与所有的金属离子形成整合物。这主要是因为EDTA分子中 含有配位能力很强的氨氮和羧氧: HOOCH2C CH2COOH N-CH2-CHz-N HOOCH2C CH,COOH (2)络合比一般为1:1 EDTA与金属离子形成的络合物的配位比简单,一般情况下,多为1:I。EDTA分子中含有两个 氨基和四个羧基,也就是说它具有六个配位原子,大多数金属离子的配位数不超过6,因此,无认金 属离子的价数是多少,一般情祝下均按1:1配位:只有少数变价金属离子与EDTA配位时不是形成 1:1络合物。如Mo与EDTA形成2:1络合物,在中性或碱性溶液中Zr”与DTA亦形成2:1络合物: (3)可形成酸式或碱式络合物 溶液的酸度或碱度高时,一些金属高子和EDTA还可形成酸式络合物MW或碱式络合物MOH。但 酸式或碱式络合物大多数不稳定,不影响金属离子与DTA之间1:1的计量关系,故一般可忽略不计: (4)络合物易溶于水 DTA与金属离子形成的络合物大多带电荷,因此能够溶于水中,一般配位反应迅速,使滴定能 在水溶液中进行: (5)形成颜色加深的络合物 EDTA与无色金属离子配位时,则形成无色的整合物,与有色金属离子配位时,一般则形成颜色 更深的整合物,如: N:Y2- CuY CrY- FeY 兰色 深兰 紫红 紫红深紫 黄 在滴定这些金属离子时,若其浓度过大,则整合物的颜色很深,这对使用指示剂确定终点将带 来一定的困难。 由于EDTA的上述特点,使EDTA成为配位滴定中最常用的滴定剂,也广泛用作金属离子的掩蔽 剂。2、EDTA与金属离子配合物的稳定常数 金属离子(M)与EDTA(Y)的配位反应,略去电荷,可简写成: 其配合物的稳定常数用Y表示: M+Y MY [M形16页 [MIY]
分析化学电子教案 新疆大学化学化工学院 第 6 页 度便成为影响“金属-EDTA”络合物稳定性的一个重要因素。 二 EDTA 与金属离子的配合物 1、EDTA 与金属离子形成配合物具有以下特点: (1)几乎与所有的金属离子络合 EDTA 具有广泛的配位性能,几乎能与所有的金属离子形成螯合物。这主要是因为 EDTA 分子中 含有配位能力很强的氨氮和羧氧; (2)络合比一般为 1∶1 EDTA 与金属离子形成的络合物的配位比简单,一般情况下,多为 1∶1。EDTA 分子中含有两个 氨基和四个羧基,也就是说它具有六个配位原子,大多数金属离子的配位数不超过 6,因此,无认金 属离子的价数是多少,一般情况下均按 1∶1 配位;只有少数变价金属离子与 EDTA 配位时不是形成 1∶1 络合物。如 MoV 与 EDTA 形成 2∶1 络合物,在中性或碱性溶液中 ZrIV 与 EDTA 亦形成 2∶1 络合物; (3)可形成酸式或碱式络合物 溶液的酸度或碱度高时,一些金属离子和 EDTA 还可形成酸式络合物 MHY 或碱式络合物 MOHY。但 酸式或碱式络合物大多数不稳定,不影响金属离子与 EDTA 之间 1∶1 的计量关系,故一般可忽略不计; (4)络合物易溶于水 EDTA 与金属离子形成的络合物大多带电荷,因此能够溶于水中,一般配位反应迅速,使滴定能 在水溶液中进行; (5)形成颜色加深的络合物 EDTA 与无色金属离子配位时,则形成无色的螯合物,与有色金属离子配位时,一般则形成颜色 更深的螯合物,如: N:Y2- CuY2- CoY2- MnY2- CrY- FeY- 兰色 深兰 紫红 紫红 深紫 黄 在滴定这些金属离子时,若其浓度过大,则螯合物的颜色很深,这对使用指示剂确定终点将带 来一定的困难。 由于 EDTA 的上述特点,使 EDTA 成为配位滴定中最常用的滴定剂,也广泛用作金属离子的掩蔽 剂。2、EDTA 与金属离子配合物的稳定常数 金属离子(M)与 EDTA(Y)的配位反应,略去电荷,可简写成: 其配合物的稳定常数用 KMY 表示: M + Y MY [ ] [ ][ ] MY MY K M Y =
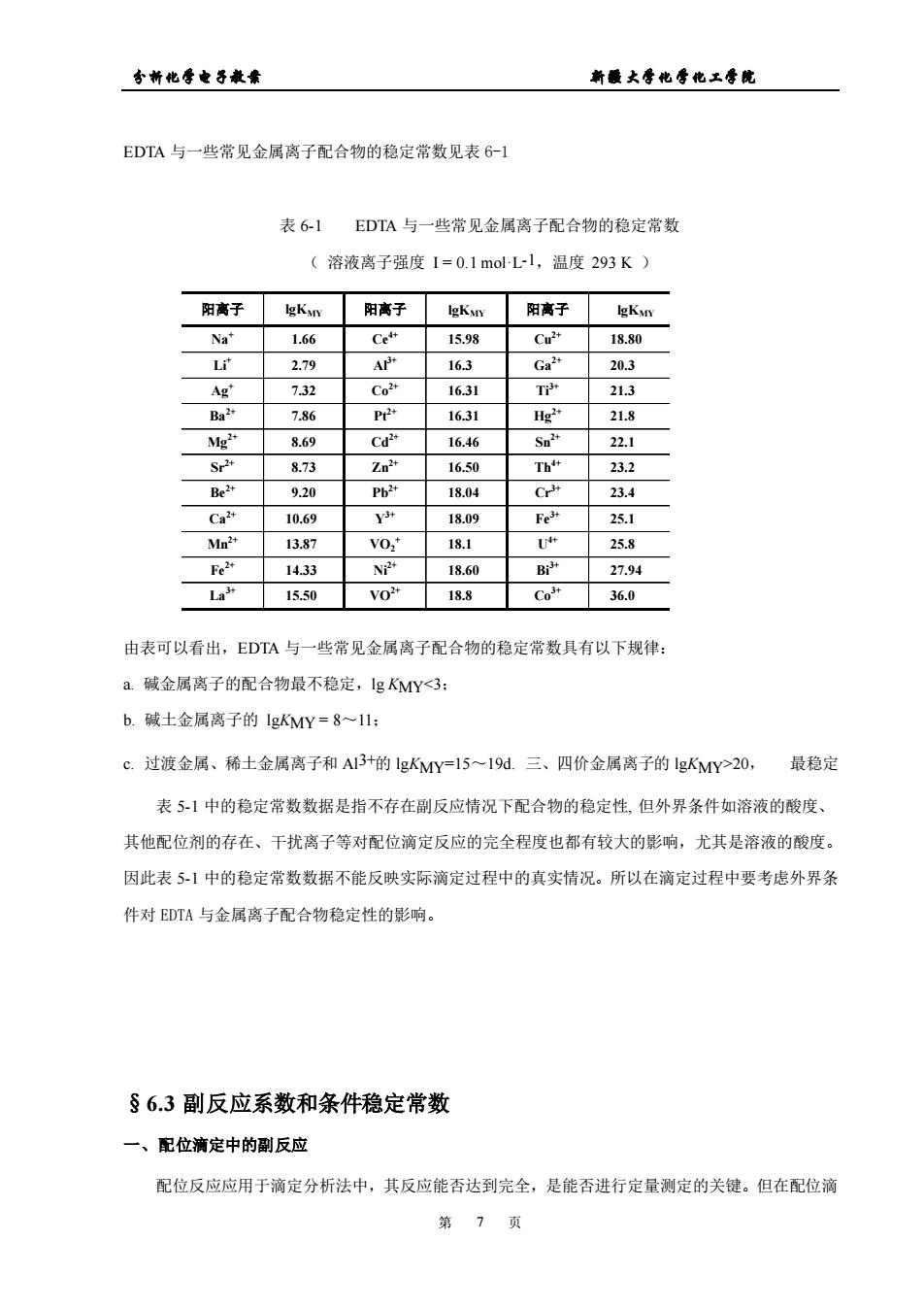
台新化季各最素 新最大零化季他工号院 EDTA与一些常见金属离子配合物的稳定常数见表6-1 表6】EDTA与一些常见金属离子配合物的稳定常数 (溶液离子强度1=0.1molL-l,温度293K) 阳离子 lKvry 阳离子 lgKyy 阳离子eKN 1.66 1+ 15.9 18.80 L产 2.79 Ar 16.3 Ga 20.3 7.32 Co 1631 T 21.3 7.86 163 218 Mg 8.69 Cd 16.46 22.1 Sr2* 8.73 Zo 1650 Th 23.2 9.20 18.04 C+ 23.4 Ca 10.6 18.09 25.1 13.87 VO. 18.1 25.8 Fe2+ 14.33 N24 18.60 Bi 27.94 1550 188 Co" 36.0 由表可以看出,EDTA与一些常见金属离子配合物的稳定常数具有以下规律: a碱金属离子的配合物最不稳定,lgY20,最稳定 表51中的稳定常数数据是指不存在副反应情况下配合物的稳定性,但外界条件如溶液的酸度、 其他配位剂的存在、干扰离子等对配位滴定反应的完全程度也都有较大的影响,尤其是溶液的酸度。 因此表51中的稳定常数数据不能反映实际滴定过程中的真实情况。所以在滴定过程中要考虑外界条 件对EDTA与金属离子配合物稳定性的影响。 §6.3副反应系数和条件稳定常数 一、配位滴定中的副反应 配位反应应用于滴定分析法中,其反应能否达到完全,是能否进行定量测定的关键。但在配位滴 第7页
分析化学电子教案 新疆大学化学化工学院 第 7 页 EDTA 与一些常见金属离子配合物的稳定常数见表 6-1 表 6-1 EDTA 与一些常见金属离子配合物的稳定常数 ( 溶液离子强度 I = 0.1 mol·L-1,温度 293 K ) 由表可以看出,EDTA 与一些常见金属离子配合物的稳定常数具有以下规律: a. 碱金属离子的配合物最不稳定,lg KMY20, 最稳定 表 5-1 中的稳定常数数据是指不存在副反应情况下配合物的稳定性, 但外界条件如溶液的酸度、 其他配位剂的存在、干扰离子等对配位滴定反应的完全程度也都有较大的影响,尤其是溶液的酸度。 因此表 5-1 中的稳定常数数据不能反映实际滴定过程中的真实情况。所以在滴定过程中要考虑外界条 件对 EDTA 与金属离子配合物稳定性的影响。 §6.3 副反应系数和条件稳定常数 一、配位滴定中的副反应 配位反应应用于滴定分析法中,其反应能否达到完全,是能否进行定量测定的关键。但在配位滴 阳离子 lgKMY 阳离子 lgKMY 阳离子 lgKMY Na+ 1.66 Ce4+ 15.98 Cu2+ 18.80 Li+ 2.79 Al3+ 16.3 Ga2+ 20.3 Ag+ 7.32 Co2+ 16.31 Ti3+ 21.3 Ba2+ 7.86 Pt2+ 16.31 Hg2+ 21.8 Mg2+ 8.69 Cd2+ 16.46 Sn2+ 22.1 Sr2+ 8.73 Zn2+ 16.50 Th4+ 23.2 Be2+ 9.20 Pb2+ 18.04 Cr3+ 23.4 Ca2+ 10.69 Y 3+ 18.09 Fe3+ 25.1 Mn2+ 13.87 VO2 + 18.1 U 4+ 25.8 Fe2+ 14.33 Ni2+ 18.60 Bi3+ 27.94 La3+ 15.50 VO2+ 18.8 Co3+ 36.0

女前化零电子最素 新最大香化零化工季院 定反应中所涉及的化学反应是比较复杂的,除了被测金属离子M与配位剂(Y)之间的主反应外,溶液 的酸度、缓冲剂、其它辅助配位剂及共存离子等,都可能与M或Y发生反应,这必然使M与Y的主 反应受到影响,从而使配位反应的完全程度发生变化。 除主反应以外其它的反应我们统称为副反应,其平衡关系如下: Mn+ + r4- MY 主反应 N+ OH 副反应 M(OH) ML Hy3- NL MHY MOHY H(OH) HY2* NL 羟基配位效应辅助配位效应酸效应干扰离学效应混合配位效应 由上图可知,反应物M、Y发生副反应时,使平衡向左移动,不利于主反应的进行,使主反应 的完全程度降低:反应产物(MY)发生副反应时,形成酸式(MHY)配合物或碱式MOHY)配合物,使 平衡向右移动,有利于主反应的进行,但由于酸式MHY)配合物或碱式(MOHY)配合物不稳定, 般不考虑。M、Y及MY的各种副反应进行的程度,可由其相应的副反应系数表示出来。下面者重讨 论滴定剂(Y)和金属离子M)的副反应。 二、EDTA的酸效应及酸效应系数am 定义:由于存在使配位体(Y)参加主反应能力降低的现象称为酸效应。酸效应的大小可用酸效 应系数ay曲表示 aY田=IYMYI 其中:[Y一EDTA各种存在形式的总浓度: [Y一能参加配位反应的有效存在形式Y4的平衡浓度。 a¥出越大,表示其副反应越严重,若Y没有副反应,即未配位的EDTA全部以Y形式存在 则c=, 酸效应系数av画的计算公式为: [】[门+[H3]+H22]+[H-]+[H]+Hs*]+[H62*1 dy(H)= [Y] [a[H]2[3 [a 不同条件下的酸效应的大小见下表 不同pH时的gaY( 第8页
分析化学电子教案 新疆大学化学化工学院 第 8 页 定反应中所涉及的化学反应是比较复杂的,除了被测金属离子(M)与配位剂(Y)之间的主反应外,溶液 的酸度、缓冲剂、其它辅助配位剂及共存离子等,都可能与 M 或 Y 发生反应,这必然使 M 与 Y 的主 反应受到影响,从而使配位反应的完全程度发生变化。 除主反应以外其它的反应我们统称为副反应,其平衡关系如下: 由上图可知,反应物(M、Y)发生副反应时,使平衡向左移动,不利于主反应的进行,使主反应 的完全程度降低;反应产物(MY)发生副反应时,形成酸式(MHY) 配合物或碱式(MOHY) 配合物,使 平衡向右移动,有利于主反应的进行,但由于酸式(MHY) 配合物或碱式(MOHY) 配合物不稳定,一 般不考虑。M、Y 及 MY 的各种副反应进行的程度,可由其相应的副反应系数表示出来。下面着重讨 论滴定剂(Y)和金属离子(M)的副反应。 二、EDTA 的酸效应及酸效应系数αY(H) 定义:由于 H+ 存在使配位体(Y)参加主反应能力降低的现象称为酸效应。酸效应的大小可用酸效 应系数αY(H) 表示 αY(H) = [Y']/[Y] 其中:[Y']——EDTA 各种存在形式的总浓度; [Y]——能参加配位反应的有效存在形式 Y4-的平衡浓度。 αY(H) 越大,表示其副反应越严重,若 Y 没有副反应,即未配位的 EDTA 全部以 Y 形式存在, 则αY(H) =1, 酸效应系数αY(H) 的计算公式为: 不同条件下的酸效应的大小见下表 不同 pH 时的 lgαY(H)

台新化季各最兼 新最大零化季化工季院 PH lga¥ PH lg ayon 00 23.64 38 8.85 74 2.88 0.4 21.32 4.0 8.4 7.8 2.47 0.8 1908 4.4 7.64 8.0 2.27 10 1801 48 684 84 187 16.02 5.0 645 1.48 1.8 14.2 54 5.69 90 1,28 2.0 13.51 58 4.98 95 0.83 24 1219 60 4.65 10.0 045 28 1.09 64 4.06 11.0 007 30 10.60 68 3.55 12.0 001 34 9.70 7.0 3.32 13.0 0.00 由表可见: 1.酸效应系数a画随溶液酸度增加而增大,随溶液pH增大而减小 2.口ym的数值大,表示酸效应引起的副反应严重 3.通常a¥m>1,即:[Y']>[Y)。 当avm=1时,表示总浓度[Y]=[Y]: 4,酸效应系数=1/分布系数。即:am=1/6EDTA与金属离子形成配合物的稳定常数由于 酸效应的影响,不能反映不同p条件下的实际情况,因而需要引入条件稳定常数。 三、金属离子的配位效应及其副反应系数aM 金属离子常发生两类副反应:金属离子与辅助配位剂的作用:金属离子的水解。 1、金属离子的配位效应与配位效应系数 定义:溶液中存在的另一种辅助配位剂L与M形成配合物,降低了金属离子参加主反应的能力的现 象称为金属离子的配位效应,其大小用金属离子的配位效应系数a山表示。 M [M')[M] 其中:M一金属离子总浓度: M一游离金属离子浓度。 可见,a山越大,游离金属离子浓度越小,表示金属离子被辅助配位剂L配合得越完全,即副 反应越严重,如果M没有副反应,则aM山=1 如果M与L发生逐级配位,则形成ML,ML,MLa,.,ML逐级配合物,则: 第9面
分析化学电子教案 新疆大学化学化工学院 第 9 页 由表可见: 1. 酸效应系数αY(H) 随溶液酸度增加而增大,随溶液 pH 增大而减小 2. αY(H) 的数值大,表示酸效应引起的副反应严重 3. 通常αY(H) >1, 即: [Y' ] > [Y]。 当αY(H) = 1 时,表示总浓度[Y' ] = [Y]; 4. 酸效应系数 = 1 / 分布系数。即:αY(H) = 1 /δ EDTA 与金属离子形成配合物的稳定常数由于 酸效应的影响,不能反映不同 pH 条件下的实际情况,因而需要引入条件稳定常数。 三、金属离子的配位效应及其副反应系数αM 金属离子常发生两类副反应:金属离子与辅助配位剂的作用;金属离子的水解。 1、 金属离子的配位效应与配位效应系数 定义:溶液中存在的另一种辅助配位剂 L 与 M 形成配合物,降低了金属离子参加主反应的能力的现 象称为金属离子的配位效应,其大小用金属离子的配位效应系数αM(L) 表示。 αM(L) = [Mˊ]/ [M] 其中:[Mˊ]——金属离子总浓度; [M]——游离金属离子浓度。 可见,αM(L) 越大,游离金属离子浓度越小,表示金属离子被辅助配位剂 L 配合得越完全,即副 反应越严重,如果 M 没有副反应,则αM(L) =1 如果 M 与 L 发生逐级配位,则形成 ML,ML1,ML2,.,MLn 逐级配合物,则: pH Y(H) lg pH Y(H) lg pH Y(H) lg 0.0 23.64 3.8 8.85 7.4 2.88 0.4 21.32 4.0 8.44 7.8 2.47 0.8 19.08 4.4 7.64 8.0 2.27 1.0 18.01 4.8 6.84 8.4 1.87 1.4 16.02 5.0 6.45 8.8 1.48 1.8 14.27 5.4 5.69 9.0 1.28 2.0 13.51 5.8 4.98 9.5 0.83 2.4 12.19 6.0 4.65 10.0 0.45 2.8 11.09 6.4 4.06 11.0 0.07 3.0 10.60 6.8 3.55 12.0 0.01 3.4 9.70 7.0 3.32 13.0 0.00

安前化学电子最常 新最大香化零化工号院 cnn -[M+[M(L]+.+[M(L).] IMI =1+B[]+B,[L叮+.+B[L 式中1Bn表示MLn各级累积稳定常数 2、羟基配位效应 羟基配位效应是由金属离子的水解造成的,用副反应系数a表示 @)M] [M =【M]+[M(OH]+.+[MOH).J =1+B[OH-1+B.[OH-12+.+B.[OH-" 式中1.n表示MOHn各级累积稳定常数 3、金属离子的总副反应系数a1 金属离子的这两种副反应都会使金属离子的游离浓度下降,使金属离子参与主反应的能力降低, 我们称这两种副反应为金属离子的配位效应(总副反应系数),用a,表示。 岛 [M+IM(+M(OH)+M(+M(D)] IM) =amom+a-1 式中:M们:金属离子各种存在形式的总浓度 M:金属离子的游离浓度 四、条件稳定常数 在溶液中,金属离子M与配位剂EDTA反应生成MY。如果没有副反应发生,当达到平衡时, KY是衡量此配位反应进行程度的主要标志。如果有副反应发生,将受到M、Y及MY的副反应的影 若EDTA存在酸效应,在配位反应中要将酸效应的影响考虑进去,其平衡反应为: 第10页
分析化学电子教案 新疆大学化学化工学院 第 10 页 式中 β1.βn 表示 MLn 各级累积稳定常数 2、 羟基配位效应 羟基配位效应是由金属离子的水解造成的,用副反应系数 αM(OH) 表示 式中 β1.βn 表示 M(OH)n 各级累积稳定常数 3、金属离子的总副反应系数αM 金属离子的这两种副反应都会使金属离子的游离浓度下降,使金属离子参与主反应的能力降低, 我们称这两种副反应为金属离子的配位效应(总副反应系数),用 αM 表示。 式中:[M']:金属离子各种存在形式的总浓度 [M]:金属离子的游离浓度 四、条件稳定常数 在溶液中,金属离子 M 与配位剂 EDTA 反应生成 MY。如果没有副反应发生,当达到平衡时, KMY 是衡量此配位反应进行程度的主要标志。如果有副反应发生,将受到 M、Y 及 MY 的副反应的影 响。 若 EDTA 存在酸效应,在配位反应中要将酸效应的影响考虑进去,其平衡反应为: ( ) 2 1 2 [ ] [ ] [ ] [ ( )] [ ( ) ] [ ] 1 [ ] [ ] [ ] M OH n n n M M M M OH M OH M OH OH OH − − − = + + + = = + + + + ( ) ( ) [ ] [ ( )] [ ( ) ] [ ( )] [ ( [ ] [ ] 1 ) ] [ ] M M OH M L M M OH M OH M L M L n n M M M + + + + + + = + = − = ( ) 2 1 2 [ ] [ ] [ ] [ ( )] [ ( ) ] [ ] 1 [ ] [ ] [ ] M L n n n M M M M L M L M L L L = + + + = = + + + +