
第三章 酸碱反应 ק3.1酸碱质子理论 ק3.2 水溶液的质子转移年衡及 有吴计算 §3.3缓冲喀液 回
第三章 酸碱反应 § 3.3 缓冲溶液 § 3.2 水溶液的质子转移平衡及 有关计算 § 3.1 酸碱质子理论

本章重点 酸碱质子理论,共轭酸碱对 离解度和离解常数 水溶液中PH值的计算(一/二元弱酸,一元 弱碱) 无机化学电子教菜 缓冲溶液的计算及配置
本章重点 • 酸碱质子理论,共轭酸碱对 • 离解度和离解常数 • 水溶液中PH值的计算(一/二元弱酸,一元 弱碱) • 缓冲溶液的计算及配置
§3.1酸碱质子理论 历史回顾 3.1.1 酸碱的定义 3.1.2 酸碱反应的实质 3.1.3 酸碱反应的类型 3.1.4酸碱的相对强弱 @
§ 3.1 酸碱质子理论 3.1.2 酸碱反应的实质 3.1.1 酸碱的定义 历史回顾 3.1.3 酸碱反应的类型 3.1.4 酸碱的相对强弱

历史回顾 以Arrhenius电离理论为基础的酸碱学说在 化学发展过程中发挥了巨大的作用。但在 非水体系理论解释方面无能为力。 1923年丹麦哥本哈根大学Bronsted和英国 剑桥大学LOwy分别提出了酸碱质子理论, 无机化学电子救 大大扩展了酸碱的概念。 1923年,美国化学家Lewis提出了酸碱电子 理论
• 以Arrhenius电离理论为基础的酸碱学说在 化学发展过程中发挥了巨大的作用。但在 非水体系理论解释方面无能为力。 • 1923年丹麦哥本哈根大学Bronsted和英国 剑桥大学Lowry分别提出了酸碱质子理论, 大大扩展了酸碱的概念。 • 1923年,美国化学家Lewis提出了酸碱电子 理论。 历史回顾

3.1.1 酸碱的定义 酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 无机化学电子数 或离子。 (质子的接受体)
酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 或离子。 (质子的接受体) 3.1.1 酸碱的定义
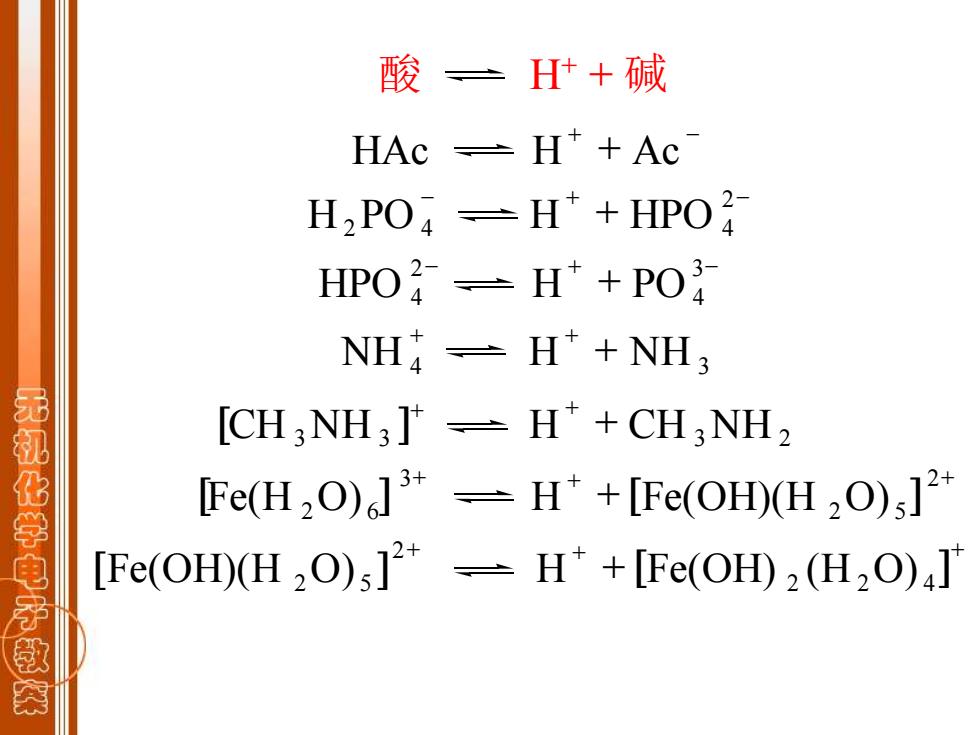
酸一 H+碱 HAc -H*+Ac H2 PO:-H*+HPO HPO孑=H*+PO NH -H*NH; [CH:NH3]=H*+CH:NH2 无机化学电子 [Fe(H2O)]3-H*+[Fe(OH)(H2O)]2* [Fe(OH)(H2O)3]2*-H*+[Fe(OH)2(H2O)J 闲
酸 H+ + 碱 + - HAc H + Ac - + - + 2 H2PO 4 H HPO 4 - + - + 3 4 2 HPO 4 H PO + + + NH 4 H NH 3 [ ] + + + CH 3NH 3 H CH 3NH 2 + + + + 2 2 5 3 [Fe(H 2O) 6 ] H [Fe(OH)(H O) ] + + + + 2 2 4 2 [Fe(OH)(H 2O) 5 ] H [Fe(OH) (H O) ]

共轭酸碱对 酸 H* 碱 例:HAc的共轭碱是Ac一, Ac一的共轭酸是HAc, HAc和Ac为一对共轭酸碱。 无机化学电子 两性物质: 既能给出质子,又能接受质子的物质。 如:HSO4,Fe(OHH,O), HCO,H,O,HS等
例:HAc的共轭碱是Ac- , Ac-的共轭酸是HAc, HAc和Ac-为一对共轭酸碱。 两性物质: 既能给出质子,又能接受质子的物质。 [ ] 等。 如: - - - + HCO ,H O,HS HSO , Fe(OH)(H O) , 3 2 2 4 2 5 酸 H+ + 碱 共轭酸碱对

3.1.2-3酸碱反应的实质和类型 ①酸碱解离反应是质子转移反应。 HF(aq)-H++F-(aq) H++H2O(1)-H3O(aq) HF(aq)+H,O(1)=H2O*(aq)+F(aq) 酸(1) 碱(2) 酸(2) 碱(1) 无机化学电子教 ②水是两性物质,它的自身解离反应 也是质子转移反应。 H H2O(I)+H2O(1)-H3O*(aq)+OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1)
① 酸碱解离反应是质子转移反应。 ② 水是两性物质,它的自身解离反应 也是质子转移反应。 H+ 酸(1) 碱(2) 酸(2) 碱(1) HF(aq) H+ + F-(aq) H+ + H2O(l) H3O+ (aq) HF(aq) + H2O(l) H3O+ (aq) + F-(aq) H2O(l)+H2O(l) H3O+ (aq) +OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1) 3.1.2-3 酸碱反应的实质和类型

③盐类水解反应也是离子酸碱的质子 转移反应。例如NaAc水解: H AC-+H,O±OH-+HAc 碱(1)酸(2) 碱(2) 酸(1) 无 NHCl水解: H 化学电产 NH:+H2O=H2O++NH; 酸(1) 碱(2) 酸(2) 碱(1)
③ 盐类水解反应也是离子酸碱的质子 转移反应。例如NaAc水解: 碱(1) 酸(2) 碱(2) 酸(1) H+ NH4Cl水解: 酸(1) 碱(2) 酸(2) 碱(1) H+ Ac-+H2O OH- + HAc + H2O H3O+ + NH3 + NH4

④非水溶液中的酸碱反应,也是离子 酸碱的质子转移反应。例如NH,CI的生成: H HCI NH,- NH 十 CI 酸(1) 碱2) 酸(2) 碱1) 液氨中的酸碱中和反应: 无机化学电子教茶 H NHCI+NaNH,2NH,NaCl
④ 非水溶液中的酸碱反应,也是离子 酸碱的质子转移反应。例如NH4Cl的生成: H+ 液氨中的酸碱中和反应: H+ + - HCl + N H N H + Cl 3 4 NH Cl NaNH 2NH NaCl 4 + 2 3 + 酸(1) 碱(2) 酸(2) 碱(1)