
第一篇 ”化学反应原理 第一章气体 §1.1理想气体伙态方程 ק1.2气依混合物 ×*§1.3气体分子动理论 ק1.4真实气体 返回
§1.1 理想气体状态方程 第一章 气 体 §1.4 真实气体 *§1.3 气体分子动理论 §1.2 气体混合物 第一篇 化学反应原理

§1.1理想气体状态方程 1.1.1理想气体状态方程 1.1.2理想气体状态方程的应用 回
1.1.1 理想气体状态方程 1.1.2 理想气体状态方程的应用 §1.1 理想气体状态方程

1.1.1 理想气体状态方程 气体的最基本特征: 具有可压缩性和扩散性。 人们将符合理想气体状态方程的气体,称 羞 为理想气体。 理想气体分子之间没有相互吸引和排斥, 化学电子 分子本身的体积相对于气体所占有体积完全 可以忽略。 寒
气体的最基本特征: 具有可压缩性和扩散性。 人们将符合理想气体状态方程的气体,称 为理想气体。 理想气体分子之间没有相互吸引和排斥, 分子本身的体积相对于气体所占有体积完全 可以忽略。 1.1.1 理想气体状态方程

理想气体状态方程: pV=nRT R-摩尔气体常量 在STP下,p=101.325kPa,T=273.15K n=1.0mol时,'m=22.414L=22.414×10-3m3 101325Pa×22.414×10-3m3 R- 无机化学电子款 nT 1.0mol×273.15K = 8.314Jmol-1.K-1 R=8.314 kPa-L-K-1.mol-1
pV = nRT R- 摩尔气体常量 在STP下,p =101.325kPa, T=273.15K n=1.0 mol时, Vm =22.414L=22.414×10-3m3 nT pV R = R=8.314 kPaLK-1 mol-1 理想气体状态方程: 1 1 8.314J mol K − − = 1.0mol 273.15K 101325Pa 22.414 10 m 3 3 = −

1.1.2理想气体状态方程的应用 1.计算,V,T,n中的任意物理量 pV=nRT 用于温度不太低,压力不太高的真实气体。 2.确定气体的摩尔质量 pV=nRT n M 无机化学电子教菜 pV= m RT M mRT M= M=M.g.mol- pV
1. 计算p,V,T,n中的任意物理量 2. 确定气体的摩尔质量 M m n = M = Mr gmol-1 1.1.2 理想气体状态方程的应用 pV mRT M = RT M m pV = pV = nRT 用于温度不太低,压力不太高的真实气体。 pV = nRT

3.确定气体的密度 mRT M= p=m/V py oRT M= p 无机化学电子数 pM p= RT lo
= RT pM pV mRT M = = m / V p RT M = 3. 确定气体的密度

§1.2气体混合物 1.2.1分压定律 *1.2.2分体积定律 返回
1.2.1 分压定律 §1.2 气体混合物 *1.2.2 分体积定律

1.2.1分压定律 组分气体: 理想气体混合物中每一种气体叫做组分 气体。 分压: 无机化学电子 组分气体B在相同温度下占有与混合气 体相同体积时所产生的压力,叫做组分气体 B的分压。 nBRT PB= V
组分气体: 理想气体混合物中每一种气体叫做组分 气体。 分压: 组分气体B在相同温度下占有与混合气 体相同体积时所产生的压力,叫做组分气体 B的分压。 V n RT p B B = 1.2.1 分压定律

分压定律: 混合气体的总压等于混合气体中各组分 气体分压之和。 p=p1+P2+. 或 p=∑PB 无机化学电子教茶
分压定律: 混合气体的总压等于混合气体中各组分 气体分压之和。 p = p1 + p2+ 或 p = pB
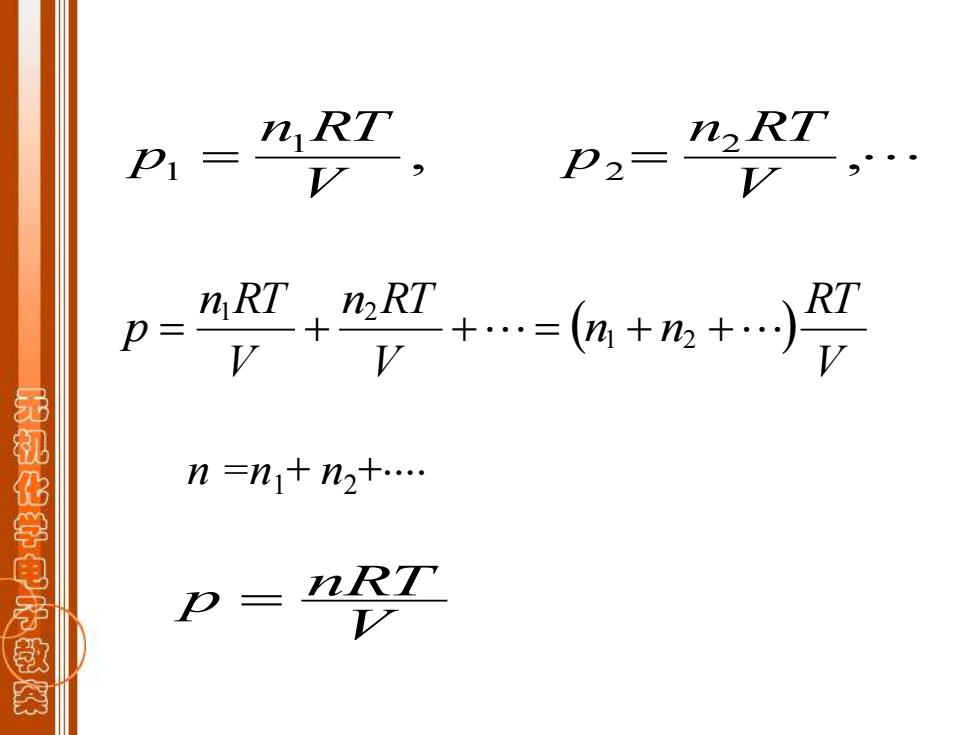
n RT n RT P1= V p2= D m+R+=a+%+-)7 无机化学电子款 n=n1+n2+. P=T
V p = nRT = , = , 2 2 1 1 V n RT p V n RT p ( ) V RT n n V n RT V n RT p = 1 + 2 += 1 + 2 + n =n1+ n2+