
第三章化学动力学基础 ק3.1化学友寇速车的橇念 人§3.2浓意对友应速车的影响 一速牵方程 ק33温意对友寇速车的影响 一Arrhenius方程 ק3.4反寇速牵理论和反寇机理简介 ק3.5催化剂和催化作用 回
§3.1 化学反应速率的概念 第三章 化学动力学基础 §3.5 催化剂和催化作用 §3.4 反应速率理论和反应机理简介 §3.3 温度对反应速率的影响 —Arrhenius方程 §3.2 浓度对反应速率的影响 —速率方程

§3.1化学友寇速乘的橇念 e 3.1.1平均速率和瞬时速率 3.1. 2定容反应速率 返回
§3.1 化学反应速率的概念 3.1.1 平均速率和瞬时速率 3.1.2 定容反应速率

3.1.1 平均速率和瞬时速率 1.平均速率 某一有限时间间隔内浓度的变化量。 例:N,0,(CC14)一2N02(CC4)+202(g 无机化学电子救 FN,0,)=-N,0)-cN20,) 1-h △cN,0s) △t
某一有限时间间隔内浓度的变化量。 3.1.1 平均速率和瞬时速率 2NO2 (CCl4 ) + O2 例: N (g) 2O5 (CCl4 ) 2 1 2 1 2 2 5 1 2 5 2 5 (N O ) (N O ) (N O ) t t c c r − − = − t c = − (N O ) 2 5 1. 平均速率
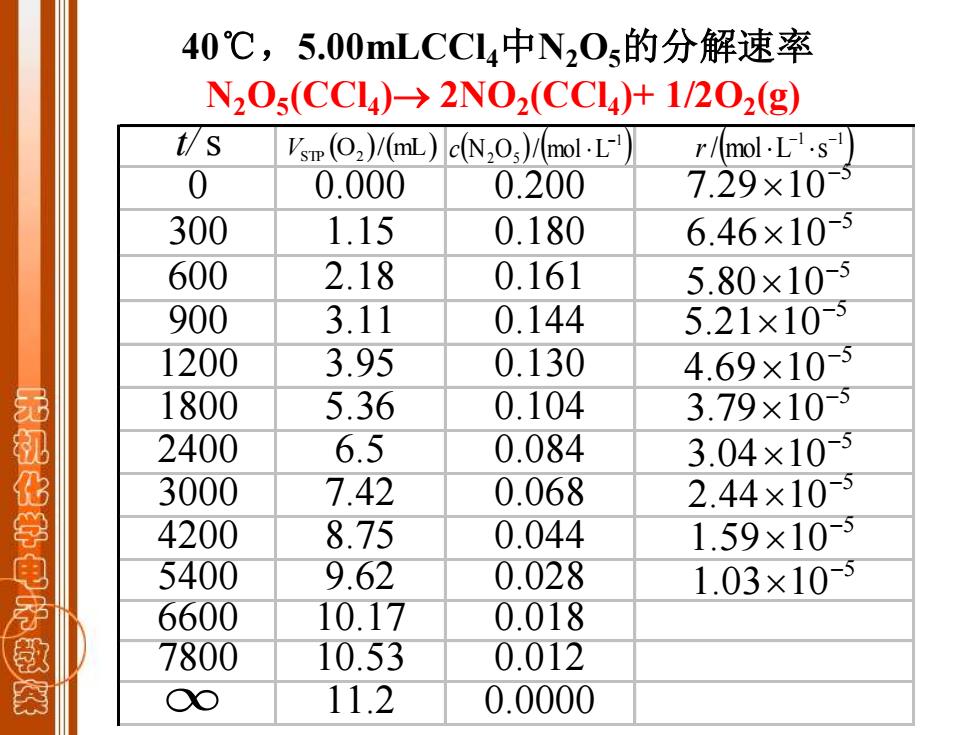
40℃,5.00 mLCCIa4中N20s的分解速率 N20s(CCL4)→2N02(CCL4)+1/202(g) t/s Vsmp(2)/(mL)c(N2O)/mol.L- r/mol.L.s 0 0.000 0.200 7.29×10-5 300 1.15 0.180 6.46×10-5 600 2.18 0.161 5.80×10-5 900 3.11 0.144 5.21×10-5 1200 3.95 0.130 4.69×10-5 1800 5.36 0.104 3.79×10-5 无机化学电子教 2400 6.5 0.084 3.04×105 3000 7.42 0.068 2.44×10-5 4200 8.75 0.044 1.59×10-5 5400 9.62 0.028 1.03×10-5 6600 10.17 0.018 7800 10.53 0.012 O 11.2 0.0000
t/s 0 0.000 0.200 300 1.15 0.180 600 2.18 0.161 900 3.11 0.144 1200 3.95 0.130 1800 5.36 0.104 2400 6.5 0.084 3000 7.42 0.068 4200 8.75 0.044 5400 9.62 0.028 6600 10.17 0.018 7800 10.53 0.012 11.2 0.0000 (O )/(mL) VSTP 2 ( ) ( ) 1 N2 O5 / mol L − c ( ) 1 1 / mol L s − − r 5 7.29 10− 5 6.46 10− 5 5.80 10− 5 5.21 10− 5 4.69 10− 5 3.79 10− 5 3.04 10− 5 1.03 10− 5 2.44 10− 5 1.59 10− 40℃,5.00mLCCl4中N2O5的分解速率 N2O5 (CCl4 )→ 2NO2 (CCl4 )+ 1/2O2 (g)
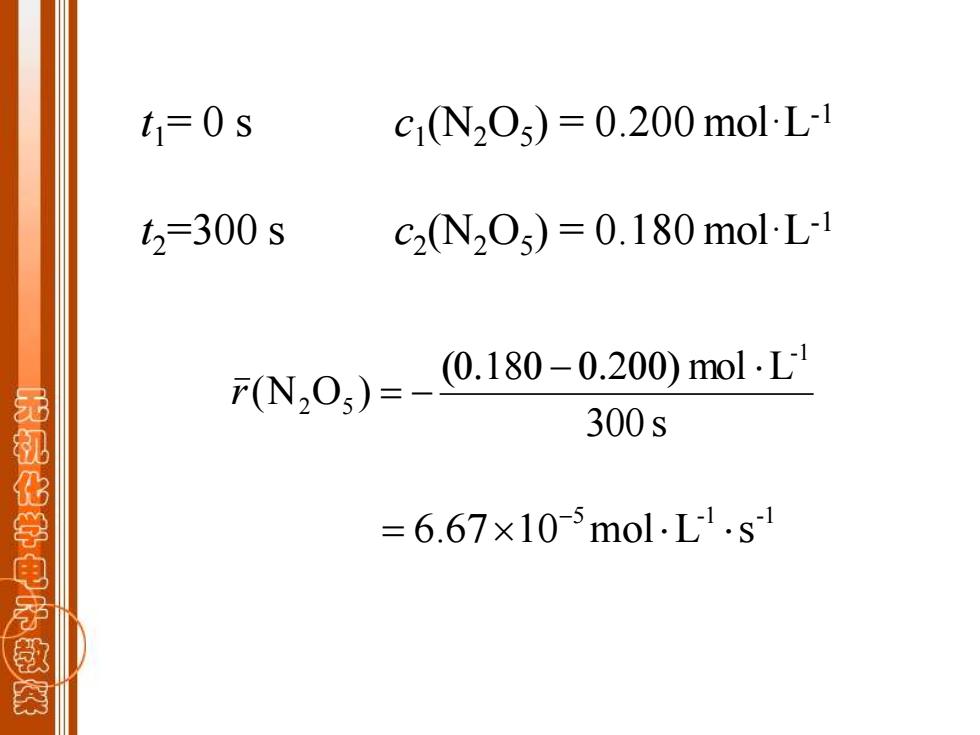
t1=0s c1N205)=0.200molL1 t2=300s C2(N2O)=0.180 mol-L-1 产(N20)= (0.180-0.200)mol.L 300s 无机化学电子救 =6.67×10-5mol.L1.s1
t1= 0 s c1 (N2O5 ) = 0.200 mol·L-1 t2=300 s c2 (N2O5 ) = 0.180 mol·L-1 300 s mol L (N O ) -1 2 5 ( − ) r = − 5 -1 -1 6.67 10 mol L s − =
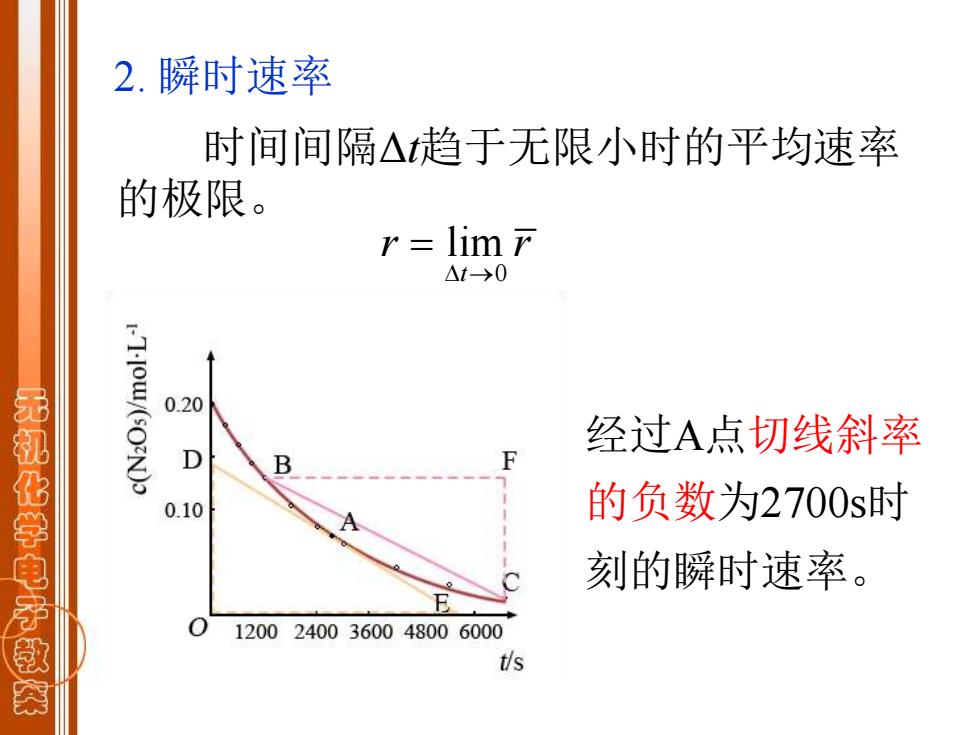
2.瞬时速率 时间间隔△趋于无限小时的平均速率 的极限。 r lim r △t→0 0.20 经过A点切线斜率 无机化学电子教茶 D B 0.10 的负数为2700s时 刻的瞬时速率。 12002400360048006000 t/s
时间间隔Δt趋于无限小时的平均速率 的极限。 0 lim t r r → = 2. 瞬时速率 经过A点切线斜率 的负数为2700s时 刻的瞬时速率

t1=0s c1N20)=0.144molL1 t2=5580s C2(N2Os)=0 mol-L-1 A点切线的斜率=(0-0.144)molL (55.8-0)×102s 无机化学电子救 =-2.58×105mol.L1.s1 r(N20s)=2.58×10-5mol-L.s
A点切线的斜率= 5 1 1 2.58 10 mol L s − − − = − (55.8 0) 10 s (0 0.144)mol L 2 -1 − − 5 -1 -1 2 5 r(N O ) 2.58 10 mol L s − = t1 = 0 s c1 (N2O5 )= 0.144 mol·L-1 t2 = 5580 s c2 (N2O5 )= 0 mol·L-1

3.1.2 定容反应速率 例:N2O,(CC)一2N02(CCL4)+2O2(g) △c(N205)_(0.180-0.200)mol.L △t 300s =-6.67×10-5mol.L1.s1 无机化学电子教突 Ac(N02)=1.33x10mol.L'.s △t △c(022=3.33×105mol-L4.s △t
3.1.2 定容反应速率 2NO2 (CCl4 ) + O2 例: N (g) 2O5 (CCl4 ) 2 1 -1 2 5 (N O ) mol L 300 s c t ( − ) = 5 -1 -1 6.67 10 mol L s − = − 2 4 -1 -1 1.33 10 mol L (NO ) s c t − = 2 5 -1 -1 3.33 10 mol L ) s c(O t − =

对于一般的化学反应: 0=∑yB B 定容条件下,定义:r= dg Vdt r一定容条件下的反应速率(molL1s1) 无机化学电子教 dns dt Vadt de 1 dcs Vdt V Vadt Vedt
r——定容条件下的反应速率(mol·L-1·s -1 ) d d r V t 定容条件下,定义: = 对于一般的化学反应: = B 0 B B B B B B d 1 d d d d d n c r V t V t t = = = B B d d d d n t t =

溶液中的化学反应: aA(aq)+bB(aq)-yY(aq)+zZ(aq) dcA=dcn dcy dcz adt bdt ydt zdt 无机化学电子教茶 对于定容的气相反应: r= 1 dpB VB dt D
z t c y t c b t c a t c r d d d d d d d d A B Y Z = − = − = = aA(aq) + bB(aq) yY(aq) + zZ(aq) t p r d 1 d B B = 对于定容的气相反应: 溶液中的化学反应: