
第六章蛋白质的三维结构 (a)
第六章 蛋白质的三维结构

X-Ray衍射确定蛋白质空间构象 (a)
X-Ray衍射确定蛋白质空间构象
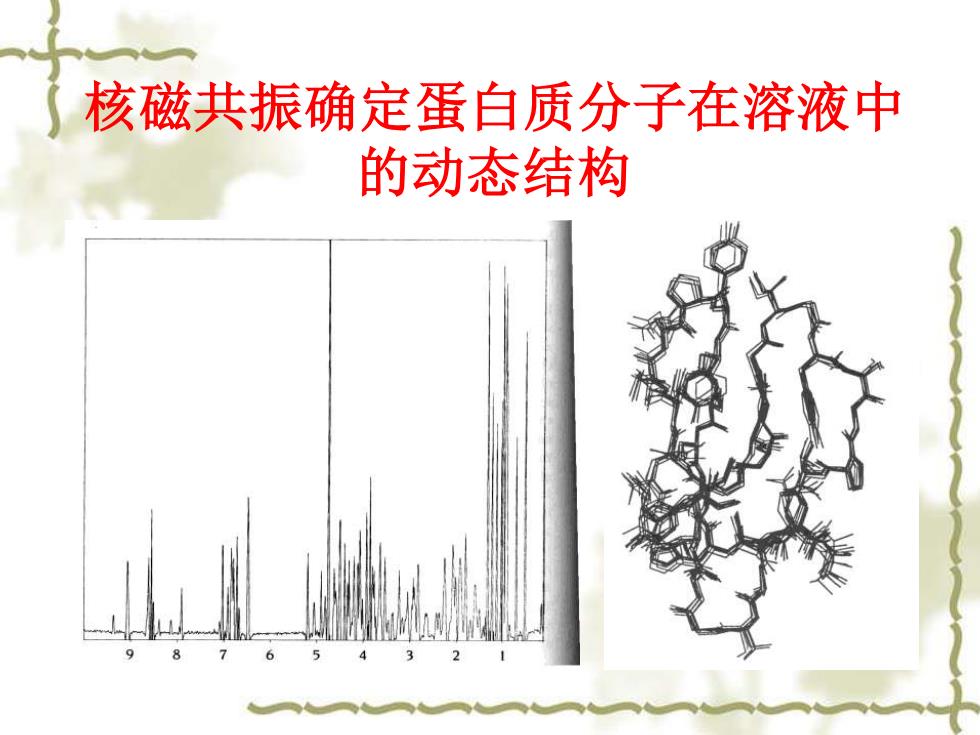
核磁共振确定蛋白质分子在溶液中 的动态结构
核磁共振确定蛋白质分子在溶液中 的动态结构

光谱学方法 ·紫外差示光谱 ÷荧光光谱 冬圆二色性
光谱学方法 ❖ 紫外差示光谱 ❖ 荧光光谱 ❖ 圆二色性

LinusCarl Pauling1901-1994 1926年 留学Sommerfeld实验室(1年7个月) 1928年 发现杂化轨道,创立量子化学 1930年 去Laurence Bragg?实验室学X-ray衍射 1936年 与Mirsky一起发表蛋白质变性的理论-氢键 1937年 开始研究a-helix的模型,发现5.4A的周期, 与Astburyl的Keratin蛋白测定得到的5.1A不符。 此后化了约10年的时间测定各种含肽键的小分 子的结构,得出肽键的6个原子在同一平面上 的结论。 1949年 人造丝X-ray数据发表,他看到了5.4A的周期 1950年 a-helix模型发表,次年发表B-sheeti模型 1954年 Nobel化学奖 1963年 Nobel和平奖 70年代 提倡Vitamin C治百病
LinusCarl Pauling1901-1994 1926年 留学Sommerfeld实验室(1年7个月) 1928年 发现杂化轨道, 创立量子化学 1930年 去Laurence Bragg实验室学X-ray衍射 1936年 与Mirsky一起发表蛋白质变性的理论-氢键 1937年 开始研究α-helix的模型,发现5.4A的周期, 与Astbury的Keratin蛋白测定得到的5.1A不符。 此后化了约10年的时间测定各种含肽键的小分 子的结构,得出肽键的6个原子在同一平面上 的结论。 1949年 人造丝X-ray数据发表,他看到了5.4A的周期 1950年 α-helix模型发表,次年发表β-sheet模型 1954年 Nobel化学奖 1963年 Nobel和平奖 70年代 提倡Vitamin C治百病

稳定蛋白质的三维结构作用力 维持蛋白质三维构象的作用力: 氢键、离子键、疏水键、范德华引力、 二硫键及配位键
一、稳定蛋白质的三维结构作用力 ❖ 维持蛋白质三维构象的作用力: 氢键、离子键、疏水键、范德华引力、 二硫键及配位键
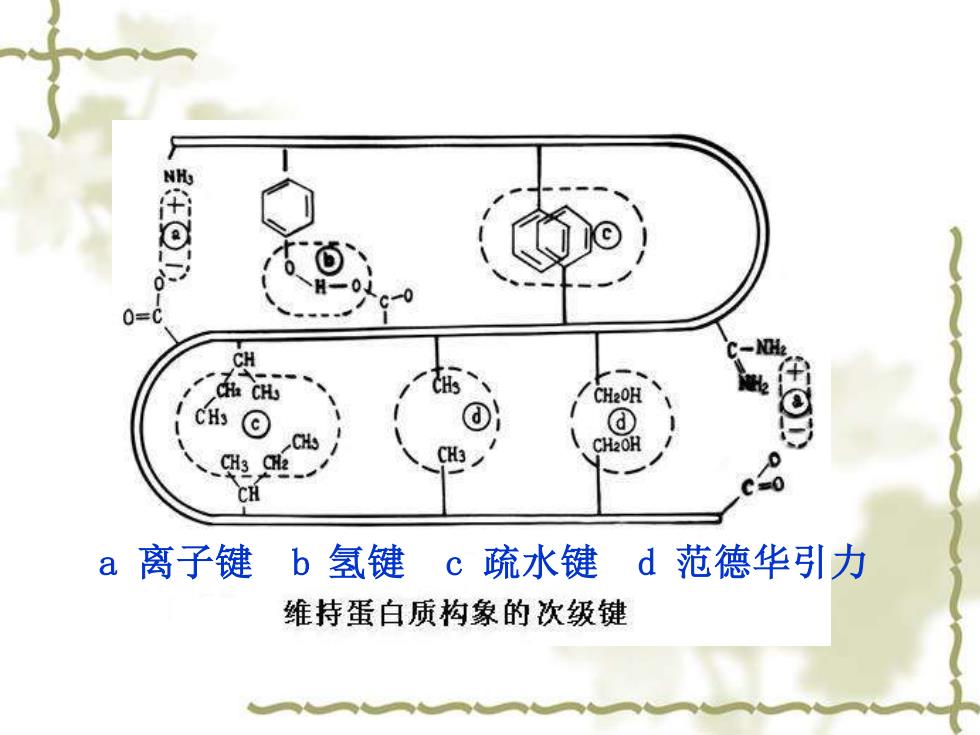
CH CH2O咀 a离子键b氢键 c疏水键d范德华引力 维持蛋白质构象的次级键
a 离子键 b 氢键 c 疏水键 d 范德华引力

氢键 X—H·.Y 范德华引力:定向效应、诱导效应和分 散效应(随原子间距离R6的倒数变化)。 疏水键 离子键 F-Q1Q2/eR2 二硫键 配位键
疏水键 二硫键 氢 键 X—H‥‥Y 离子键 F=Q1Q2/εR2 范德华引力:定向效应、诱导效应和分 散效应(随原子间距离R6的倒数变化)。 配位键
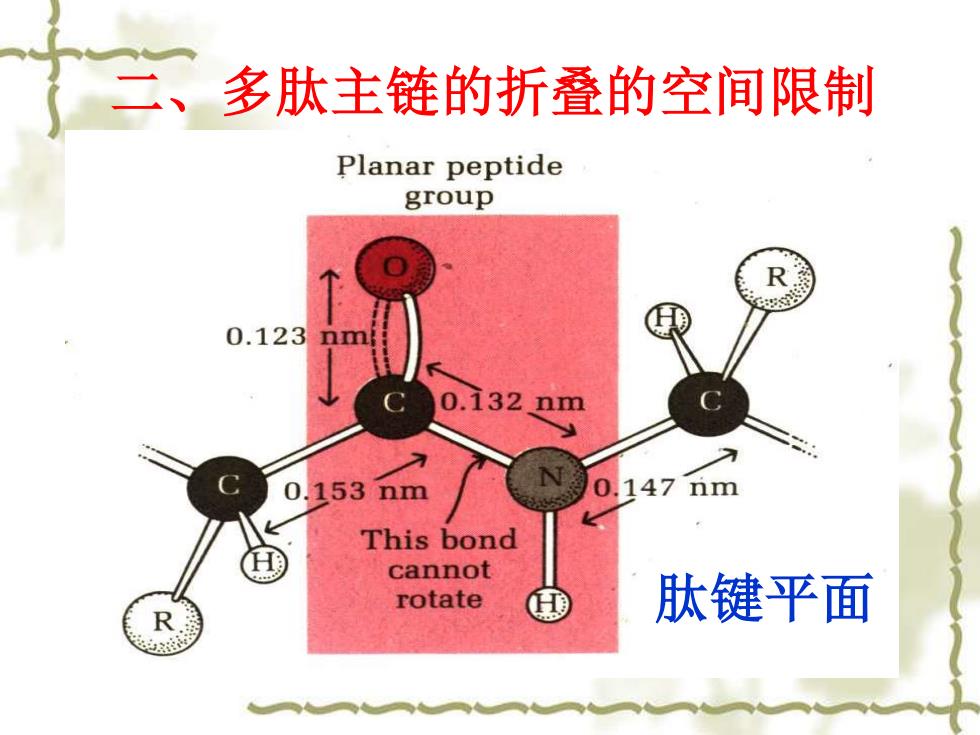
二、 多肽主链的折叠的空间限制 Planar peptide group 0.123 0.132 nm 0.153nm 0.147nm This bond cannot rotate 肽键平面 R
二、多肽主链的折叠的空间限制 肽键平面
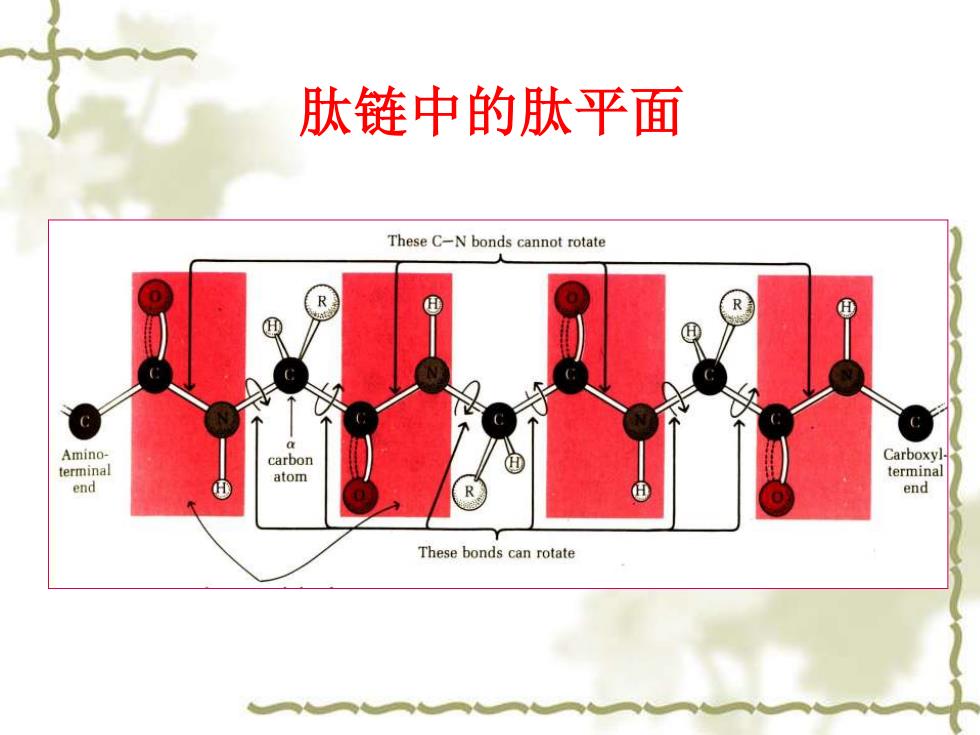
肽链中的肽平面 These C-N bonds cannot rotate R c Amino- carbon Carboxyl terminal atom terminal end end These bonds can rotate
肽链中的肽平面