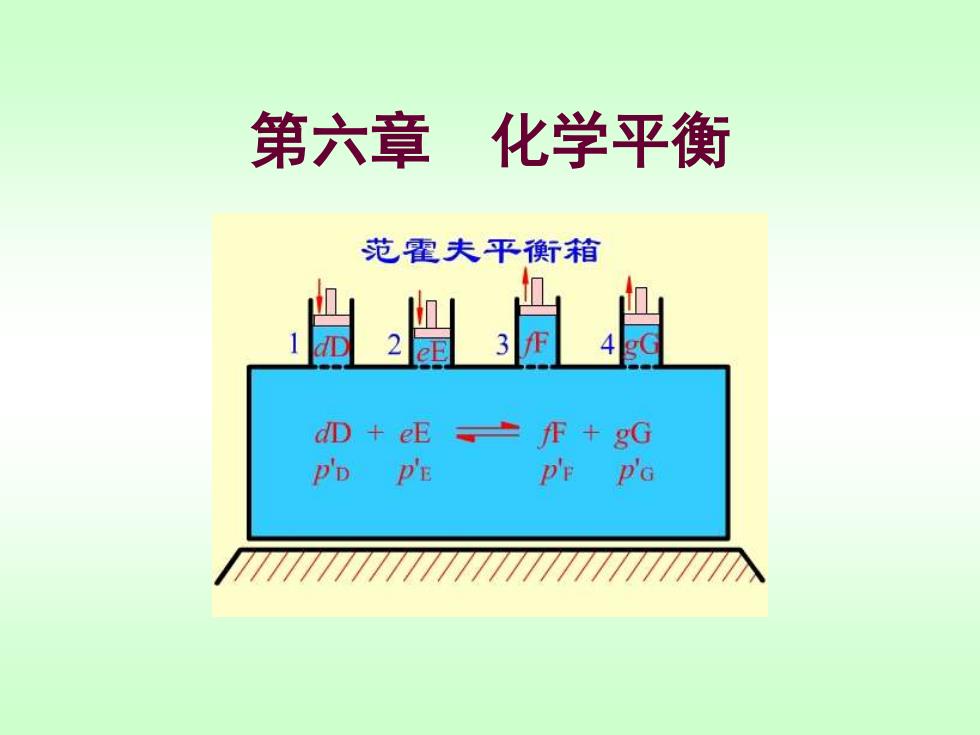
第六章 化学平衡 范霍夫平衡舒箱 愠盟 dD +eE fF gG P'D P'E P'F P'G
第六章 化学平衡

第六章化学平衡衡 §6.1化学反应的平衡条件 反应进度和化学反应的亲和势 §6.2化学反应的平衡常数和等温方程式 §6.3平衡常数的表示式 §6.4复相化学平衡 §6.5标准摩尔生成Gibbs自由能 §6.6温度、压力及惰性气体对化学平衡的影响 §6.7同时化学平衡衡 §6:8反应的耦合 §6.9近似计算 *§6.10生物能学简介
第六章 化学平衡 §6.1 化学反应的平衡条件—— 反应进度和化学反应的亲和势 §6.2 化学反应的平衡常数和等温方程式 §6.3 平衡常数的表示式 §6.4 复相化学平衡 §6.5 标准摩尔生成Gibbs自由能 §6.6 温度、压力及惰性气体对化学平衡的影响 §6.8 反应的耦合 §6.9 近似计算 §6.7 同时化学平衡 *§6.10 生物能学简介

§6.1化学反应的平衡条件和反应进度 5的关系 化学反应系统: 封闭的单相系统,不作非膨胀功,当发生了 一个微小变化时,有: dU=TdS-pdW+∑dnB dG=-SdT+dp+∑4dnB 引入反应进度的概念 dξ= dns dne Veds VB
§6.1 化学反应的平衡条件和反应进度 的关系 化学反应系统: 封闭的单相系统,不作非膨胀功,当发生了 一个微小变化时,有: B B d d d d U T S p V n = − + B B B d d d d G S T V p n = − + + B 引入反应进度的概念 B B d d n = d d nB B =

反应进度(extent of reaction) yoD+yEE+.>yF+yGG+. t=0,5=0 neg ngo t=t,5=5 np ne ne na 反应进度的定义为: △5=s⑤)-”wd5= ns 5单位:mol VB VB ngo和n.分别代表任一组分B在起始和t时 刻的物质的量。B是任一组分B的化学计量数, 对反应物取负值,对生成物取正值
反应进度(extent of reaction ) 反应进度 的定义为: B B,0 B n n ( ) = − B B d d n = 和 分别代表任一组分B 在起始和 t 时 刻的物质的量。 是任一组分B的化学计量数, 对反应物取负值,对生成物取正值。 nB,0 B n B D E F G D E F G + +→ + + t = t, = D n E n F n G n t = 0, = 0 nD,0 E,0 n nF,0 nG,0 单位:mol

化学反应的平衡条件和反应进度5的关系 基本公式可表示为: dU=TdS-pdV+∑ye4ed5 P dG=-SdT+Wdp+∑y4d5 等温、等压条件下, (dGp=∑Hndne=∑n4md
化学反应的平衡条件和反应进度 的关系 基本公式可表示为: B B B d d d d U T S p V = − + B B B d d d d G S T V p = − + + 等温、等压条件下, , B B B ( )d d G n T p = B B B = d

化学反应的平衡条件和反应进度ξ的关系 (dG)z,p=∑yB4d5 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势4B保持不变
化学反应的平衡条件和反应进度 的关系 , B B B ( )d d G T p = B B r m T p, B G G = = 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变

判断化学反应的方向与限度 用。,4或aCh,作判据都是等效的 (AGm).p0 反应自发地向左进行 ∑4>0 (A:Gm)T.p=O ∑4=0 反应达到平衡
判断化学反应的方向与限度 用 , B r m , 作判据都是等效的 B ( ) , ( ) T p B T p G G 或 r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行 r m , ( ) 0 G T p = 反应达到平衡 B B B 0 B B B > 0 B B B = 0

判断化学反应的方向与限度 用 a衫 判断,这相当于G~5图上曲线的斜率 T,p 因为是微小变化,反应进度处于0~1mol之间。 G 0 反应自发向左进行,趋向平衡 og T,P =0 反应达到平衡 T.p
判断化学反应的方向与限度 用 判断,这相当于 图上曲线的斜率 T p, G G ~ , 0 T p G 反应自发向右进行,趋向平衡 , 0 T p G 反应自发向左进行,趋向平衡 , 0 T p G = 反应达到平衡 因为是微小变化,反应进度处于0~1 mol之间
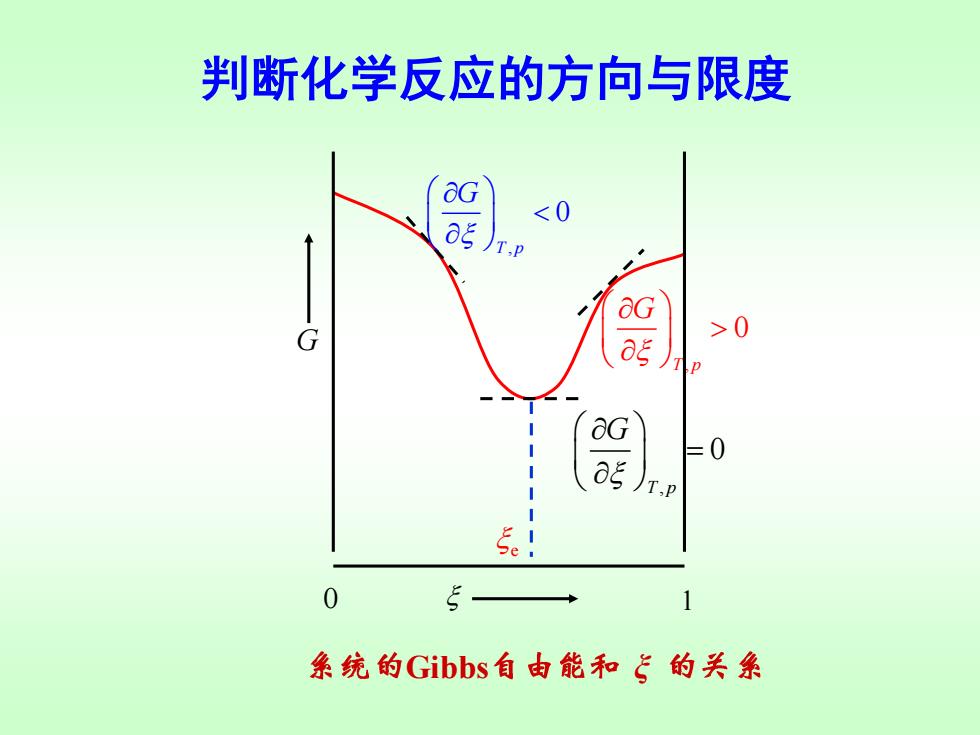
判断化学反应的方向与限度 &G >0 系统的Gibbs自由能和飞的关系
判断化学反应的方向与限度 , 0 T p G , 0 T p G = , 0 T p G Gibbs ξ 0 1 G e

为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故