
药品监督管理统计报告 (2021年第三季度) 国家药品监督管理局综合和规划财务司 中国食品药品监管数据中心 2022年3月
药品监督管理统计报告 (2021 年第三季度) 国家药品监督管理局综合和规划财务司 中国食品药品监管数据中心 2022 年 3 月

说明 本报告所用数据来源于《药品监督管理2020年年报及2021 年定期(月报、季报)统计调查制度》月报、季报,数据报告期 为2021年1月1日至2021年9月30日。报告分别对药品、医 疗器械、化妆品的相关行政受理、审批、监管等情况进行了汇总 分析,供药品监管系统参考使用
说 明 本报告所用数据来源于《药品监督管理 2020 年年报及 2021 年定期(月报、季报)统计调查制度》月报、季报,数据报告期 为 2021 年 1 月 1 日至 2021 年 9 月 30 日。报告分别对药品、医 疗器械、化妆品的相关行政受理、审批、监管等情况进行了汇总 分析,供药品监管系统参考使用

目录 一、药品监督管理 (一)药品行政受理情况… (二)药品注册审批情况 (三)国产,进口药品批准文号情况 3 (四)药品生产企业许可情况 4 (五药品经营企业许可情况. 4 (六)药品生产日常监管情况. (七)药品经营日常监管情况 (八)互联网药品信息服务机构审批情况 (九)地方药品抽检情况… .6 (十)进口药品检验情况 6 (十一)药品案件查处情况 6 二、医疗器械监督管理… .7 (一)医疗器械行政受理情况.… .7 (二)医疗器械产品注册情况 , (三)医疗器械生产企业基本情况 (四)医疗器核经营企业基本情况 (五)医疗器械生产日常监管情况 .8 (六)医疗器械经营日常监管情况… (七)地方医疗器候抽验情况 .8 (八)医疗器械案件查处情况 8 三、化妆品监督管理a (一)化妆品受理审批情况… 9 (二)化妆品生产企业许可情况 10 (三)化妆品生产日常监管情况 10 (四)化妆品案件查处情况 10
目 录 一、药品监督管理 ....................................................................................1 (一) 药品行政受理情况...................................................................1 (二) 药品注册审批情况...................................................................1 (三) 国产、进口药品批准文号情况 ..............................................3 (四) 药品生产企业许可情况 ..........................................................4 (五) 药品经营企业许可情况 ..........................................................4 (六) 药品生产日常监管情况 ..........................................................5 (七) 药品经营日常监管情况 ..........................................................5 (八) 互联网药品信息服务机构审批情况 ......................................5 (九) 地方药品抽检情况...................................................................6 (十) 进口药品检验情况...................................................................6 (十一) 药品案件查处情况 ..............................................................6 二、医疗器械监督管理 ............................................................................7 (一) 医疗器械行政受理情况 ..........................................................7 (二) 医疗器械产品注册情况 ..........................................................7 (三) 医疗器械生产企业基本情况 ..................................................8 (四) 医疗器械经营企业基本情况 ..................................................8 (五) 医疗器械生产日常监管情况 ..................................................8 (六) 医疗器械经营日常监管情况 ..................................................8 (七) 地方医疗器械抽验情况 ..........................................................8 (八) 医疗器械案件查处情况 ..........................................................8 三、化妆品监督管理 ................................................................................9 (一) 化妆品受理审批情况 ..............................................................9 (二) 化妆品生产企业许可情况 ....................................................10 (三) 化妆品生产日常监管情况 ....................................................10 (四) 化妆品案件查处情况 ............................................................10

一、药品监督管理 (一)药品行政受理情况 1国家药监局(以下简称“国家局”)药品行玫受理事项情况 本报告期内国家局受理进口(含港澳台)药品临床试验申请481 件,其中中药天然药物临床试验0件,化学药品临床试验315件,生 物制品临床试验166件;受理上市申请507件,其中中药天然药物上 市申请1件,化学药品上市申请459件,生物制品上市申请47件; 受理再注册申请256件,补充申请1154件.详见附表1. 本报告期内国家局受理国产药品临床试验申请1286件,其中中 药天然药物临床试验29件,化学药品临床试验811件,生物制品临 床试验446件;受理上市申请1736件,其中中药天然药物上市申请 8件,化学药品上市申请1674件,生物制品上市申请54件:受理补 充申请2980件。详见附表1. 本报告期内国家局受理仿制药质量和疗效一致性评价申请644 件,临时进口申请298件。详见附表1. 2.省局行政受理事项情况 本报告期内各省(区,市)局受理再注册申请5640件,药品上 市后变更备案接收17654件,受理药品上市后变更报告接收1195 件。受理进口药材首次进口审批申请77件,备案3引9件,补充申请 0件。详见附表2 (二)药品注册审批情况 1境内生产药品临床中请的审批情况 本报告期内国家局共批准新药临床试验申请1063件,其中批准国 际多中心临床试验申请0件.详见附表3. 2新上市药品的申报审批情况 1
1 一、药品监督管理 (一)药品行政受理情况 1.国家药监局(以下简称“国家局”)药品行政受理事项情况 本报告期内国家局受理进口(含港澳台)药品临床试验申请 481 件,其中中药天然药物临床试验 0 件,化学药品临床试验 315 件,生 物制品临床试验 166 件;受理上市申请 507 件,其中中药天然药物上 市申请 1 件,化学药品上市申请 459 件,生物制品上市申请 47 件; 受理再注册申请 256 件,补充申请 1154 件。详见附表 1。 本报告期内国家局受理国产药品临床试验申请 1286 件,其中中 药天然药物临床试验 29 件,化学药品临床试验 811 件,生物制品临 床试验 446 件;受理上市申请 1736 件,其中中药天然药物上市申请 8 件,化学药品上市申请 1674 件,生物制品上市申请 54 件;受理补 充申请 2980 件。详见附表 1。 本报告期内国家局受理仿制药质量和疗效一致性评价申请 644 件,临时进口申请 298 件。详见附表 1。 2.省局行政受理事项情况 本报告期内各省(区、市)局受理再注册申请 5640 件,药品上 市后变更备案接收 17654 件,受理药品上市后变更报告接收 1195 件。受理进口药材首次进口审批申请 77 件,备案 319 件,补充申请 0 件。详见附表 2。 (二)药品注册审批情况 1.境内生产药品临床申请的审批情况 本报告期内国家局共批准新药临床试验申请 1063 件,其中批准国 际多中心临床试验申请 0 件。详见附表 3。 2.新上市药品的申报审批情况

本报告期内国家局共批准3类中药天然药物新上市申请3件:批准 1类化学药品新上市申请24件,2类化学药品新上市申请36件,3类 化学药品新上市申请130件,4类化学药品新上市申请582件,5类化 学药品新上市审请93件:批准预防用生物制品13件,治疗用生物制品 97件,体外诊断试剂0件。详见附表4. 3.境外生严药品临床中请的审批情况 本报告期内共批准境外生产药品临床申请484件,其中中药天然药 物0件,化学药品321件,生物制品163件,详见附表5. 4境外生产药品上市中请的审批情况 本报告期内共批准境外生产药品上市申请168件,其中中药天然药 物0件,化学药品114件,生物制品54作。详见附表6. 5.份制药临床中请的审批情况 本报告期内共批准化学药品仿制药临床申请40作。详见附表7: 6.仿制药上市申请的审批情况 本报告期内共批准化学药品仿制药上市申请734件。详见附表8. 7.进口药材审批情况 本报告期内共批准进口药材首次进口申请47件,备案421件,补 充申请8作。详见附表9。 8.国产药品再注册中请的审批情况 本报告期内全国各省(区、市)局共批准国产药品再注册申请9877 件,其中中药天然药物2773件,化学药品6793件,生物制品311件. 详见附表10. 9境外生产药品再注册中请的审批情况 本报告期内国家局共批准境外生产药品再注册申请293件,其中中 药天然药物16件,化学药品235作,生物制品42件,详见附表11
2 本报告期内国家局共批准 3 类中药天然药物新上市申请 3 件;批准 1 类化学药品新上市申请 24 件,2 类化学药品新上市申请 36 件,3 类 化学药品新上市申请 130 件,4 类化学药品新上市申请 582 件,5 类化 学药品新上市申请 93 件;批准预防用生物制品 13 件,治疗用生物制品 97 件,体外诊断试剂 0 件。详见附表 4。 3.境外生产药品临床申请的审批情况 本报告期内共批准境外生产药品临床申请 484 件,其中中药天然药 物 0 件,化学药品 321 件,生物制品 163 件。详见附表 5。 4.境外生产药品上市申请的审批情况 本报告期内共批准境外生产药品上市申请 168 件,其中中药天然药 物 0 件,化学药品 114 件,生物制品 54 件。详见附表 6。 5.仿制药临床申请的审批情况 本报告期内共批准化学药品仿制药临床申请 40 件。详见附表 7。 6.仿制药上市申请的审批情况 本报告期内共批准化学药品仿制药上市申请 734 件。详见附表 8。 7.进口药材审批情况 本报告期内共批准进口药材首次进口申请 47 件,备案 421 件,补 充申请 8 件。详见附表 9。 8.国产药品再注册申请的审批情况 本报告期内全国各省(区、市)局共批准国产药品再注册申请 9877 件,其中中药天然药物 2773 件,化学药品 6793 件,生物制品 311 件。 详见附表 10。 9.境外生产药品再注册申请的审批情况 本报告期内国家局共批准境外生产药品再注册申请 293 件,其中中 药天然药物 16 件,化学药品 235 件,生物制品 42 件。详见附表 11

10.国家局受理药品补充中请审批情况 本报告期内国家局共批准药品补充申请4377件,其中中药天然药 物758件,化学药品2995件,生物制品624件:共批准备案申请156 件,其中中药天然药物4件,化学药品119件,生物制品33件。详见 附表12. 11.省局受理/接收事项审批情况 本报告期内全国各省(区、市)局共批准通过药品上市后变更备案 15451件,其中中药天然药物6822件,化学药品8206件,生物制品423 件.详见附表13. 12.按药品管理的体外诊断试制上市中请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂上市申请0 件。详见附表14。 13.按药品管理的体外诊断试剂再注册及补充中请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂再注册申请 1件,补充申请5件。详见附表15. 14.批准创新药上市情况 本报告期内国家局共批准创新药上市品种26个,其中中药天然药 物2个,化学药品17个,生物制品7个。详见附表16. 15.批准创新药临床试验情况 本报告期内国家局共批准创新药临床品种111个,其中药天然药 物20个,化学药品732个,生物制品359个。详见附表17. (三)国产、进口药品批准文号情况 截至2021年9月底,共有国产药品批准文号150043件,其中中药 天然药物56914件,化学药品91362件,生物制品1699件,辅料68 件:共有境外生产药品注册证4663件,其中中药天然药物78件,化学
3 10.国家局受理药品补充申请审批情况 本报告期内国家局共批准药品补充申请 4377 件,其中中药天然药 物 758 件,化学药品 2995 件,生物制品 624 件;共批准备案申请 156 件,其中中药天然药物 4 件,化学药品 119 件,生物制品 33 件。详见 附表 12。 11.省局受理/接收事项审批情况 本报告期内全国各省(区、市)局共批准通过药品上市后变更备案 15451 件,其中中药天然药物 6822 件,化学药品 8206 件,生物制品 423 件。详见附表 13。 12.按药品管理的体外诊断试剂上市申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂上市申请 0 件。详见附表 14。 13.按药品管理的体外诊断试剂再注册及补充申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂再注册申请 1 件,补充申请 5 件。详见附表 15。 14.批准创新药上市情况 本报告期内国家局共批准创新药上市品种 26 个,其中中药天然药 物 2 个,化学药品 17 个,生物制品 7 个。详见附表 16。 15.批准创新药临床试验情况 本报告期内国家局共批准创新药临床品种 1111 个,其中药天然药 物 20 个,化学药品 732 个,生物制品 359 个。详见附表 17。 (三)国产、进口药品批准文号情况 截至 2021 年 9 月底,共有国产药品批准文号 150043 件,其中中药 天然药物 56914 件,化学药品 91362 件,生物制品 1699 件,辅料 68 件;共有境外生产药品注册证 4663 件,其中中药天然药物 78 件,化学
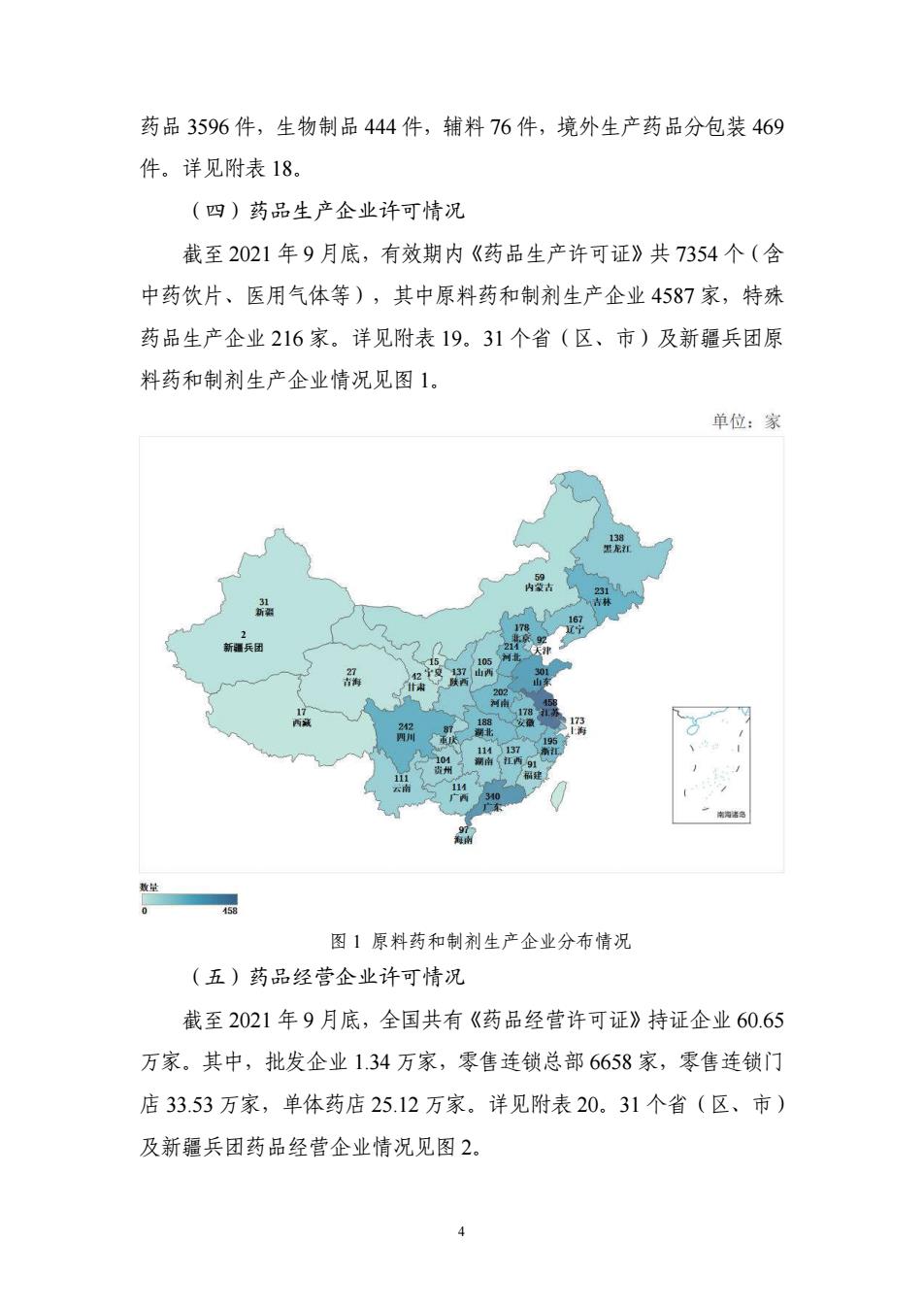
药品3596件,生物制品444件,辅料76件,境外生产药品分包装469 件.详见附表18. (四)药品生产全业许可情况 截至2021年9月底,有效期内《药品生产许可证》共7354个(含 中药饮片,医用气体等),其中原料药和制剂生产企业4587家,特殊 药品生产企业216家。详见附表19.31个省(区、市)及新疆兵团原 料药和制剂生产企业情况见图1. 单位:家 图】原料药和制剂生产企业分布情况 (五)药品经营全业许可情况 战至2021年9月底,全国共有《药品经营许可证》持证企业60.65 万家。其中,批发企业134万家,零售连锁总部6658家,零售连锁门 店33.53万家,单体药店25.12万家,详见附表20.31个省(区、市) 及新隔兵团药品经营企业情况见图2
4 药品 3596 件,生物制品 444 件,辅料 76 件,境外生产药品分包装 469 件。详见附表 18。 (四)药品生产企业许可情况 截至 2021 年 9 月底,有效期内《药品生产许可证》共 7354 个(含 中药饮片、医用气体等),其中原料药和制剂生产企业 4587 家,特殊 药品生产企业 216 家。详见附表 19。31 个省(区、市)及新疆兵团原 料药和制剂生产企业情况见图 1。 图 1 原料药和制剂生产企业分布情况 (五)药品经营企业许可情况 截至 2021 年 9 月底,全国共有《药品经营许可证》持证企业 60.65 万家。其中,批发企业 1.34 万家,零售连锁总部 6658 家,零售连锁门 店 33.53 万家,单体药店 25.12 万家。详见附表 20。31 个省(区、市) 及新疆兵团药品经营企业情况见图 2。 2 新疆兵团
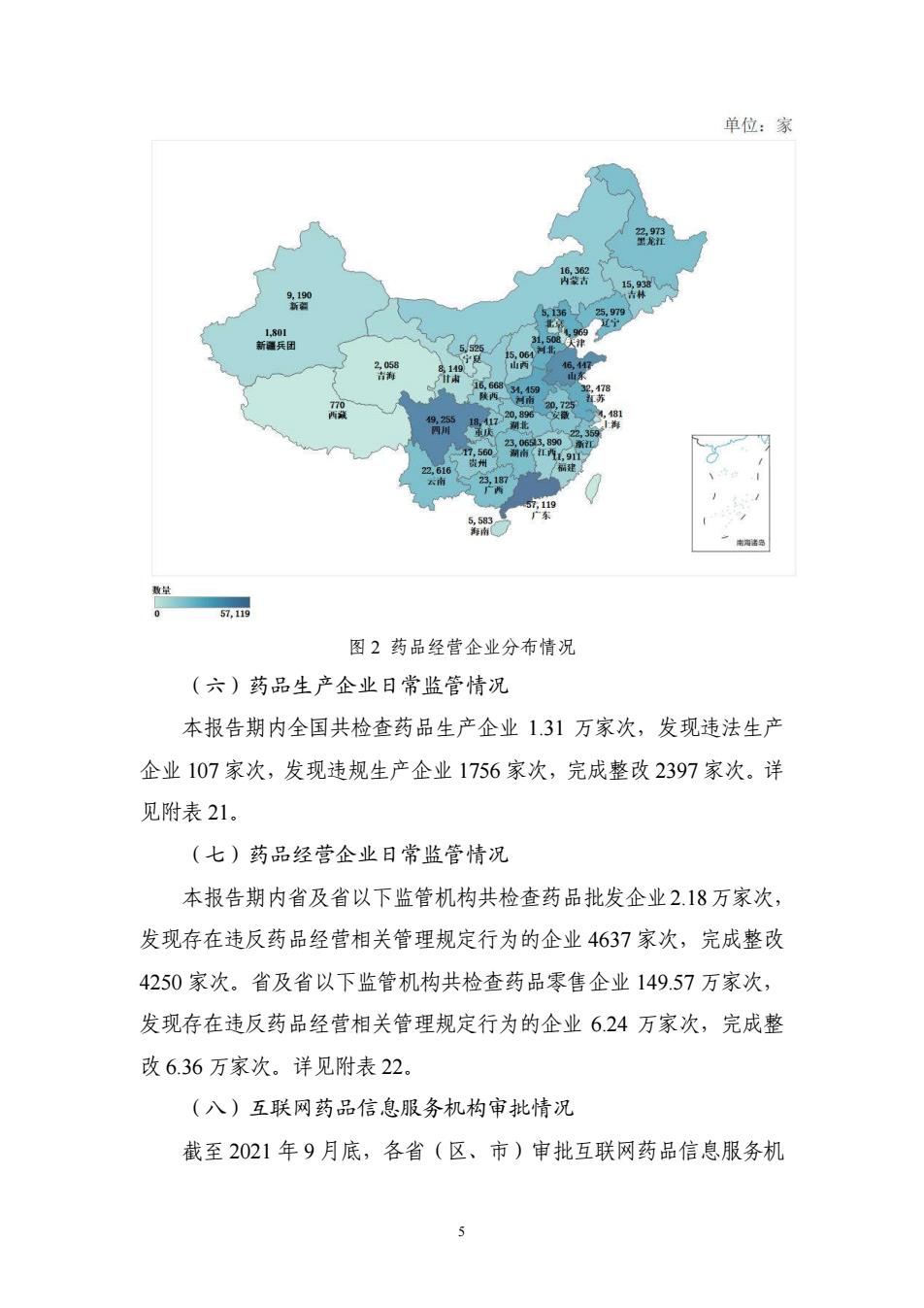
单位:家 围2药品经营企业分布情况 (六)药品生产全业日常监管情况 本报告期内全国共检查药品生产企业13引万家次,发现违法生产 企业107家次,发现违规生产企业1756家次,完成整改2397家次.详 见附表21. (七)药品经营全业日常监管情况 本报告期内省及省以下监管机构共检查药品批发企业218万家次, 发现存在违反药品经营相关管理规定行为的企业4637家次,完咸整改 4250家次.省及省以下监管机构共检查药品零售企业149.57万家次, 发现存在违反药品经营相关管理规定行为的企业624万家次,完成整 改6.36万家次.详见附表22. (入)互联网药品信息服务机构审批情况 截至2021年9月底,各省(区,市)审批互联网药品信息服务机
5 图 2 药品经营企业分布情况 (六)药品生产企业日常监管情况 本报告期内全国共检查药品生产企业 1.31 万家次,发现违法生产 企业 107 家次,发现违规生产企业 1756 家次,完成整改 2397 家次。详 见附表 21。 (七)药品经营企业日常监管情况 本报告期内省及省以下监管机构共检查药品批发企业2.18万家次, 发现存在违反药品经营相关管理规定行为的企业 4637 家次,完成整改 4250 家次。省及省以下监管机构共检查药品零售企业 149.57 万家次, 发现存在违反药品经营相关管理规定行为的企业 6.24 万家次,完成整 改 6.36 万家次。详见附表 22。 (八)互联网药品信息服务机构审批情况 截至 2021 年 9 月底,各省(区、市)审批互联网药品信息服务机 1,801 新疆兵团

构21248家。详见附表23. (九)地方药品抽栓情况 本报告期内各省(区、市)共检验药品145069批次,不合格633 批次,不合格率0.44%.详见附表24. (十)进口药品检验情况 本报告期内中检院及18个口岸药检所对涉及51个国家或地区的 6633批次、130.45亿美元的申请进口药品进行了检验,检验药品批次 数同比增加29.83%(去年同期5109批次),金额数同比增加67.29% (去年同期77.98亿美元),检验不合格63批次,占总批次的0.95% 不合格药品金额达949.01万美元。进口药品检验情况详见附表25~27. (十一)药品案件查处情况 本报告期内全国共查处药品违法案作39063件,案件货值金额共计 58326.60万元,罚款金额共5884633万元,没收违法所得9772.30万元, 捣毁制假售假窝点32个,责令停产停业179家(包括生产企业21家和 经营企业158家),吊销许可证18件(包括生产许可证2件和经营许 可证16件),移送司法机关268作. 查处药品案件数量排在前5位的省份依次为山东,河北、四川、辽 宁、广东,从货值划分来看,货值10万元以下的案件有38857件,占 药品案件总数的99.47%;货值10万元至20万元的案件有82件,占比 021%;货值20万元至50万元的案件有47件,占比0.12%:货值50 万元至1000万元的案件有71件,占比0.18%6:货值1000万元至1亿 元的案件有5件,分别由湖南(2)、安徽(1),福建(1),河北(1) 查处:货值1亿元以上案件1件,由河北查处。 从违法主体来看,药品生产企业案件有637件,占全部药品業件数 的1.63%:经营企业案件有27623件,占比70.71%:医疗机构案件有
6 构 21248 家。详见附表 23。 (九)地方药品抽检情况 本报告期内各省(区、市)共检验药品 145069 批次,不合格 633 批次,不合格率 0.44%。详见附表 24。 (十)进口药品检验情况 本报告期内中检院及 18 个口岸药检所对涉及 51 个国家或地区的 6633 批次、130.45 亿美元的申请进口药品进行了检验,检验药品批次 数同比增加 29.83%(去年同期 5109 批次),金额数同比增加 67.29% (去年同期 77.98 亿美元)。检验不合格 63 批次,占总批次的 0.95%, 不合格药品金额达 949.01 万美元。进口药品检验情况详见附表 25~27。 (十一)药品案件查处情况 本报告期内全国共查处药品违法案件 39063 件,案件货值金额共计 58326.60 万元。罚款金额共 58846.33 万元,没收违法所得 9772.30 万元, 捣毁制假售假窝点 32 个,责令停产停业 179 家(包括生产企业 21 家和 经营企业 158 家),吊销许可证 18 件(包括生产许可证 2 件和经营许 可证 16 件),移送司法机关 268 件。 查处药品案件数量排在前 5 位的省份依次为山东、河北、四川、辽 宁、广东。从货值划分来看,货值 10 万元以下的案件有 38857 件,占 药品案件总数的 99.47%;货值 10 万元至 20 万元的案件有 82 件,占比 0.21%;货值 20 万元至 50 万元的案件有 47 件,占比 0.12%;货值 50 万元至 1000 万元的案件有 71 件,占比 0.18%;货值 1000 万元至 1 亿 元的案件有 5 件,分别由湖南(2)、安徽(1)、福建(1)、河北(1) 查处;货值 1 亿元以上案件 1 件,由河北查处。 从违法主体来看,药品生产企业案件有 637 件,占全部药品案件数 的 1.63%;经营企业案件有 27623 件,占比 70.71%;医疗机构案件有

9471件,占比2425%;其他主体案件有1332件,占比3.41%. 生产销售假劣药品方面,共查处生产销售和使用假劣药案件632 件(其中通过互联网销售假劣药案件38件),货值金额3540133万元, 罚款20269.16万元,移送司法机关167件。详见附表28. 二、医疗器械监督管理 (一)医疗器械行政受理情况 本报告期内,全国共完成第一类医疗器械备案21630件,其中, 境内第一类医疗器械备案21155件,进口第一类医疗器械备案475件. 全国共受理首次注册申请12776件,其中,境内第二类首次注册医疗 器械10926件,境内第三类首次注册医疗器械1276件,进口首次注册 医疗器械(含港澳台)574作,全国共受理延续注册申请12742件,其 中,境内第二类医疗器械延续注册申请8173件,境内第三类医疗器械 延续注册申请171】件,进口医疗器械(含港澳台)延续注册申请2858 件.详见附表29. (二)医疗器械产品注册情况 本报告期内,全国共批准各类医疗器械首次注册10714件,延续 注册13297件.其中,批准境内第二类医疗器械首次注册9512件,境 内第三类医疗器械首次注册785件,进口医疗器械(含港澳台)首次 注册417件;批准境内第二类医疗器械延续注册8352件,境内第三类 医疗器械延续注局1837件,进口医疗器械(含港澳台)延续注册3108 件 截至2021年9月底,全国累计共有境内第一类医疗器械备案 112135件:各省级局共批准境内第二类医疗器械注册75608件。详见 附表29. 7
7 9471 件,占比 24.25%;其他主体案件有 1332 件,占比 3.41%。 生产销售假劣药品方面,共查处生产销售和使用假劣药案件 6372 件(其中通过互联网销售假劣药案件 38 件),货值金额 35401.33 万元, 罚款 20269.16 万元,移送司法机关 167 件。详见附表 28。 二、医疗器械监督管理 (一)医疗器械行政受理情况 本报告期内,全国共完成第一类医疗器械备案 21630 件,其中, 境内第一类医疗器械备案 21155 件,进口第一类医疗器械备案 475 件。 全国共受理首次注册申请 12776 件,其中,境内第二类首次注册医疗 器械 10926 件,境内第三类首次注册医疗器械 1276 件,进口首次注册 医疗器械(含港澳台)574 件。全国共受理延续注册申请 12742 件,其 中,境内第二类医疗器械延续注册申请 8173 件,境内第三类医疗器械 延续注册申请 1711 件,进口医疗器械(含港澳台)延续注册申请 2858 件。详见附表 29。 (二)医疗器械产品注册情况 本报告期内,全国共批准各类医疗器械首次注册 10714 件,延续 注册 13297 件。其中,批准境内第二类医疗器械首次注册 9512 件,境 内第三类医疗器械首次注册 785 件,进口医疗器械(含港澳台)首次 注册 417 件;批准境内第二类医疗器械延续注册 8352 件,境内第三类 医疗器械延续注册 1837 件,进口医疗器械(含港澳台)延续注册 3108 件。 截至 2021 年 9 月底,全国累计共有境内第一类医疗器械备案 112135 件;各省级局共批准境内第二类医疗器械注册 75608 件。详见 附表 29