
11萃取 11.1液液相平衡 11.2萃取操作的原理
11 萃 取 11.1 液液相平衡 11.2 萃取操作的原理
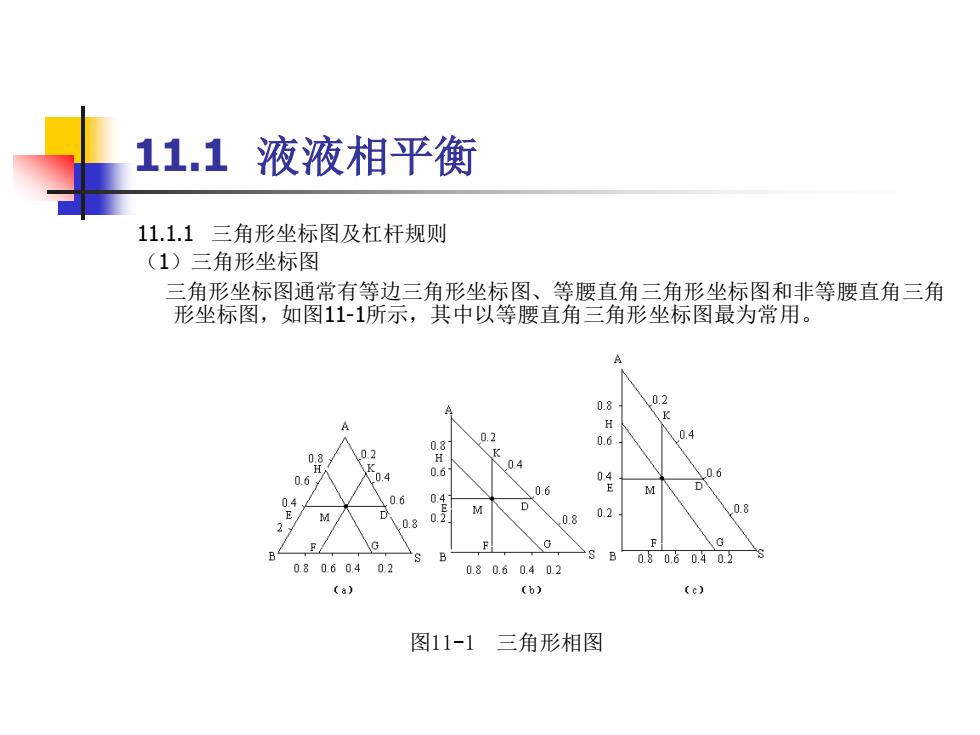
11.1液液相平衡 11.1.1三角形坐标图及杠杆规则 (1)三角形坐标图 三角形坐标图通常有等边三角形坐标图、等腰直角三角形坐标图和非等腰直角三角 形坐标图,如图11-1所示,其中以等腰直角三角形坐标图最为常用。 A 0.8 0 K g 0.2 0.6 0.4 08 0.2 K 0.4 0.6 0.4 0.6 06 0.4 0.6 D 0分 0.2 0.8 0.8 0.8 F F B B080.60.402 0.8 0.60.4 0.2 0.80.60.40.2 (a) (b) (c) 图11-1三角形相图
11.1 液液相平衡 11.1.1 三角形坐标图及杠杆规则 (1)三角形坐标图 三角形坐标图通常有等边三角形坐标图、等腰直角三角形坐标图和非等腰直角三角 形坐标图,如图11-1所示,其中以等腰直角三角形坐标图最为常用。 图11-1 三角形相图

11.1液液相平衡 般而言,在萃取过程中很少遇到恒摩尔流的简化情况,故在三角形坐标图中混 合物的组成常用质量分数表示。习惯上,在三角形坐标图中,AB边以A的质量分 率作为标度,BS边以B的质量分率作为标度,SA边以S的质量分率作为标度。三 角形坐标图的每个顶点分别代表一个纯组分,即顶点A表示纯溶质A,顶点B表示 纯原溶剂(稀释剂)B,顶点S表示纯萃取剂S。三角形坐标图三条边上的任一点 代表一个二元混合物系,第三组分的组成为零。例如AB边上的E点,表示由A、B 组成的二元混合物系,由图可读得:A的组成为0.40,则B的组成为(1.0-0.40) =0.60,S的组成为零。 9 0.8 、0.2 0.4 0.6 04 0.6 0.6 0.4 M M 0.2 08 0.8 0.80.60402 0.80.6 0.4 0.2 0.80.60.40.2 (a) (b) (c)
11.1 液液相平衡 一般而言,在萃取过程中很少遇到恒摩尔流的简化情况,故在三角形坐标图中混 合物的组成常用质量分数表示。 习惯上,在三角形坐标图中,AB边以A的质量分 率作为标度,BS边以B的质量分率作为标度,SA边以S的质量分率作为标度。 三 角形坐标图的每个顶点分别代表一个纯组分,即顶点A表示纯溶质A,顶点B表示 纯原溶剂(稀释剂)B,顶点S表示纯萃取剂S。 三角形坐标图三条边上的任一点 代表一个二元混合物系,第三组分的组成为零。例如AB边上的E点,表示由A、B 组成的二元混合物系,由图可读得:A的组成为0.40,则B的组成为(1.0–0.40) = 0.60,S的组成为零
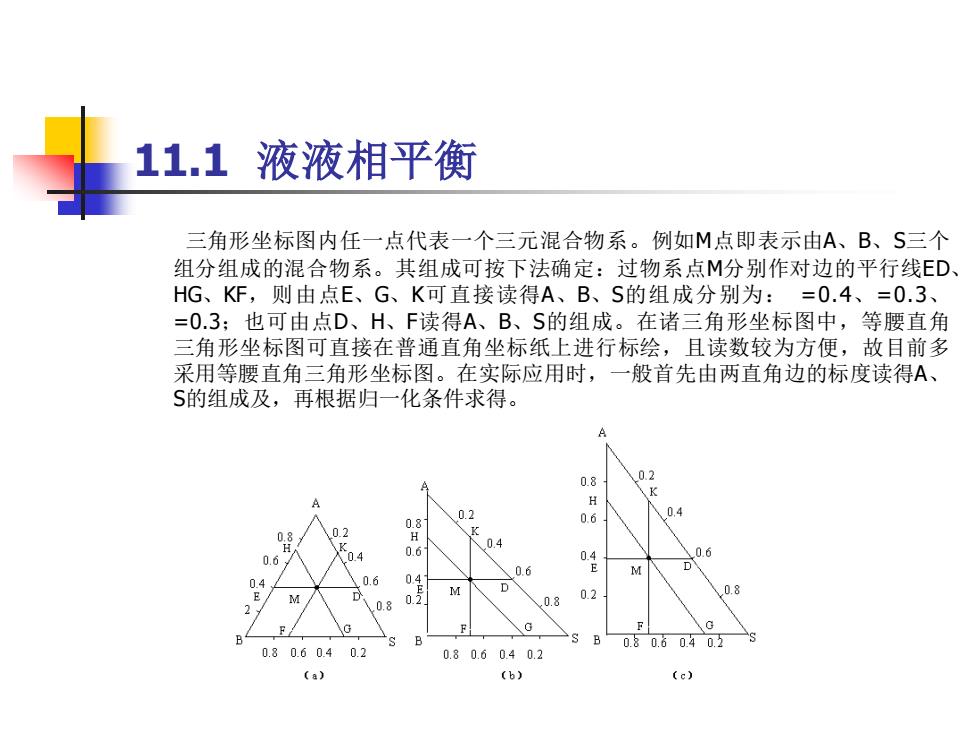
11.1液液相平衡 三角形坐标图内任一点代表一个三元混合物系。例如M点即表示由A、B、S三个 组分组成的混合物系。其组成可按下法确定:过物系点M分别作对边的平行线ED、 HG、KF,则由点E、G、K可直接读得A、B、S的组成分别为:=0.4、=0.3、 =O.3;也可由点D、H、F读得A、B、S的组成。在诸三角形坐标图中,等腰直角 三角形坐标图可直接在普通直角坐标纸上进行标绘,且读数较为方便,故目前多 采用等腰直角三角形坐标图。在实际应用时,一般首先由两直角边的标度读得A、 S的组成及,再根据归一化条件求得。 0.8 0.2 0.2 0.4 08 02 K 06 0.4 0.6 04 06 0.6 0.6 D M 0.8 0 0.8 0.2 G F B 0.80.60402 0.80.60.4 0.2 0.80.6040.2 (a) (b)
11.1 液液相平衡 三角形坐标图内任一点代表一个三元混合物系。例如M点即表示由A、B、S三个 组分组成的混合物系。其组成可按下法确定:过物系点M分别作对边的平行线ED、 HG、KF,则由点E、G、K可直接读得A、B、S的组成分别为: =0.4、=0.3、 =0.3;也可由点D、H、F读得A、B、S的组成。在诸三角形坐标图中,等腰直角 三角形坐标图可直接在普通直角坐标纸上进行标绘,且读数较为方便,故目前多 采用等腰直角三角形坐标图。在实际应用时,一般首先由两直角边的标度读得A、 S的组成及,再根据归一化条件求得

11.1液液相平衡 (2)杠杆规则 Xs 如图11-2所示,将质量为rkg、组成为xA、xB、 xs的混合物系R与质量为kg、组成为yA、yB、ys, 的混合物系E相混合,得到一个质量为mkg、组成 XA R 为2A、2B、2S的新混合物系M,其在三角形坐标图 ys 中分别以点R、E和M表示。M点称为R点与E点的和 ZA 点,R点与E点称为差点。 B XB ZB YB 如图11-2
如图11-2所示,将质量为 kg、组成为 、 、 的混合物系R与质量为 kg、组成为 、 、 , 的混合物系E相混合,得到一个质量为m kg、组成 为 、 、 的新混合物系M,其在三角形坐标图 中分别以点R、E和M表示。M点称为R点与E点的和 点,R点与E点称为差点。 r A x B x S x e A y B y S y A z B z S z 如图11-2 11.1 液液相平衡 (2)杠杆规则

11.1液液相平衡 和点M与差点E、R之间的关系可用杠杆规则描述,即 (I)几何关系:和点M与差点E、R共线。即:和点在两差点的连线 上;一个差点在另一差点与和点连线的延长线上。 (ii)数量关系:和点与差点的量m、r、e与线段长a、b之间的关 系符合杠杆原理,即, 以R为支点可得m、e之间的关系ma=e(a+b) (11-1) 以M为支点可得l、e之间的关系ra=eb (11-2) 以E为支点可得r、m之间的关系r(a+b)=mb (11-3) 根据杠杆规则,若己知两个差点,则可确定和点;若已知和点和一 个差点,则可确定另一个差点
11.1 液液相平衡 和点M与差点E、R之间的关系可用杠杆规则描述,即 (I)几何关系:和点M与差点E、R共线。即:和点在两差点的连线 上;一个差点在另一差点与和点连线的延长线上。 (ii)数量关系:和点与差点的量m、r、e与线段长 、b 之间的关 系符合杠杆原理,即, 以R为支点可得m、e之间的关系 a ma e a b = + ( ) (11-1) 以M为支点可得 、 之间的关系 r e ra = eb ra eb = (11-2) 以E为支点可得 r 、 之间的关系 r m r a b mb ( + =) (11-3) 根据杠杆规则,若已知两个差点,则可确定和点;若已知和点和一 个差点,则可确定另一个差点

11.1.2三角形相图 根据萃取操作中各组分的互溶性,可将三元物系分为以下三种情况,即 ①溶质A可完全溶于B及S,但B与S不互溶; ②溶质A可完全溶于B及S,但B与S部分互溶: ③溶质A可完全溶于B,但A与S及B与S部分互溶。 习惯上,将①、②两种情况的物系称为第I类物系,而将③情况的物系 称为第Ⅱ类物系。工业上常见的第I类物系有丙酮(A)-水(B)甲基异丁基 酮(S)、醋酸(A)-水(B)苯(S)及丙酮(A)氯仿(B)水(S)等;第IⅡ类物系有 甲基环己烷(A)正庚烷(B)苯胺(S)、苯乙烯(A)乙苯(B)二甘醇(S)等。在 萃取操作中,第I类物系较为常见,以下主要讨论这类物系的相平衡关系
11.1.2 三角形相图 根据萃取操作中各组分的互溶性,可将三元物系分为以下三种情况,即 ①溶质A可完全溶于B及S,但B与S不互溶; ②溶质A可完全溶于B及S,但B与S部分互溶; ③溶质A可完全溶于B,但A与S及B与S部分互溶。 习惯上,将①、②两种情况的物系称为第Ⅰ类物系,而将③情况的物系 称为第Ⅱ类物系。工业上常见的第Ⅰ类物系有丙酮(A)–水(B)–甲基异丁基 酮(S)、醋酸(A)–水(B)–苯(S)及丙酮(A)–氯仿(B)–水(S)等;第Ⅱ类物系有 甲基环己烷(A)–正庚烷(B)–苯胺(S)、苯乙烯(A)–乙苯(B)–二甘醇(S)等。在 萃取操作中,第Ⅰ类物系较为常见,以下主要讨论这类物系的相平衡关系

11.1.2三角形相图 设溶质A可完全溶于B及S,但B与S为部分互溶, 其平衡相图如图11-3所示。此图是在一定温度下 绘制的,图中曲线RgRR2 RRKE EE2EE称为溶 解度曲线,该曲线将三角形相图分为两个区域: 曲线以内的区域为两相区,以外的区域为均相区。 KE 位于两相区内的混合物分成两个互相平衡的液相, 称为共轭相,联结两共轭液相相点的直线称为联 R 结线,如图11-3中的RE线(=0,1,2,.n)。显然 E R M 萃取操作只能在两相区内进行。 图11-3溶解度曲线
11.1.2 三角形相图 设溶质A可完全溶于B及S,但B与S为部分互溶, 其平衡相图如图11-3所示。此图是在一定温度下 绘制的,图中曲线R0R1R2RiRnKEnEiE2E1E0称为溶 解度曲线,该曲线将三角形相图分为两个区域: 曲线以内的区域为两相区,以外的区域为均相区。 位于两相区内的混合物分成两个互相平衡的液相, 称为共轭相,联结两共轭液相相点的直线称为联 结线,如图11-3中的RiEi线(i=0,1,2,.n)。显然 萃取操作只能在两相区内进行。 图11-3 溶解度曲线

11.1.2三角形相图 溶解度曲线可通过下述实验方法得到:在一定温度下, 将组分B与组分S以适当比例相混合,使其总组成位于 两相区,设为M,则达平衡后必然得到两个互不相溶的 液层,其相点为R,、Eo。在恒温下,向此二元混合液 中加入适量的溶质A并充分混合,使之达到新的平衡, 静置分层后得到一对共轭相,其相点为R、E1,然后 继续加入溶质A,重复上述操作,即可以得到+1对共 轭相的相点R、E(i=0,1,2,.n),当加入A的量使混 合液恰好由两相变为一相时,其组成点用K表示,K点 称为混溶点或分层点。联结各共轭相的相点及K点的曲 线即为实验温度下该三元物系的溶解度曲线
11.1.2 三角形相图 溶解度曲线可通过下述实验方法得到:在一定温度下, 将组分B与组分S以适当比例相混合,使其总组成位于 两相区,设为M,则达平衡后必然得到两个互不相溶的 液层,其相点为R0、E0。在恒温下,向此二元混合液 中加入适量的溶质A并充分混合,使之达到新的平衡, 静置分层后得到一对共轭相,其相点为R1、E1,然后 继续加入溶质A,重复上述操作,即可以得到n+1对共 轭相的相点Ri、Ei (i=0,1,2,.n),当加入A的量使混 合液恰好由两相变为一相时,其组成点用K表示,K点 称为混溶点或分层点。联结各共轭相的相点及K点的曲 线即为实验温度下该三元物系的溶解度曲线
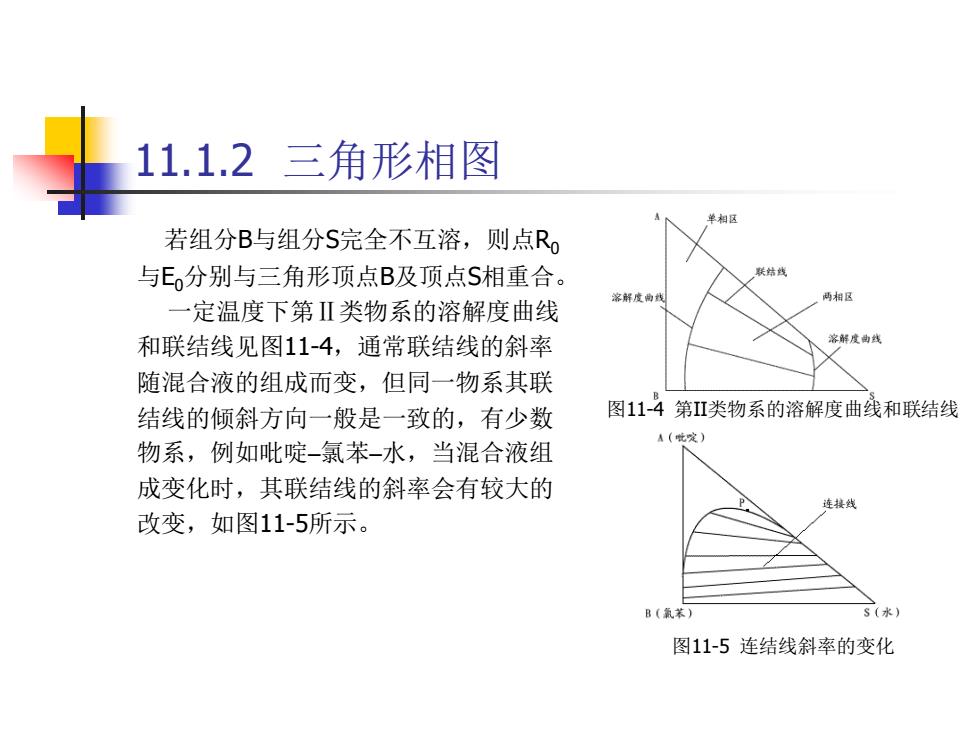
11.1.2 三角形相图 单相区 若组分B与组分S完全不互溶,则点R, 与E,分别与三角形顶点B及顶点S相重合。 联结线 家解废曲线 两相区 一定温度下第Ⅱ类物系的溶解度曲线 和联结线见图11-4,通常联结线的斜率 溶解度曲线 随混合液的组成而变,但同一物系其联 结线的倾斜方向一般是一致的,有少数 图114第IⅡ类物系的溶解度曲线和联结线 A(定) 物系,例如吡啶-氯苯-水,当混合液组 成变化时,其联结线的斜率会有较大的 连接线 改变,如图11-5所示。 B(苯) 图11-5连结线斜率的变化
11.1.2 三角形相图 若组分B与组分S完全不互溶,则点R0 与E0分别与三角形顶点B及顶点S相重合。 一定温度下第Ⅱ类物系的溶解度曲线 和联结线见图11-4,通常联结线的斜率 随混合液的组成而变,但同一物系其联 结线的倾斜方向一般是一致的,有少数 物系,例如吡啶–氯苯–水,当混合液组 成变化时,其联结线的斜率会有较大的 改变,如图11-5所示。 图11-4 第II类物系的溶解度曲线和联结线 图11-5 连结线斜率的变化