
第三节 第二节 第一节 第六章 花 分步沉淀和沉淀的 沉淀的生成和溶解 标准溶度积常数 淀溶解平衡 电 质
第六章难溶强电解质的 第一节标准溶度积常数 第二节沉淀的生成和溶解 第三节分步沉淀和沉淀的 转化 沉淀溶解平衡

第一节标准溶度积常数 一、标准溶度积常数 二、标准溶度积常数与溶解度的关系
第一节 标准溶度积常数 一、标准溶度积常数 二、标准溶度积常数与溶解度的关系

一、标准溶度积常数 难溶强电解质M,A,在水溶液中存在下列沉 淀一溶解平衡: M,.A,v.M (aq)+vA-(aq) 标准平野常数表达式为: K9(M,A)=[c.(M-)/ce]r·[c(A2)/ce] 上式表明:在一定温度下,难溶强电解质饱和 溶液中离子的相对浓度各以其化学计量数为幂 指数的乘积为一常数。此常数称为标准溶度积 常数
一、标准溶度积常数 难溶强电解质 在水溶液中存在下列沉 淀-溶解平衡: 标准平衡常数表达式为: M A v v + − M A M (aq) A (aq) z z v v v v + − + − + − + 上式表明:在一定温度下,难溶强电解质饱和 溶液中离子的相对浓度各以其化学计量数为幂 指数的乘积为一常数。此常数称为标准溶度积 常数。 sp eq eq (M A ) [ (M )/ ] [ (A )/ ] z v z v K c c c c v v + + − − + − =
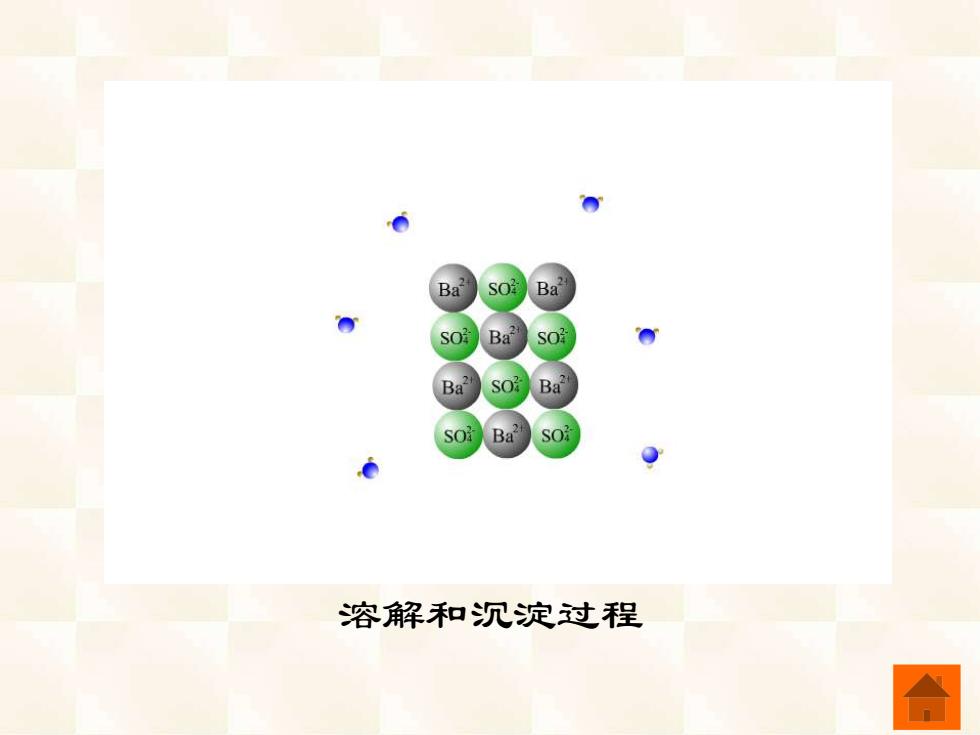
Ba? Ba Ba SO:Ba 溶解和沉淀过程
溶解和沉淀过程

标准溶度积常数的大小反映了难溶强电解 质的溶解能力的大小,K日越小,难溶强电解质 就越难溶于水。K只与温度有关,而与电解 质离子的浓度无关。 例题
标准溶度积常数的大小反映了难溶强电解 质的溶解能力的大小, 越小,难溶强电解质 就越难溶于水。 只与温度有关,而与电解 质离子的浓度无关。 例题 Ksp Ksp

二、标准溶度积常数与溶解度的关系 M,.A,(s)=vMi(aq)+vA-(aq) K=[c(M-)/cIce(A-)/c]- =(v,s/ce)(ys1ce)y=(y)严(v)y.(s/c9)严+" ++V K留 c1 V(y)严·(v)' 对于同类型的难溶强电解质,标准溶度积常 数越大,溶解度也就越大。但对于不同类型的难 溶强电解质,不能直接用标准溶度积常数来比较 溶解度的大小,必须通过计算进行判断。 例题
二、标准溶度积常数与溶解度的关系 对于同类型的难溶强电解质,标准溶度积常 数越大,溶解度也就越大。但对于不同类型的难 溶强电解质,不能直接用标准溶度积常数来比较 溶解度的大小,必须通过计算进行判断。 例题 M A (s) M (aq) A (aq) z z v v v v + − + − + − + sp eq eq [ (M ) / ] [ (A ) / ] z v z v K c c c c + + − − = sp ( ) ( ) v v s K c v v + − + − = v v + − + ( / ) ( / ) ( ) ( ) ( / ) v v v v v v v s c v s c v v s c + − + − + − + = = + − + −

第二节 沉淀的生成和溶解 一、溶度积规则 二、沉淀的生成 三、沉淀的溶解 四、同离子效应和盐效应
第二节 沉淀的生成和溶解 一、溶度积规则 二、沉淀的生成 三、沉淀的溶解 四、同离子效应和盐效应

溶度积规则 对于沉淀一溶解反应: M,.A,(s)=v,M (aq)+vA-(aq) 其反应商为: /=xA 沉淀一溶解反应的摩尔吉布斯函数变为: △,Gm=-RTIn K9+RTInJ
一、溶度积规则 对于沉淀-溶解反应: 其反应商为: 沉淀-溶解反应的摩尔吉布斯函数变为: M A (s) M (aq) A (aq) z z v v v v + − + − + − + (M ) (A ) [ ] [ ] z z c c v v J c c + − + − = r m sp = − + G RT K RT J ln ln

由上式可以得出如下结论: (1)当K9>J时,△,Gm<0,沉淀-溶解反应 正向进行。若溶液中有难溶强电解质固体,则固 体溶解,直至K=J时重新达到沉淀一溶解平衡断。 (2)当 时, ,沉淀一溶解反应 处于平衡状瑾蠼时的琼刘饱和溶液。 (3)当 时, ,沉淀一溶解反应 逆向进行,东家海析出个真至0 时重新达到 沉淀一溶解平。 K9=J 这就是沉淀 溶解平衡的反应商判据,也称 溶度积规则。利用溶度积规则,可以判断沉淀的 生成或溶解
由上式可以得出如下结论: (1)当 时, ,沉淀-溶解反应 正向进行。若溶液中有难溶强电解质固体,则固 体溶解,直至 时重新达到沉淀-溶解平衡。 (2)当 时, ,沉淀-溶解反应 处于平衡状态,此时的溶液为饱和溶液。 (3)当 时, ,沉淀-溶解反应 逆向进行,有沉淀析出,直至 时重新达到 沉淀-溶解平衡。 这就是沉淀 溶解平衡的反应商判据,也称 溶度积规则。利用溶度积规则,可以判断沉淀的 生成或溶解。 r m G 0 r m = G 0 r m G 0 K J sp > K J sp = K J sp = K J sp = K J sp < -

二、 沉淀的生成 根据溶度积规则,如果J>K,就会有难溶强 电解质的沉淀生成。 例题
二、沉淀的生成 根据溶度积规则,如果 ,就会有难溶强 电解质的沉淀生成。 例题 sp J K