
第十六章 d区元素(二) 第一节 铁系元素 第二节铂系元素
第十六章 d 区元素 (二) 第一节 铁系元素 第二节 铂系元素

第8、9、10族元素包括铁、钴、镍、钌、 铑、钯、锇、铱、铂九种元素。第一过渡系的 第8、9、10族元素的性质相似,称为铁系元素。 第二过渡系和第三过渡系的第8、9、10 族元素钌、铑、锇、铱、铂统称为铂系元素。 备
无机化学 第 8、9、10 族元素包括铁、钴、镍、钌、 铑、钯、锇、铱、铂九种元素。第一过渡系的 第 8、9、10 族元素的性质相似,称为铁系元素。 第二过渡系和第三过渡系的第 8、9、10 族元素钌、铑、锇、铱、铂统称为铂系元素

第一节 铁系概述 一、铁系元素概念 二、铁的重要化合物 三、钴和镍的重要化合物 e
第一节 铁系概述 一、铁系元素概念 二、铁的重要化合物 三、钴和镍的重要化合物

一、铁系元素概述 Fe、C0、Ni元素的价电子组态分别是3d4s2、 3d74s2、3d84s2,它们的原子半径十分接近,在最外 层的4$轨道上都有两个电子,只是次外层的3d电 子不同,所以它们的性质很相似。第一过渡系元素 原子的电子填充过渡到第8~10族时,3d电子已超 过5个,在一般情况下价电子全部参加成键的可能 性减小,已不再呈现与族数相当的最高氧化值。F 元素的最高氧化值为+6,常见氧化值是+2和+3, 与很强的氧化剂作用,F可以生成不稳定的+6氧 化值的化合物。C0、Ni元素的最高氧化值为+3, 常见氧化值都是+2
无机化学 一、铁系元素概述 Fe、Co、Ni 元素的价电子组态分别是3d64s2 、 3d74s2 、3d84s2,它们的原子半径十分接近,在最外 层的 4s 轨道上都有两个电子,只是次外层的 3d 电 子不同,所以它们的性质很相似。第一过渡系元素 原子的电子填充过渡到第 8 ~10 族时,3d 电子已超 过 5 个,在一般情况下价电子全部参加成键的可能 性减小,已不再呈现与族数相当的最高氧化值。Fe 元素的最高氧化值为 +6,常见氧化值是 +2 和 +3, 与很强的氧化剂作用,Fe 可以生成不稳定的 +6 氧 化值的化合物。Co、Ni 元素的最高氧化值为 +3, 常见氧化值都是 +2
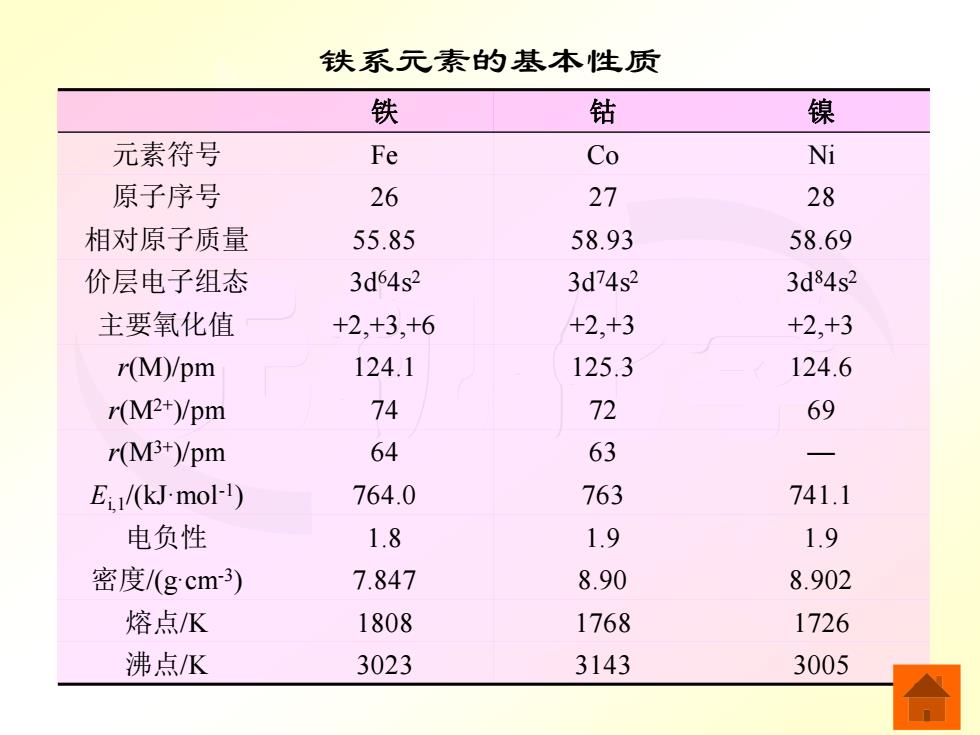
铁系元素的基本性质 铁 钴 镍 元素符号 Fe Co Ni 原子序号 26 27 28 相对原子质量 55.85 58.93 58.69 价层电子组态 3d64s2 3d74s2 3d84s2 主要氧化值 +2,+3,+6 +2,+3 +2,+3 r(M)/pm 124.1 125.3 124.6 r(M2+)/pm 74 72 69 r(M3+)/pm 64 63 Ei/(kJmol-1) 764.0 763 741.1 电负性 1.8 1.9 1.9 密度/(gcm3) 7.847 8.90 8.902 熔点K 1808 1768 1726 沸点K 3023 3143 3005
无机化学 铁系元素的基本性质 铁 钴 镍 元素符号 Fe Co Ni 原子序号 26 27 28 相对原子质量 55.85 58.93 58.69 价层电子组态 3d64s2 3d74s2 3d84s2 主要氧化值 +2,+3,+6 +2,+3 +2,+3 r(M)/pm 124.1 125.3 124.6 r(M2+)/pm 74 72 69 r(M3+)/pm 64 63 ─ Ei,1/(kJ·mol-1 ) 764.0 763 741.1 电负性 1.8 1.9 1.9 密度/(g·cm-3 ) 7.847 8.90 8.902 熔点/K 1808 1768 1726 沸点/K 3023 3143 3005

Fe、C0和Ni元素的原子半径、离子半径、电 离能等性质基本上随原子序数增加而呈现规律性变 化。Ni元素的相对原子质量比C0元素的相对原子 质量小,这是因为N的同位素中质量数小的一种 所占的质量分数较大的缘故。 铁、钴、镍单质都是具有光泽的银白色金属。 铁、钴略带灰色,而镍为银白色。它们的密度都较 大,熔点也较高。钴比较硬而脆,铁和镍却有很好 的延展性。此外,它们都表现有铁磁性,钴、镍、 铁合金是很好的兹性材料。 铁、钴、镍都是中等活泼的金属单质。在常温 和无水情况下,铁系元素的单质都比较稳定,但在 高温下,它们能与氧气、硫、氮气、氯气发生剧烈 的反应
无机化学 Fe、Co 和 Ni 元素的原子半径、离子半径、电 离能等性质基本上随原子序数增加而呈现规律性变 化。Ni 元素的相对原子质量比 Co 元素的相对原子 质量小,这是因为 Ni 的同位素中质量数小的一种 所占的质量分数较大的缘故。 铁、钴、镍单质都是具有光泽的银白色金属。 铁、钴略带灰色,而镍为银白色。它们的密度都较 大,熔点也较高。钴比较硬而脆,铁和镍却有很好 的延展性。此外,它们都表现有铁磁性,钴、镍、 铁合金是很好的磁性材料。 铁、钴、镍都是中等活泼的金属单质。在常温 和无水情况下,铁系元素的单质都比较稳定,但在 高温下,它们能与氧气、硫、氮气、氯气发生剧烈 的反应

在常温下,铁因“钝化”而不与浓硝酸、 浓硫酸反应,所以可用铁制品盛装和运输浓硝 酸和浓硫酸。稀硝酸能溶解铁,若铁过量,则 生成Fe(NO3)2;若HNO3过量,则生成Fe(NO3)3o 铁能从非氧化性酸中置换出氢气,也能被浓碱 溶液所侵蚀,在潮湿空气中生成铁锈。钴和镍 在大多数无机酸中缓慢溶解,但在碱性溶液中 稳定性较高
无机化学 在常温下,铁因 “钝化” 而不与浓硝酸、 浓硫酸反应,所以可用铁制品盛装和运输浓硝 酸和浓硫酸。稀硝酸能溶解铁,若铁过量,则 生成 Fe(NO3 )2;若 HNO3 过量,则生成Fe(NO3 )3。 铁能从非氧化性酸中置换出氢气,也能被浓碱 溶液所侵蚀,在潮湿空气中生成铁锈。钴和镍 在大多数无机酸中缓慢溶解,但在碱性溶液中 稳定性较高

二、铁的重要化合物 (一)氧化物和氢氧化物 铁的氧化物有氧化亚铁、四氧化三铁和氧化 铁o FO是碱性氧化物,溶于酸形成铁(Ⅱ)盐。 Fe2O3是两性氧化物,但碱性强于酸性。在 低温下制得的FO3易溶于强酸生成铁()盐; 在600℃以上制得的F03则不易溶于强酸,但 能与碳酸钠共熔生成铁(Ⅲ)酸盐: Fe,O3+Na,CO;=2NaFeO2 +CO2 Fe203及其水合物具有多种颜色,可用作颜料
无机化学 二、铁的重要化合物 (一) 氧化物和氢氧化物 铁的氧化物有氧化亚铁、四氧化三铁和氧化 铁。 FeO 是碱性氧化物,溶于酸形成铁(Ⅱ)盐。 Fe2O3 是两性氧化物,但碱性强于酸性。在 低温下制得的Fe2O3 易溶于强酸生成铁(Ⅲ)盐; 在 600 ℃以上制得的 Fe2O3 则不易溶于强酸,但 能与碳酸钠共熔生成铁(Ⅲ)酸盐: Fe O Na CO 2NaFeO CO 2 3 2 3 2 2 + + ↑ Fe2O3 及其水合物具有多种颜色,可用作颜料

Fe304是黑色、具有滋性的物质。铁丝在氧气 中燃烧生成Fe3O4o粉末状Fe3O4常作为颜料,称 为“铁黑”。Fe3O4可认为是Fe2O3与FeO的混合 物或铁(IⅢ)酸铁(IⅡ)Fe(FeO2)2 铁的氢氧化物有Fe(OH2和Fe(OH3,它们都 是难溶于水的弱碱。在亚铁盐、铁盐溶液中加入碱 时,有相应的氢氧化物沉淀生成。 氢氧化铁实际上是含水量不定的水合氧化铁
无机化学 Fe3O4 是黑色、具有磁性的物质。铁丝在氧气 中燃烧生成 Fe3O4。粉末状 Fe3O4 常作为颜料,称 为“铁黑”。Fe3O4 可认为是 Fe2O3 与 FeO 的混合 物或铁(Ⅲ)酸铁(Ⅱ)Fe(FeO2 )2。 铁的氢氧化物有 Fe(OH)2 和 Fe(OH)3,它们都 是难溶于水的弱碱。在亚铁盐、铁盐溶液中加入碱 时,有相应的氢氧化物沉淀生成。 氢氧化铁实际上是含水量不定的水合氧化铁

(二)盐类 铁(Ⅱ)和铁(Ⅲ)的硝酸盐、硫酸盐、氯化物和 高氯酸盐等都易溶于水,并且在水中发生微弱的水 解使溶液显酸性。它们的碳酸盐、磷酸盐、硫化物 等弱酸盐都难溶于水。 铁(I)和铁(I)的可溶性盐从溶液中析出时, 常带有结晶水。铁(Ⅱ)盐一般为浅绿色,而铁(Ⅲ) 盐一般为红棕色。 1.硫酸亚铁 将铁屑与稀硫酸反应生成硫酸亚铁,从溶液中 结晶出来的是绿色的七水合硫酸亚铁,俗称绿矾。 绿矾加热失水得到白色的无水硫酸亚铁,加强热则 发生分解: 2Fes0,△Fe,0,+S0,t+S0,↑
无机化学 (二) 盐类 铁(Ⅱ)和铁(Ⅲ)的硝酸盐、硫酸盐、氯化物和 高氯酸盐等都易溶于水,并且在水中发生微弱的水 解使溶液显酸性。它们的碳酸盐、磷酸盐、硫化物 等弱酸盐都难溶于水。 铁(Ⅱ)和铁(Ⅲ)的可溶性盐从溶液中析出时, 常带有结晶水。铁(Ⅱ)盐一般为浅绿色,而铁(Ⅲ) 盐一般为红棕色。 1. 硫酸亚铁 将铁屑与稀硫酸反应生成硫酸亚铁,从溶液中 结晶出来的是绿色的七水合硫酸亚铁,俗称绿矾。 绿矾加热失水得到白色的无水硫酸亚铁,加强热则 发生分解: 4 2 3 2 3 2FeSO Fe O + SO + SO △ ↑ ↑