
第十三章p区元素(一) 第一节 p区元素概述 第二节 硼族元素 第三节 碳族元素 第四节 氨族元素
第十三章 p 区元素 (一) 第一节 p 区元素概述 第二节 硼族元素 第三节 碳族元素 第四节 氮族元素

第一节刀区元素概述 p区元秦包括第13~18族元素,p区元素沿 B一Si一AS一TC一At对角线分为两部分,对角线右 上角的元素(含对角线上的元素)为非金属元素, 对角线左下角的元素为金属元素。 在同一族中,卩区元素的原子半径自上而下 逐渐增大,元素的非金属性逐渐减弱,金属性逐 渐增强。同一族区元素中,第一个元素的原子 半径最小,电负性最大,与同族其他元素相比, 化学性质有较大的差异
第一节 p 区元素概述 p 区元素包括第 13 ~ 18 族元素,p 区元素沿 B─Si─As─Te─At 对角线分为两部分,对角线右 上角的元素(含对角线上的元素)为非金属元素, 对角线左下角的元素为金属元素。 在同一族中,p 区元素的原子半径自上而下 逐渐增大,元素的非金属性逐渐减弱,金属性逐 渐增强。同一族 p区元素中,第一个元素的原子 半径最小,电负性最大,与同族其他元素相比, 化学性质有较大的差异

p区元素的价层电子组态为s2如16,大多 数都有多种氧化值。第13~15族元素的较低正氧 化值化合物的稳定性,在同一族中大致随原子序 数的增加而增强,但最高氧化值化合物的稳定性 则随原子序数的增加而减弱。同一族元素这种自 上而下随原子序数的增加低氧化值化合物比高氧 化值化合物稳定的现象,称为惰性电子对效应。 第14族外层S轨道中的一对电子越不容易参与 成键,因此高氧化值化合物容易获得两个电子而 形成S2电子组态。惰性电子对效应也存在于第 13族和第15族元素中
无机化学 p 区元素的价层电子组态为 ns 2np 1~6,大多 数都有多种氧化值。第 13~15 族元素的较低正氧 化值化合物的稳定性,在同一族中大致随原子序 数的增加而增强,但最高氧化值化合物的稳定性 则随原子序数的增加而减弱。同一族元素这种自 上而下随原子序数的增加低氧化值化合物比高氧 化值化合物稳定的现象,称为惰性电子对效应。 第14 族外层 ns 轨道中的一对电子越不容易参与 成键,因此高氧化值化合物容易获得两个电子而 形成 ns 2 电子组态。惰性电子对效应也存在于第 13 族和第 15 族元素中

p区元素的电负性较大,在许多化合物中以 共价键结合。除In和Tl外,p区元素形成的氢化 物都是共价型的,较重元素形成的氢化物不稳定。 在卩区元素中,第二周期元素也表现出反常 性,氨、氧、氟的单键键能分别小于第三周期元 素鳞、硫、氯的单键键能,与通常情况下单键键 能在同一族中自上而下依次递减的规律不符。造 成这一反常现象的原因,是由于N、O、F的原子 半径小,成键时两个原子间距离较近,原子中未 成键的电子间有比较明显的排斥作用,从而削弱 了共价单键的键能
无机化学 p 区元素的电负性较大,在许多化合物中以 共价键结合。除In 和Tl外,p区元素形成的氢化 物都是共价型的,较重元素形成的氢化物不稳定。 在 p 区元素中,第二周期元素也表现出反常 性,氮、氧、氟的单键键能分别小于第三周期元 素磷、硫、氯的单键键能,与通常情况下单键键 能在同一族中自上而下依次递减的规律不符。造 成这一反常现象的原因,是由于 N、O、F的原子 半径小,成键时两个原子间距离较近,原子中未 成键的电子间有比较明显的排斥作用,从而削弱 了共价单键的键能

第二周期p区元素的原子最外层只有2S和2p 轨道,其配位数一般不超过4。而其他周期卩区元 素的原子层有d轨道,可以形成更高配位数的化合 物。 从第四周期起,在S区元素和卩区元素之间插 入了d区和ds区元素,使第四周期p区元素的有 效核电荷显著增大,原子半径比同周期的$区元素 显著减小。因此,第四周期p区元素的性质在同族 中也显得比较特殊,表现异样性。 在第五周期和第六周期的卩区元素之前,也排 列着d区和ds区元素(第六周期前还排列着f区元 素),它们对这两个周期的元素也有类似的影响,使 各族第四、五、六周期三种元素性质又出现了同族 元素性质的递变情况,但远不如S区元素那样有规 律
无机化学 第二周期 p 区元素的原子最外层只有2s 和2p 轨道,其配位数一般不超过 4 。而其他周期 p 区元 素的原子层有d 轨道,可以形成更高配位数的化合 物。 从第四周期起,在 s 区元素和 p 区元素之间插 入了 d 区和 ds 区元素,使第四周期 p 区元素的有 效核电荷显著增大,原子半径比同周期的 s 区元素 显著减小。因此,第四周期p 区元素的性质在同族 中也显得比较特殊,表现异样性。 在第五周期和第六周期的 p 区元素之前,也排 列着 d 区和 ds 区元素 (第六周期前还排列着 f 区元 素),它们对这两个周期的元素也有类似的影响,使 各族第四、五、六周期三种元素性质又出现了同族 元素性质的递变情况,但远不如 s 区元素那样有规 律

第六周期刀区元素受镧系收缩的影响,与第 五周期同族元素的性质比较接近。第五周期元素 的原子半径与第六周期元素的离子半径相差不太 大,而第四周期元素的原子半径与第五周期同族 元素的原子半径相差较大。 合
无机化学 第六周期 p 区元素受镧系收缩的影响,与第 五周期同族元素的性质比较接近。第五周期元素 的原子半径与第六周期元素的离子半径相差不太 大,而第四周期元素的原子半径与第五周期同族 元素的原子半径相差较大

p区元素的性质具有以下特征: (1)第二周期元素具有反常性质; (2) 第四周期元素表现出异样性; (3) 各族第四、五、六周期三种元素性质缓慢地 递变; (4) 各族第五、六周期两种元素性质有些相似
无机化学 p 区元素的性质具有以下特征: (1) 第二周期元素具有反常性质; (2) 第四周期元素表现出异样性; (3) 各族第四、五、六周期三种元素性质缓慢地 递变; (4) 各族第五、六周期两种元素性质有些相似

第二节硼族元素 一、硼族元素概述 二、 硼族元素的单质 三、 硼的化合物 四、铝的化合物 a
第二节 硼族元素 一、硼族元素概述 二、硼族元素的单质 三、硼的化合物 四、铝的化合物 Ga

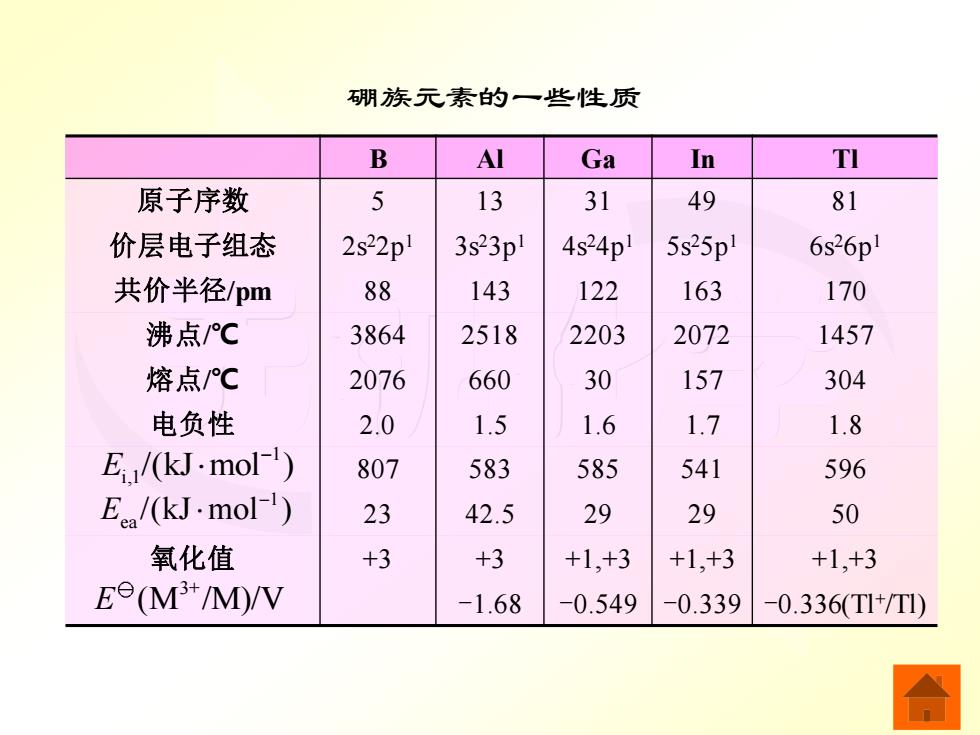
一、硼族元素概述 硼族元素包括硼、铝、镓、铟、铊五种元素。 铝在地壳中的含量仅次于氧和硅,其丰度(以质量 计)在所有元素中居第三位,而在金属元素中铝的 丰度居于首位。硼和铝有富集矿藏,而镓、铟、铊 是分散的稀有元素,常与其他矿物共生。 5B10.81 134126.98 31Ga69.72 49n114.8 81T1204.3 2s22pl 3s23p 4s24pl 5s25pl 6s26pl +3 +3 (+1),+3 +1,+3 +1,(+3)
无机化学 一、硼族元素概述 硼族元素包括硼、铝、镓、铟、铊五种元素。 铝在地壳中的含量仅次于氧和硅,其丰度(以质量 计)在所有元素中居第三位,而在金属元素中铝的 丰度居于首位。硼和铝有富集矿藏,而镓、铟、铊 是分散的稀有元素,常与其他矿物共生
硼族元素的一些性质 B Al Ga n ti 原子序数 5 13 31 49 81 价层电子组态 2s22pl 3s23p1 4s24p1 5s25p' 6s26p1 共价半径pm 88 143 122 163 170 沸点/℃ 3864 2518 2203 2072 1457 熔点℃ 2076 660 30 157 304 电负性 2.0 1.5 1.6 1.7 1.8 E/(kJ·mol) 807 583 585 541 596 E/(kJ.mol-) 23 42.5 29 29 50 氧化值 +3 +3 +1,+3 +1,+3 +1,+3 E9(M3+/M①0/V -1.68 -0.549 -0.339 0.336(T1+/T1)
无机化学 硼族元素的一些性质 B Al Ga In Tl 原子序数 5 13 31 49 81 价层电子组态 2s22p1 3s23p1 4s24p1 5s25p1 6s26p1 共价半径/pm 88 143 122 163 170 沸点/℃ 3864 2518 2203 2072 1457 熔点/℃ 2076 660 30 157 304 电负性 2.0 1.5 1.6 1.7 1.8 807 583 585 541 596 23 42.5 29 29 50 氧化值 +3 +3 +1,+3 +1,+3 +1,+3 -1.68 -0.549 -0.339 -0.336(Tl+ /Tl) 3+ E (M /M)/V1 i,1 E /(kJ mol ) − 1 ea E /(kJ mol ) −