
第十四章p区元素(二) 第一节氧族元素 第二节 卤族元素 第三节 稀有气体
第十四章 p 区元素(二) 第一节 氧族元素 第二节 卤族元素 第三节 稀有气体

第一节氧族元素 第16族元素也称氧族元素,由氧、硫、硒、 碲和钋五种元素组成。氧和硫元素是典型的非金属 元素,硒和啼元素是准金属元素,钋元素是放射性 金属元素
第一节 氧族元素 第 16 族元素也称氧族元素,由氧、硫、硒、 碲和钋五种元素组成。氧和硫元素是典型的非金属 元素,硒和碲元素是准金属元素,钋元素是放射性 金属元素

氧是地壳中分布最广的元素,其丰度居各种元 素之首。氧广泛分布在大气和海洋中,在海洋中主 要以水的形式存在:在大气层中,氧以单质状态存 在0 硫在自然界中的含量较少,主要以硫化物和硫 酸盐的形式存在。 硒和碲属于分散稀有元素,常以硒化物和碲化 物的形式存在于各种硫化物矿中
无机化学 氧是地壳中分布最广的元素,其丰度居各种元 素之首。氧广泛分布在大气和海洋中,在海洋中主 要以水的形式存在;在大气层中,氧以单质状态存 在。 硫在自然界中的含量较少,主要以硫化物和硫 酸盐的形式存在。 硒和碲属于分散稀有元素,常以硒化物和碲化 物的形式存在于各种硫化物矿中
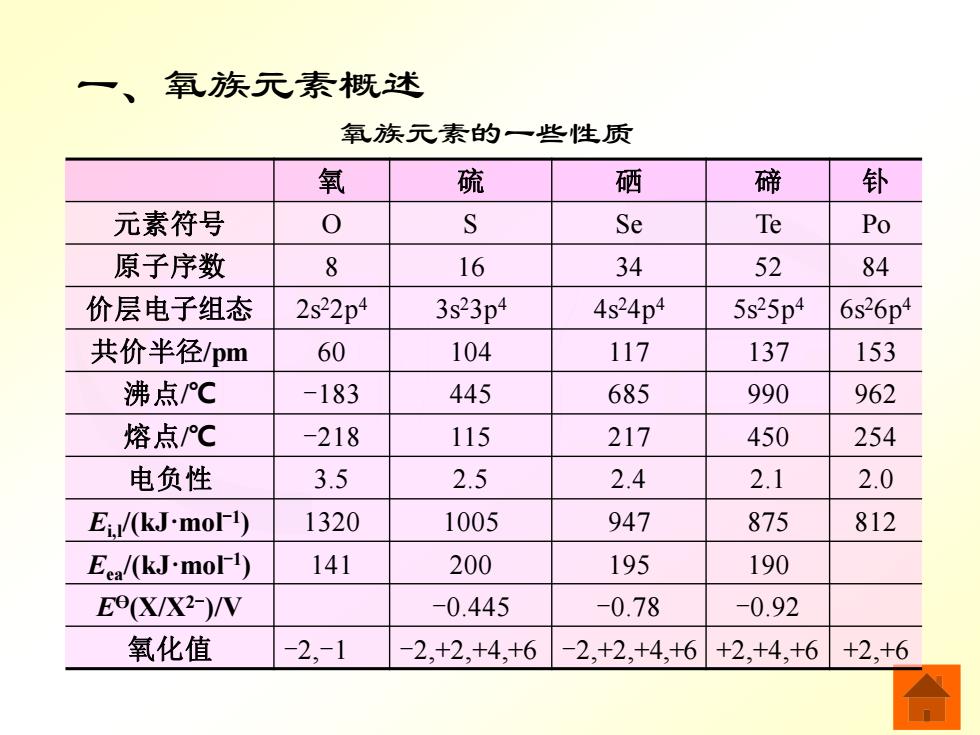
一、氧族元素概述 氧族元素的一些性质 氧 硫 硒 碲 钋 元素符号 0 S Se Te Po 原子序数 P 16 34 52 84 价层电子组态 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4 共价半径/pm 60 104 117 137 153 沸点℃ -183 445 685 990 962 熔点℃ -218 115 217 450 254 电负性 3.5 2.5 2.4 2.1 2.0 Ei/(kJ-mol-1) 1320 1005 947 875 812 Ea/(kJ-mol1) 141 200 195 190 E0X/X2-)/W -0.445 -0.78 -0.92 氧化值 -2,-1 -2.+2.+4.+6-2,+2,+4,+6 +2,+4,+6 +2,+6
无机化学 一、氧族元素概述 氧族元素的一些性质 氧 硫 硒 碲 钋 元素符号 O S Se Te Po 原子序数 8 16 34 52 84 价层电子组态 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4 共价半径/pm 60 104 117 137 153 沸点/℃ -183 445 685 990 962 熔点/℃ -218 115 217 450 254 电负性 3.5 2.5 2.4 2.1 2.0 Ei,l/(kJ·mol-1 ) 1320 1005 947 875 812 Eea/(kJ·mol-1 ) 141 200 195 190 EӨ(X/X2- )/V -0.445 -0.78 -0.92 氧化值 -2,-1 -2,+2,+4,+6 -2,+2,+4,+6 +2,+4,+6 +2,+6

从氧到钋随着原子序数的增大,元素的原子 半径依次增大,元素的电负性、电离能和电子亲 和能依次减小,元素的非金属性依次减弱,金属 性逐渐增强。 氧族元素的价电子层组态为nsnp4,有夺取 或共用两个电子达到稀有气体原子电子层组态的 倾向,表现出较强的非金属性。 氧元素的电负性很大,仅次于氟元素,因此 氧元素在大多数含氧化合物中的氧化值为一2。 硫、硒、碲的价电子层中均有空d轨道,当 与电负性比较大的元素化合时,空d轨道也可以 成键,这些元素的氧化值可呈现十2、十4、+6。 氧族元素具有较强的配位能力,O和S是常 见的配位原子
无机化学 从氧到钋随着原子序数的增大,元素的原子 半径依次增大,元素的电负性、电离能和电子亲 和能依次减小,元素的非金属性依次减弱,金属 性逐渐增强。 氧族元素的价电子层组态为 ns 2np 4,有夺取 或共用两个电子达到稀有气体原子电子层组态的 倾向,表现出较强的非金属性。 氧元素的电负性很大,仅次于氟元素,因此 氧元素在大多数含氧化合物中的氧化值为-2。 硫、硒、碲的价电子层中均有空 d 轨道,当 与电负性比较大的元素化合时,空 d 轨道也可以 成键,这些元素的氧化值可呈现 +2、+4、+6。 氧族元素具有较强的配位能力,O 和 S 是常 见的配位原子
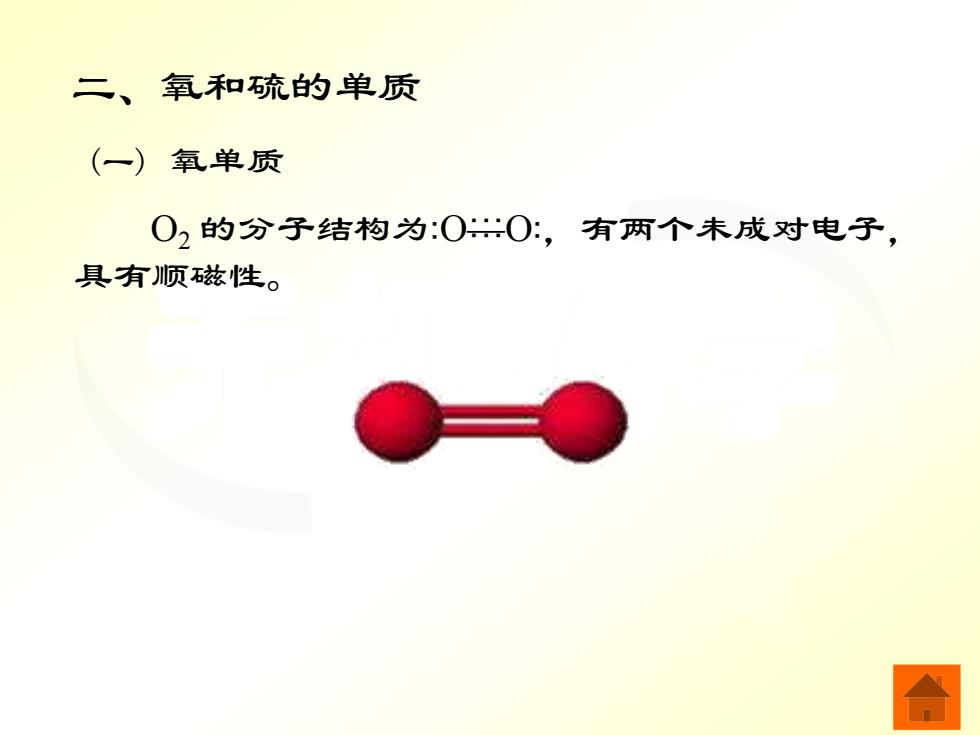
二、氧和硫的单质 (一) 氧单质 02的分子结构为:00:,有两个未成对电子, 具有顺兹性
无机化学 二、氧和硫的单质 (一) 氧单质 O2 的分子结构为 O—O ,有两个未成对电子, 具有顺磁性。 ······ ·· ··

02是无色、无味的气体,在90K时凝聚为蓝 色液体,冷却到54K时,疑结为蓝色的固体。02 在水中的溶解度很小,293K、101.03kPa下,1L 水约溶解30mL020 O,最主要的化学性质是氧化性。O,几乎能与 除稀有气体和极少数金属元素以外的所有元素直接 或间接地化合,但多数氧化反应在常温下反应速率 较慢,需要在高温条件下进行
无机化学 O2 是无色、无味的气体,在 90 K 时凝聚为蓝 色液体,冷却到 54 K 时,凝结为蓝色的固体。O2 在水中的溶解度很小,293 K、101.03 kPa 下,1 L 水约溶解 30 mL O2。 O2 最主要的化学性质是氧化性。O2 几乎能与 除稀有气体和极少数金属元素以外的所有元素直接 或间接地化合,但多数氧化反应在常温下反应速率 较慢,需要在高温条件下进行
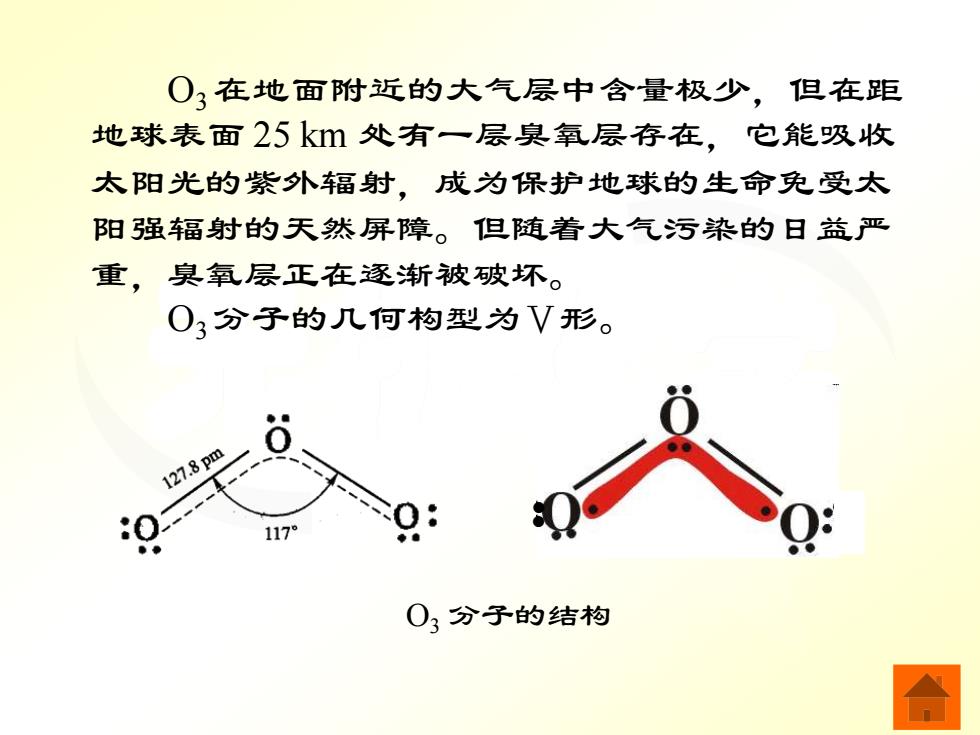
O3在地面附近的大气层中含量极少,但在距 地球表面25k处有一层臭氧层存在,它能吸收 太阳光的紫外辐射,成为保护地球的生命免受太 阳强辐射的天然屏障。但随着大气污染的日益严 重,臭氧层正在逐渐被破坏。 O3分子的几何构型为V形。 127.8pm 117 03分子的结构
无机化学 O3 在地面附近的大气层中含量极少,但在距 地球表面 25 km 处有一层臭氧层存在,它能吸收 太阳光的紫外辐射,成为保护地球的生命免受太 阳强辐射的天然屏障。但随着大气污染的日益严 重,臭氧层正在逐渐被破坏。 O3 分子的几何构型为Ⅴ形。 O3 分子的结构 • •

O3的氧化性比O,强。 常用○3氧化烯烃的反应确定烯烃中双键的位 置。 利用03的氧化性及不容易导致二次污染这一 优点,可用○3消毒饮用水,其优点是杀菌快,且 消毒后无异味
无机化学 O3 的氧化性比 O2 强。 常用 O3 氧化烯烃的反应确定烯烃中双键的位 置。 利用 O3 的氧化性及不容易导致二次污染这一 优点,可用 O3 消毒饮用水,其优点是杀菌快,且 消毒后无异味

(二) 硫单质 单质硫是分子晶体,很松脆,不溶于水。疏的导 电性和导热性很差。单质硫有多种同素异形体,最常 见的两种同素异形体是斜方硫和单斜硫。 斜方硫为黄色晶体,密度为2.06gcm3,熔点为 385.8K。单斜硫为浅黄色晶体,密度为1.96gc3, 熔点为392K。将单斜硫加热到368.6K时转变为斜方 硫。 斜方硫 单斜硫
无机化学 (二) 硫单质 单质硫是分子晶体,很松脆,不溶于水。硫的导 电性和导热性很差。单质硫有多种同素异形体,最常 见的两种同素异形体是斜方硫和单斜硫。 斜方硫为黄色晶体,密度为 2.06 g·cm-3,熔点为 385.8 K。单斜硫为浅黄色晶体,密度为1.96 g·cm-3 , 熔点为 392 K。将单斜硫加热到 368.6 K时转变为斜方 硫。 斜方硫 单斜硫