
第十四章氮族元素 §14-1氮族元素的通性 。§14-2氮和它的化合物 §14-3磷和它的化合物 。§14-4As、Sb、Bi及其化合物
第十四章 氮族元素 ⚫§14-1 氮族元素的通性 ⚫§14-2 氮和它的化合物 ⚫§14-3磷和它的化合物 ⚫§14-4 As、Sb、Bi及其化合物

§14-1氮族元素的通性 。一、特征电子结构和各主要价态 ●ns2np3主要氧化态: N:-3,-2, -1, NH3,N2H4,H2NOH, +1,+2, +3,+4, +5 N2O,NO, N2O3,NO2, N205 HNO2,N204,HNO;
§14-1 氮族元素的通性 ⚫ 一、特征电子结构和各主要价态 ⚫ ns2np3 主要氧化态: N: -3, -2, -1, NH3,N2H4,H2NOH , +1,+2, +3, +4, +5 N2O,NO, N2O3, NO2, N2O5 HNO2 , N2O4, HNO3
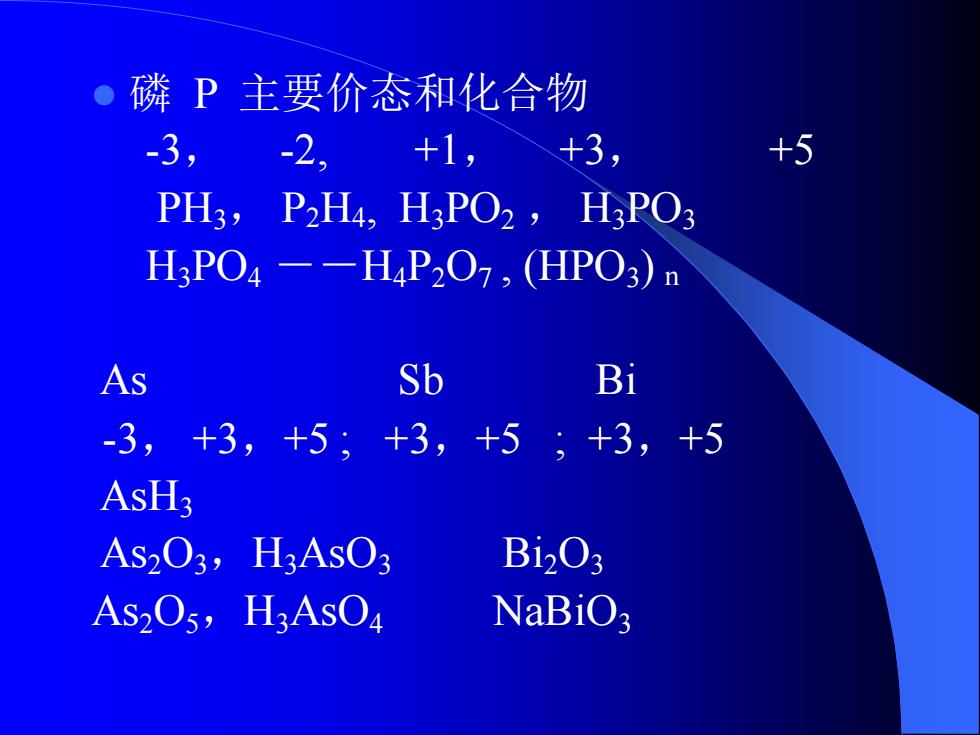
0 磷P主要价态和化合物 -3,-2,+1, +3, +5 PH3,P2H4,H3PO2, HPO3 H3PO4-H4P207,(HPO3)n As Sb Bi -3,+3,+5;+3,+5;+3,+5 AsH3 As2O3,H3AsO3 B1203 As2O5,H3AsO4 NaBiO;
⚫ 磷 P 主要价态和化合物 -3, -2, +1, +3, +5 PH3, P2H4, H3PO2 , H3PO3 H3PO4 --H4P2O7 , (HPO3) n As Sb Bi -3, +3,+5 ; +3,+5 ; +3,+5 AsH3 As2O3,H3AsO3 Bi2O3 As2O5,H3AsO4 NaBiO3

。二、氧化还原性 最高价态的氧化性 p°AHNO3 0.94 HNO, HPO -0.27 H,PO, H3ASO +0.56 HAsO; Sb,Os +0.58 SbO+ Bi,0s+1.6 BiO+ 0°B NO30.1 _N02 PO3-112HP0,2
⚫ 二、氧化还原性 最高价态的氧化性 A HNO3__0.94__HNO2 H3 PO4__﹣0.27__H3 PO3 H3AsO4__+0.56__H3AsO3 Sb2O5__+0.58__SbO+ Bi2O5__+1.6__BiO+ B NO3 -__0.1__NO2 - PO4 3-__﹣1.12__HPO3 2-

。+3价,中间价态的氧化性 HNO20.996 NO 1.59NO 1.29 HASO, +0.25 As SbO+ +0.15 Sb BiO+ +0.32 Bi 其中非金属的中间价比最高价氧化性 更强
⚫ +3价,中间价态的氧化性 HNO2_0.996_NO_1.59_N2O ︱_____1.29____∣ HAsO2__+0.25__As SbO+ __+0.15__Sb BiO+__+0.32__Bi 其中非金属的中间价比最高价氧化性 更强

§14-2氮和它的化合物 一、成键特征 -N-SP3 NH3 N=sp2-N=0 N∈ sp N=N-C=N
§14-2 氮和它的化合物 一、成键特征 -N- sp3 NH3 —N= sp2 —N=O N≡ sp N≡N -C≡N

二、单质N 1、NN性质 分子轨道:0s2os 62 262 *2 2Pyz O22Π2z'2N 键级=3 键能941.7 kJmol- ① 非常稳定,与较活泼的金属才能燃烧 结合,如LiN Mg:N2 N2+3H2→2NH3 生物固氨酶
二、单质N2 1、N≡N 性质 分子轨道: 1s 2 1s *2 2s 2 2s *2 ∏2Pyz 4 2px 2 ∏2Pyz * 2Px * 键级=3 键能941.7kJ·mol﹣1 ① 非常稳定,与较活泼的金属才能燃烧 结合, 如Li3N Mg3N2 ② N2+3H2→2NH3 ③ 生物固氮酶

2、氮气实验室制备 i)NH,NO2(aq)→N2+2H,0(加热) NHCI (aq)+NaNO2 (aq)NHNO2 ii)(NH)2Cr207 (s)-N2+Cr203+4H2O i)NH+Br2→NIH,Br+N2 iv)NH,tCuO→Cu+N2 它们的共同反应物均用氨为还原剂
2、氮气实验室制备 ⅰ)NH4NO2(aq)→N2+2H2O (加热) NH4Cl(aq)+NaNO2(aq)→NH4NO2 ⅱ)(NH4)2Cr2O7(s)→N2+Cr2O3+ 4H2O ⅲ)NH3+Br2→NH4Br+N2 ⅳ)NH3+CuO→Cu+N2 它们的共同反应物均用氨为还原剂

三、氮化合物性质 1、氢化物NH 高温可被CuO氧化,常温需Cl2,Br,等氧化 氨解反应: COCI2+4NH3-CO (NH2)2+2NHCI SOC12+4NH3SO (NH2)2+NH CI HgCl2+2NH3→Hg(NH2)Cl↓+NHCI 氨解类似卤化物水解 NH+2(HgL4)2-+4OH°→(Hg0 (NH,))I(s)+7I-+3HO
三、氮化合物性质 1、氢化物 NH3 高温可被CuO氧化,常温需Cl2,Br2等氧化 氨解反应: COCl2+4NH3→CO(NH2)2+2NH4Cl SOCl2+4NH3→SO(NH2)2+NH4Cl HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl 氨解类似卤化物水解 NH4 ++2〔HgI4〕2﹣+4OH﹣→〔Hg2O (NH2)〕I(s)+7I﹣+3H2O

N,H4:熔沸点略比HO高,是一种还原剂,可 作双齿配体 N2H4(1)+O2(g)-→N2(g+2H0(1) △H°=-621.74 KJ.mol-1 C0+0.5O2→CO2△H°=-283 KJ-mol H2+0.502→H20(g)△H°=-241.8 kJ:mol N2H4(1)+2H2O2(1)→N2(g)+4H20(g) △H=-642.2KJmo1-1 N2H是一种高能燃料
N2H4:熔沸点略比H2O高,是一种还原剂,可 作双齿配体 N2H4(l)+O2(g)→N2(g)+2H2O(l) △H=﹣621.74 KJ·mol﹣1 CO+0.5O2→CO2 △H=﹣283 KJ·mol﹣1 H2+0.5O2→H2O(g)△H=﹣241.8 kJ·mol﹣1 N2H4(l)+2H2O2(l)→N2(g)+4H2O(g) △H=﹣642.2 KJ·mol﹣1 ∴N2H4是一种高能燃料