
第八章: 表面化学和胶体化学
第八章 表面化学和胶体化学

§1引言 一、几个概念 表面化学:研究物质相界面上发生的现象的规律 1.界面和表面 界面(interface):密切接触的两相间的过渡区, 约10-9一10-8m,有几个分子层厚。 五类界面:气(g)-液),气(g)-固(s), 液①-固S),液41)-液(2),固s)-固(s2) 表面(surface)?: 若其中的一相为气相(习惯)。如lg,$-g
§1 引 言 一、几个概念 表面化学:研究物质相界面上发生的现象的规律。 1. 界面和表面 界面(interface):密切接触的两相间的过渡区, 约10-9—10 -8m, 有几个分子层厚。 五类界面:气(g)-液(l),气(g)- 固(s), 液(l)- 固(s) ,液(l1 )-液(l2 ) ,固(s1 )- 固(s2 ) 表面(surface): 若其中的一相为气相(习惯)。如l-g,s-g

2.界面现象和表面现象: 在相的界面上发生的行为 。 如: 露珠为球形 微小液滴易蒸发 水在毛细管中会自动上升 3.1 比表面A 单位(量纲):长度 A 或A。= 单位(量纲):面积·质量1 m 6×126 如:有边长为的立方体,4。 60 分割成边长为0 的小立方体,A,'=10A= 1
2. 界面现象和表面现象: 在相的界面上发生的行为 。 如: 露珠为球形 微小液滴易蒸发 水在毛细管中会自动上升 3. 比表面A0 单位(量纲):长度-1 V A A0 = m A 或 Ao = 单位(量纲):面积·质量-1 例如:有边长为 的立方体, l l l A 6 6 3 2 0 = l = 分割成边长为 的小立方体, 10 l l A A 60 0 ' =10 0 =

可见:体系的分散程度越高,比表面积越大。 二、表面化学和胶体化学的关系 胶体: 粒子粒径在1nm一100nm间的高度分散的多 相体系。 胶体粒子的比表面积极大,表面效应极为显著
可见:体系的分散程度越高,比表面积越大。 二、表面化学和胶体化学的关系 胶体: 粒子粒径在1nm—100nm间的高度分散的多 相体系。 胶体粒子的比表面积极大,表面效应极为显著
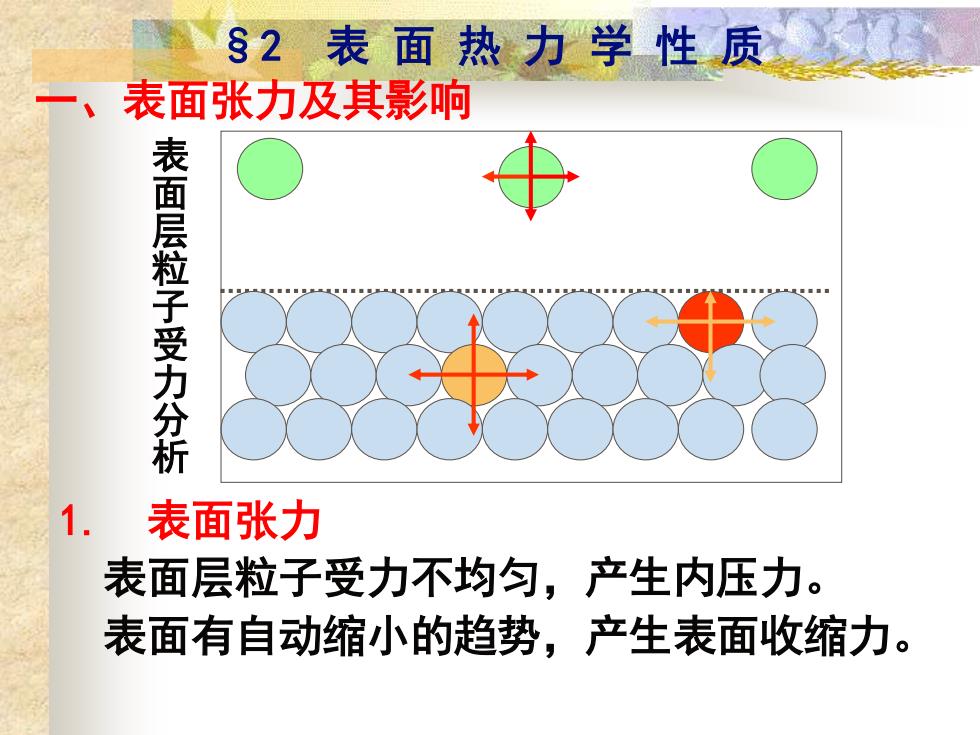
§2表面热力学性质 一、 表面张力及其影响 表面层粒子受力分析 1. 表面张力 表面层粒子受力不均匀,产生内压力。 表面有自动缩小的趋势,产生表面收缩力
§2 表 面 热 力 学 性 质 1. 表面张力 表面层粒子受力不均匀,产生内压力。 表面有自动缩小的趋势,产生表面收缩力。 表 面 层 粒 子 受 力 分 析 一、表面张力及其影响

例:记f=g(m+m),金属丝移动 到一定位置时,可以保持不再滑动 δW∝dA、=2ldx δW=odA=fx 21 6一表面张力
例:记 ,金属丝移动 到一定位置时,可以保持不再滑动 ( ) g m1 m2 f = + δW' dA fdx = s = δW' ∝ dA 2ldx s = l f 2 = ——表面张力 m2 l m1 σ f

表面张力:垂直作用于单位长度相界面上,与表 面平行(平面)或相切(曲面)的收 缩力。 力的方向:与液面相切,与单位线段垂直。 力的类型:表面收缩力。 力的单位量纲:Nm1 表面层分子受力不均匀→内压力◆表面张力 体系的一种强度性质,受到多种因素的影响
表面张力:垂直作用于单位长度相界面上,与表 面平行(平面)或相切(曲面)的收 缩力。 力的方向:与液面相切,与单位线段垂直。 力的类型:表面收缩力。 力的单位量纲:N·m -1 表面层分子受力不均匀 内压力 表面张力 体系的一种强度性质,受到多种因素的影响

2.影响表面张力的因素 ★与物质本性有关 分子间的作用力越大,。越大: 0金属键>·离子键>0极性键>0非极性键, ★与温度有关 一 般:温度升高,o↓;教材P54式 (11-3) 温度升高到临界温度T时,σ→0 ★与接触相的性质有关 (见教材P543表11-2) 接触相相同,0固体>¤液体 ★与压强有关 一般:压强升高,0↓;见教材P544图11-5 ★其它:分散度,运动情况等
σ金属键>σ离子键>σ极性键>σ非极性键, ★ 与压强有关 ★ 与温度有关 一般:温度升高,σ↓;教材P544 式(11-3) 温度升高到临界温度Tc时,σ→0 ★ 其它:分散度 ,运动情况等 ★ 与接触相的性质有关(见教材P543表11-2) 一般:压强升高,σ↓;见教材P544图11-5 2. 影响表面张力的因素 ★ 与物质本性有关 分子间的作用力越大,σ越大: 接触相相同, σ固体 > σ液体

二、比表面Gibbs自由能与表面Gibbs自由能 表面分子具有比内部分子高的能量 例如:一滴水(1克水),比表面积4o=4.85cm2g 表面能约为4.85X72.8×10-7=3.5×105J r=10-7cm小水滴,比表面积A0'=3.0×107cm2g1 表面能达到220J,是原有表面能的6.3×106倍。 恒T、P、恒组成、可逆过程,生成dA,新表面 需环境作功:dG,p=δW,=odAs
二、比表面Gibbs自由能与表面Gibbs自由能 恒T、P、恒组成、可逆过程,生成dAs新表面 需环境作功:dGT,p=δWr ’ =σdAs 表面分子具有比内部分子高的能量 例如:一滴水(1克水),比表面积A0=4.85cm2·g- 1 表面能约为4.85×72.8×10-7 = 3.5×10-5 J r =10-7cm小水滴,比表面积 A0 ’=3.0×107 cm2·g-1 表面能达到 220J,是原有表面能的6.3×106倍

积分:dGPw=oxA=以 得:W=Gp=oA=G则:O=G,A,=W,A, o:(比)表面Gibbs自由能,表面自由能。 也表示恒T,p,n:下,增加单位面积所必须 对体系作的非体积功,又称比表面功。 单位量纲:Jm2 J.m2=N.m'm-2 N.m-
d d ' r 0 s 0 , , , , s G A W G A T P n T P ni i = = 积分: 则:σ= Gs /As= Wr ’/As r , , s s W ' G A G T p ni 得: = = = σ:(比)表面Gibbs自由能,表面自由能。 也表示恒T,p,ni下,增加单位面积所必须 对体系作的非体积功,又称比表面功。 单位量纲:J·m-2 J·m-2 = N·m·m-2 = N·m-1