
第六章电化学 电化学是研究电能与化学能之间相互转化及其规律的科 学。 实现电能与化学能之间相互转化的装置是电解池和原电池,把 电能转变为化学能的装置称为电解池,而把化学能转变为电能 的装置则称为原电池。 本章的内容包括以下四个部分: 电解质溶液:导电及溶液中电解质的热力学性质 可逆电池热力学:在有非体积功的条件下化学反应的热力 学问题; 不可逆电极过程:非平衡条件下的电极过程: 电化学的应用
第六章 电化学 电化学是研究电能与化学能之间相互转化及其规律的科 学。 实现电能与化学能之间相互转化的装置是电解池和原电池,把 电能转变为化学能的装置称为电解池,而把化学能转变为电能 的装置则称为原电池。 本章的内容包括以下四个部分: 电解质溶液:导电及溶液中电解质的热力学性质 可逆电池热力学:在有非体积功的条件下化学反应的热力 学问题; 不可逆电极过程:非平衡条件下的电极过程; 电化学的应用

§6-1电解质溶液 电解质溶液是指溶质在溶剂剂中溶解后完全或部分离解成 离子的溶液,该溶质则称为电解质。在溶液中完全离解的电解 质,称为强电解质。在溶液中只有部分离解,即便在较稀的溶 液中都有未离解成离子的电解质,称为弱电解质。 1.电解质溶液的导电机理 导体分类: 第一类导体:如金属及其某些化和物,是由于电子在电场作 用下移动而传导电流,在导电过程中,导体本身不发生变化, 且温度升高,其导电能力下降。 第二类导体:如电解质溶液和熔融电解质,是由于正、负离 子在电场作用下定向移动而传导电流,第二类导体在传导电流 的同时在两极发生电极反应,且温度升高其导电能力增大
§6 -1 电解质溶液 电解质溶液是指溶质在溶剂剂中溶解后完全或部分离解成 离子的溶液,该溶质则称为电解质。在溶液中完全离解的电解 质,称为强电解质。在溶液中只有部分离解,即便在较稀的溶 液中都有未离解成离子的电解质,称为弱电解质。 1.电解质溶液的导电机理 导体分类: 第一类导体:如金属及其某些化和物,是由于电子在电场作 用下移动而传导电流,在导电过程中,导体本身不发生变化, 且温度升高,其导电能力下降。 第二类导体:如电解质溶液和熔融电解质,是由于正、负离 子在电场作用下定向移动而传导电流,第二类导体在传导电流 的同时在两极发生电极反应,且温度升高其导电能力增大
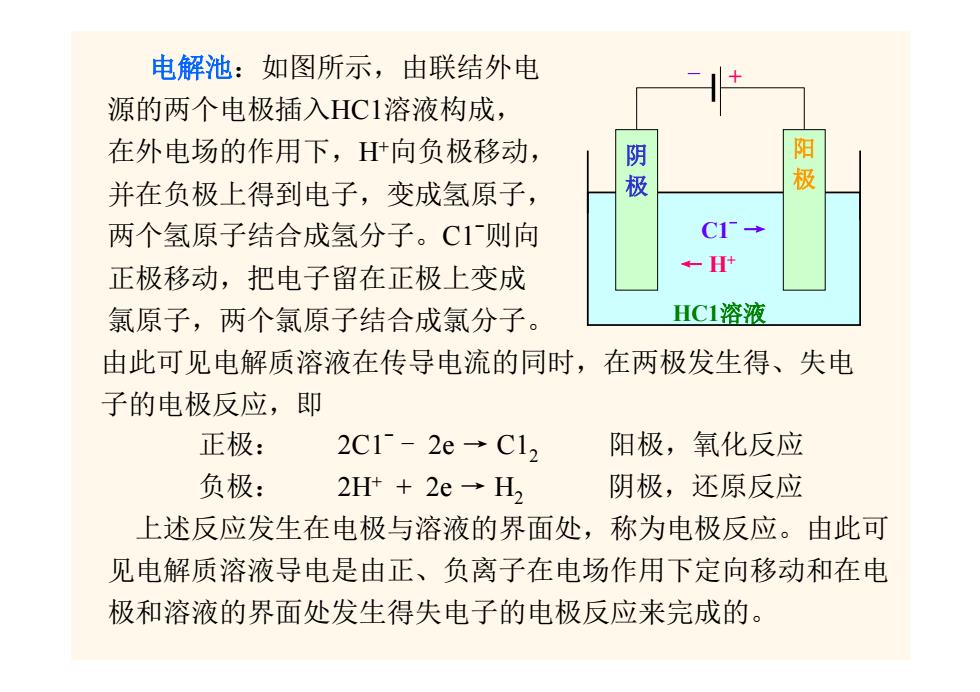
电解池:如图所示,由联结外电 源的两个电极插入HC1溶液构成, 在外电场的作用下,H+向负极移动, 现 阳 并在负极上得到电子,变成氢原子, 极 两个氢原子结合成氢分子。C1则向 C1→ 正极移动,把电子留在正极上变成 ←H 氯原子,两个氯原子结合成氯分子。 HC1溶液 由此可见电解质溶液在传导电流的同时,在两极发生得、失电 子的电极反应,即 正极: 2C1-2e→C1, 阳极,氧化反应 负极: 2Ht+2e→H2 阴极,还原反应 上述反应发生在电极与溶液的界面处,称为电极反应。由此可 见电解质溶液导电是由正、负离子在电场作用下定向移动和在电 极和溶液的界面处发生得失电子的电极反应来完成的
电解池:如图所示,由联结外电 源的两个电极插入HC1溶液构成, 在外电场的作用下,H+向负极移动, 并在负极上得到电子,变成氢原子, 两个氢原子结合成氢分子。C1-则向 正极移动,把电子留在正极上变成 氯原子,两个氯原子结合成氯分子。 由此可见电解质溶液在传导电流的同时,在两极发生得、失电 子的电极反应,即 正极: 2C1- - 2e → C12 阳极,氧化反应 负极: 2H+ + 2e → H2 阴极,还原反应 上述反应发生在电极与溶液的界面处,称为电极反应。由此可 见电解质溶液导电是由正、负离子在电场作用下定向移动和在电 极和溶液的界面处发生得失电子的电极反应来完成的。 HC1溶液 C1- → ← H+ - + 阴 极 阳 极
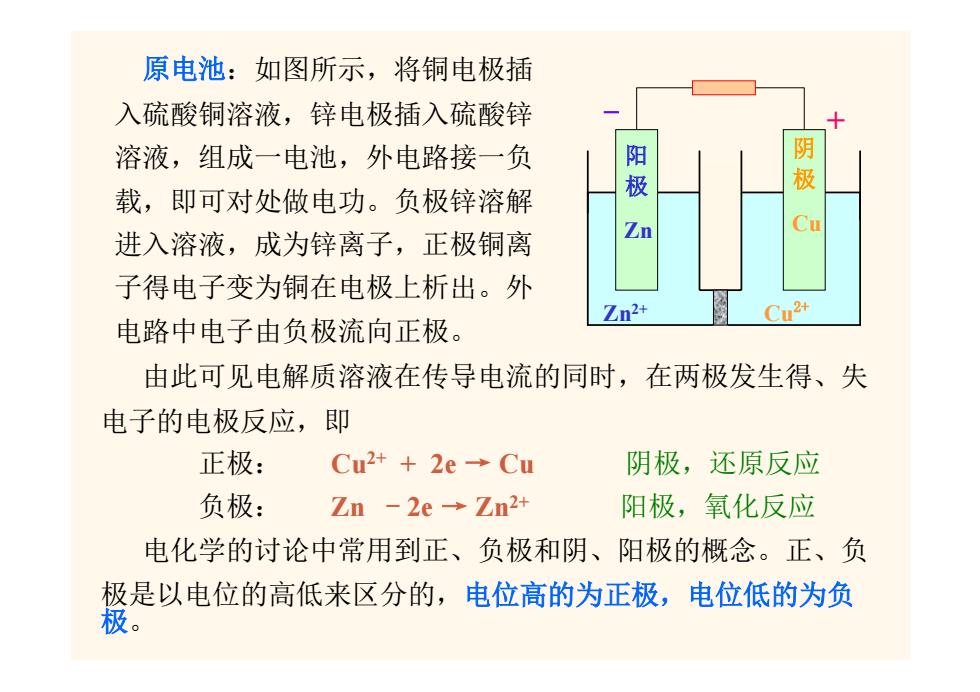
原电池:如图所示,将铜电极插 入硫酸铜溶液,锌电极插入硫酸锌 溶液,组成一电池,外电路接一负 阳极 阴 极 载,即可对处做电功。负极锌溶解 进入溶液,成为锌离子,正极铜离 子得电子变为铜在电极上析出。外 Zn2+ Cu2+ 电路中电子由负极流向正极。 由此可见电解质溶液在传导电流的同时,在两极发生得、失 电子的电极反应,即 正极: Cu2++2e→Cu 阴极,还原反应 负极: Zn-2e→Zn2+ 阳极,氧化反应 电化学的讨论中常用到正、负极和阴、阳极的概念。正、负 极是以电位的高低来区分的,电位高的为正极,电位低的为负
原电池:如图所示, 由此可见电解质溶液在传导电流的同时,在两极发生得、失 电子的电极反应,即 正极: Cu2+ + 2e → Cu 阴极,还原反应 负极: Zn - 2e → Zn2+ 阳极,氧化反应 电化学的讨论中常用到正、负极和阴、阳极的概念。正、负 极是以电位的高低来区分的,电位高的为正极,电位低的为负 极。 Cu2+ Zn2+ + 阳 极 阴 极 - Zn Cu 将铜电极插 入硫酸铜溶液,锌电极插入硫酸锌 溶液,组成一电池,外电路接一负 载,即可对处做电功。负极锌溶解 进入溶液,成为锌离子,正极铜离 子得电子变为铜在电极上析出。外 电路中电子由负极流向正极

而阴、阳极则是以电极反应来区分的,发生氧化反应(失 去电子的反应)的电极称为阳极,发生还原反应(得到电子的 反应)的电极称为阴极。 在电解池中正极发生氧化反应,正极是阳极,负极发生还 原反应,负极是阴极。以后将会看到,在原电池中正极发生还 原反应,正极是阴极,负极发生氧化反应,负极是阳极。 2.法拉第定律 法拉第(Faraday)在总结大量实验结果的基础上于l833年提出 了著名的法拉第定律,该定律内容如下: 1)在电极上发生电极反应的物质的量与通过溶液的电量成 正比。 2)对于串联电解池,每一个电解池的每一个电极上发生电 极反应的物质的量相等
而阴、阳极则是以电极反应来区分的,发生氧化反应(失 去电子的反应)的电极称为阳极,发生还原反应(得到电子的 反应)的电极称为阴极。 在电解池中正极发生氧化反应,正极是阳极,负极发生还 原反应,负极是阴极。以后将会看到,在原电池中正极发生还 原反应,正极是阴极,负极发生氧化反应,负极是阳极。 2.法拉第定律 法拉第(Faraday)在总结大量实验结果的基础上于1833年提出 了著名的法拉第定律,该定律内容如下: 1)在电极上发生电极反应的物质的量与通过溶液的电量成 正比。 2)对于串联电解池,每一个电解池的每一个电极上发生电 极反应的物质的量相等

谈到物质的量必须规定基本单元,这里规定的基本单元是 MW2或A2,M为分子,A为原子,z为发生电极反应时电荷变化 数。例如电解CuCL,溶液时,电极反应为 正极: 2CI-2e→Cl2 负极: Cu2++2e→Cu 在上面的反应中基本单元为CL,/2或Cu/2。 摩尔质子的电荷(一摩尔电子的电荷的绝对值)称为法拉 第常数,用F表示,即 F=Le=6.023×1023mol1×1.6022×10-19C F=96484.4C.molF1=96500C.mol1 若通过溶液的电量为1F,则电路中每一个电极上都要发生得或 失1摩尔电子的电极反应。根据法拉第定律,通过溶液的电量与 电极上发生电极反应的物质的量之间有严格的定量关系
谈到物质的量必须规定基本单元,这里规定的基本单元是 M/z 或A/z,M为分子, A为原子, z为发生电极反应时电荷变化 数。例如电解CuCl 2溶液时,电极反应为 正极: 2Cl - - 2e → Cl 2 负极: Cu2+ + 2e → Cu 在上面的反应中基本单元为Cl 2/2 或Cu/2 。 一摩尔质子的电荷( 一摩尔电子的电荷的绝对值)称为法拉 第常数,用 F 表示,即 F =L e = 6.023 ×1023mol-1 ×1.6022 ×10 -19C F = 96484.4C.mol -1 = 96500C.mol - 1 若通过溶液的电量为1F,则电路中每一个电极上都要发生得或 失 1摩尔电子的电极反应。根据法拉第定律,通过溶液的电量与 电极上发生电极反应的物质的量之间有严格的定量关系

从电极上发生电极反应的物质的量可以确定通过溶液的电 量, 实现这种测量的装置称为电量计。例如将两个银电极插入硝酸银 溶液中就构成了银电量计,若阴极沉积了107.88g银,则通过溶 液的电量为1F。 例6-125℃、101.325kPa下电解CuS0,溶液,当通入的电量为 965C时,在阴上沉积出0.2859g铜,问同时在阴极上有多 少氢气放出? 解:在阴极上发生的反应为 Cu2++2e→Cu 2H++2e→H2 根据法拉第定律,在阴极上析出物质的总量为(以1/2Cu或H 为基本单元): n=n(1/2Cu)+n(H)
从电极上发生电极反应的物质的量可以确定通过溶液的电 量, 实现这种测量的装置称为电量计。例如将两个银电极插入硝酸银 溶液中就构成了银电量计,若阴极沉积了107.88g银,则通过溶 液的电量为 1 F 。 例 6 - 1 25℃、101.325kPa下电解CuSO 4溶液,当通入的电量为 965C时,在阴上沉积出0.2859g铜,问同时在阴极上有多 少氢气放出? 解:在阴极上发生的反应为 Cu 2 + + 2e → Cu 2H + + 2e → H 2 根据法拉第定律,在阴极上析出物质的总量为(以1/2Cu 或 H 为基本单元): n = n (1/2Cu) + n ( H )

n=Q/F=965/96500=0.01000mol n(1/2Cu)=0.2859×2/63.54=0.008999mol n(H)=n-n(Cu)=0.01000mol-0.008999mol =0.00100mol V(H2)= n(H,)RT p 0-00100×8-314×298-15m3=0-0122dm3 2×101.325 3.电解质溶液的导电性质 1)电导、电导率和摩尔电导率 (1)定义 电导即电阻的倒数,用符号G表示,即 G=1/R (6-1-1)
n = Q / F = 965 / 96500 = 0.01000 mol n(1/2Cu)= 0.2859×2/63.54 = 0.008999 mol n(H)= n - n(Cu)= 0.01000 mol -0.008999 mol = 0.00100 mol ( ) p n RT V 2 2 H (H ) = 3 3 m 0 0122dm 2 101 325 0 00100 8 314 298 15 = ⋅ × ⋅ ⋅ × ⋅ × ⋅ = 3. 电解质溶液的导电性质 1)电导、电导率和摩尔电导率 (1)定义 电导即电阻的倒数,用符号G 表示,即 G = 1 / R (6-1-1)

电导的单位为$或2。电解质溶液的电导与两电极间的距离成 反比,与电极的横截面积成正比,即 G= (6-1-2) 式中k称为电导率,其单位为$.m1。对于电解质溶液,是将电 解质溶液置于面积为1m2,相距为1m的两平行电极之间的电导就 是电导率。 由于电解质溶液的浓度不同所包含的离子数不同,因此不能 用电导率来比较电解质的导电能力,需要引入摩尔电导率的概 鑫:在相距为m的两半行电极之间,放入含101电解质的浴 该溶液的电导称为摩尔电导率,用符号4表示。若电解溶液的 浓度为c(mol.m3)则含lmol电解质溶液的体积为lmol/c,由于 电导率k是边长为1m,体积为1m的导体的电导,所以摩尔电导 率1m为
电导的单位为S或Ω-1。电解质溶液的电导与两电极间的距离l成 反比,与电极的横截面积成正比,即 l A G = κ (6-1-2) 式中κ称为电导率,其单位为S.m-1。对于电解质溶液,是将电 解质溶液置于面积为1m2,相距为1m的两平行电极之间的电导就 是电导率。 由于电解质溶液的浓度不同所包含的离子数不同,因此不能 用电导率来比较电解质的导电能力,需要引入摩尔电导率的概 念。在相距为1m的两平行电极之间,放入含1mol 电解质的溶 液, 该溶液的电导称为摩尔电导率,用符号Λm表示。若电解溶液的 浓度为c(mol.m-3)则含1mol 电解质溶液的体积为1mol/c,由于 电导率κ是边长为1m,体积为1m3的导体的电导,所以摩尔电导 率Λm为

对含有1mol电解质的溶 1m2 液: 当c=lmol.m3时,V=1m3,电 导率与摩尔电导率在数值上正 好相等。4m=K/1mol.m3; 当c=2mol.m3时,V=0.5m3, 电导率正好是摩尔电导率的两 倍。1m=k/2mol.m3; 1m 当c=3mol.m-3时,V=⅓m3 电导率正好是摩尔电导率的三倍。Am=k/3mol.m3。所以 Am=K /c (6-1-3) 摩尔电导率的单位为S.m2moH,使用上式时应注意浓度c的单 位,c的单位应为mol.m3,并标明基本单元,如Am(NaCl) 、 Am(1/2CuS04)等
1m 对含有1mol电解质的溶 液: 当c =1mol.m-3 时,V =1m3,电 导率与摩尔电导率在数值上正 好相等。Λm = κ / 1mol.m-3 ; 当c = 2mol.m-3时,V = 0.5m3, 电导率正好是摩尔电导率的两 倍。 Λm = κ / 2mol.m-3 ; 1m2 当c = 3mol.m-3时,V = ⅓ m3, 电导率正好是摩尔电导率的三倍。 Λm = κ / 3mol.m-3 。所以 Λ m = κ / c (6-1-3) 摩尔电导率的单位为S.m2.mol-1,使用上式时应注意浓度c的单 位,c的单位应为mol.m-3,并标明基本单元,如Λm(NaCl)、 Λ m(1/2CuSO4)等