
2)电解池: 电解池:充电过程,电能一→化学能 例:Zn++Cu 一→ Zn+Cu+不能发生 若在可逆电池:电解,能发生 (-)Zn++2e一→Zm 还原,阴极 (+)Cu-→Cu++2e 氧化,阳极 总反应:Zn++Cu一→Zn+Cu+
1 2)电解池: 电解池:充电过程,电能—→化学能 例:Zn++ + Cu —→ Zn + Cu++ 不能发生 若在可逆电池:电解,能发生 (-)Zn++ + 2e —→ Zn 还原,阴极 (+)Cu —→ Cu++ + 2e 氧化,阳极 总反应:Zn++ + Cu —→ Zn + Cu++
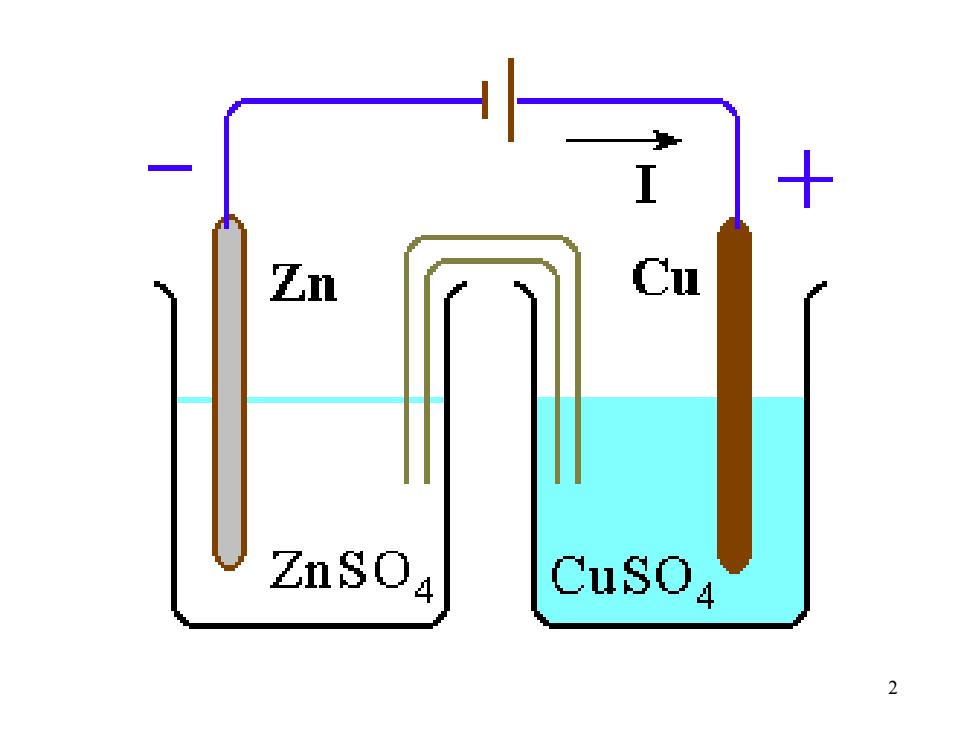
Zn ZnSOa CuSOa 2
2

说明:a)电解池: 负极(-):还原反应 阳极(+):氧化反应 3.电池的表示 1)“|”或“,”表示不同相的接界, “‖”表示盐桥 例:Zn(s)|H2SO4(I)|Cu(s) Zn (s)ZnCl (1)AgCI (s),Ag (s) Zn (s)ZnSO (1)II CuSO (1)Cu (s) 3
3 负极(-):还原反应 阳极(+):氧化反应 说明:a)电解池: 3. 电池的表示 1)“∣”或“,”表示不同相的接界, “‖”表示盐桥 例: Zn(s)∣H2 SO4(l)∣Cu(s) Zn(s)∣ZnCl2(l)∣AgCl(s), Ag(s) Zn(s)∣ZnSO4(l)‖CuSO4(l)∣Cu(s)

2)写原电池时,一般左边(一)极, 右边(十)极 3)标出体系T,P,m及物态, 298K,P,m=m°,可略 4)气体电极,因气体不能直接作为电极, 必须惰性金属如Pt,惰性电极不参加 反应,可略 (Pt),H2(g,P)HSO(m)O2(g,P2),(Pt)
4 2)写原电池时,一般左边(-)极, 右边(+)极 3)标出体系 T,P,m 及物态, 298K,P θ,m=mθ,可略 4)气体电极,因气体不能直接作为电极, 必须惰性金属如 Pt,惰性电极不参加 反应,可略 (Pt), H2 (g,P1 ) ∣HSO4 (m) ∣O2 (g,P2 ), (Pt)

二.电化学反应的△G1,p和可逆电池电动势 1.电化学反应△Gm,P 等T,P,可逆条件下:-△GT,=W可' W可'=nFE n; 电极反应中得失电子数 E:电池的电动势 -A GT,P=nFE 表示可逆电池的化学势来源于化学能 在T,P,可逆:-△,G,=nFE E:标准电池的电动势 5
5 二.电化学反应的Δ rGT,P和可逆电池电动势 1. 电化学反应Δ rGT,P 等 T,P,可逆条件下:-Δ rGT,P =W 可 ' W 可 '=nFE n:电极反应中得失电子数 E:电池的电动势 -Δ rGT,P = nFE 表示可逆电池的化学势来源于化学能 在 T,P θ,可逆:-Δ rG θ T,P = nFEθ E θ:标准电池的电动势

2.可逆电池的电动势E 1)电动势(电位差)E: 例:Zu,Cu电池 由Zu,Cu棒构成两电极,放在电解液中, 用盐桥连接两电解液,将两电极连接,产 生电动势,这是电子流动产生电流引起的 电动势E:与T,P,电解液浓度m等有关 2)可逆电池电动势 E,E°:电化学的重要参数 6
6 例:Zu,Cu 电池 由 Zu,Cu 棒构成两电极,放在电解液中, 用盐桥连接两电解液,将两电极连接,产 生电动势,这是电子流动产生电流引起的 2. 可逆电池的电动势 E 1)电动势(电位差)E: 电动势 E:与 T,P,电解液浓度 m 等有关 2)可逆电池电动势 E,E θ:电化学的重要参数

-△,G,p=nFE,-△G°,=nFE 由热力学量求出电化学量,显然此式为热 力学和电化学的桥梁 例:Zn+Cu+ Zn++Cu 298K,P:△G°,p=-212.19K/mol E=-A.GT.r/nF-1.10J/C-1.10V 三、可逆电池和不可逆电池 电池反应:若以可逆过程实现为可逆电 池,用热力学讨论 7
7 -Δ rGT,P = nFE,-Δ rG θ T,P = nFEθ 由热力学量求出电化学量,显然此式为热 力学和电化学的桥梁 例:Zn+ Cu++ —→ Zn++ + Cu 298K,P θ :Δ rG θ T,P = - 212.19KJ/mol E θ= -Δ rG θ T,P /nF=1.10J/C=1.10V 三、可逆电池和不可逆电池 电池反应:若以可逆过程实现为可逆电 池,用热力学讨论

若以不可逆过程实现,为不可逆电池,用 动力学速率理论,过渡态理论讨论 1.可逆电池必须满足两个条件: 1)电池中发生的化学反应必须是可逆 正反两方向进行,即充放电反应互为可逆 放电电池:原电池,外加电动势电池电动势 电池充放电后,化学反应体系复原 8
8 若以不可逆过程实现,为不可逆电池,用 动力学速率理论,过渡态理论讨论 1. 可逆电池必须满足两个条件: 1)电池中发生的化学反应必须是可逆 正反两方向进行,即充放电反应互为可逆 放电电池:原电池,外加电动势电池电动势 电池充放电后,化学反应体系复原
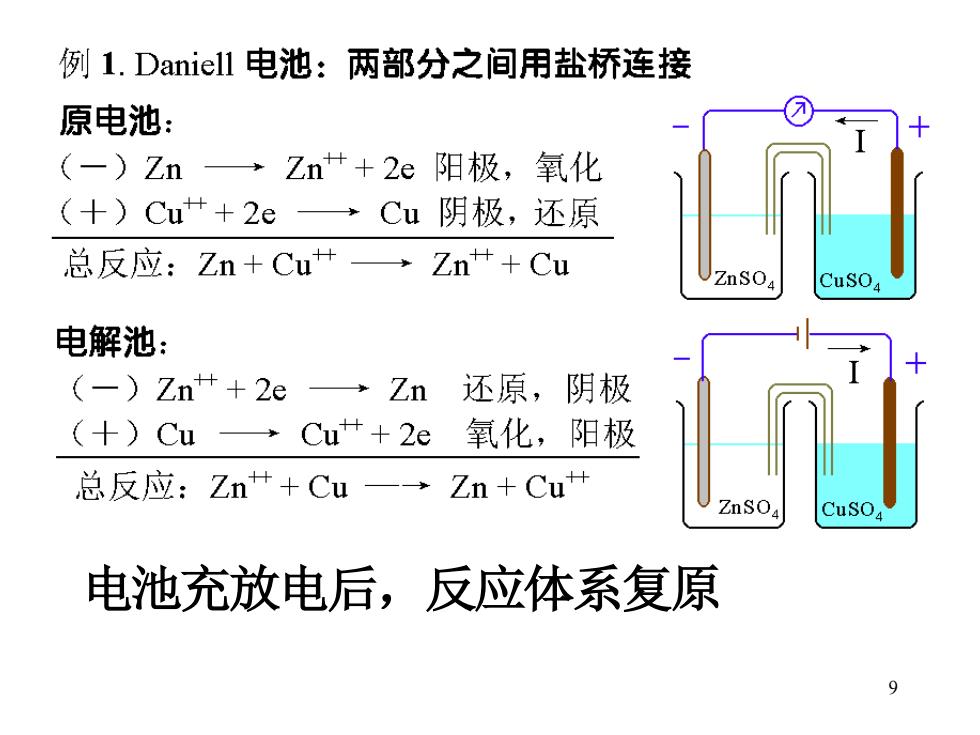
例1.Daniell电池:两部分之间用盐桥连接 原电池: (一)Zn→Zn++2e阳极,氧化 (十)Cu++2eCu阴极,还原 总反应:Zn+Cu+→Zn++Cu ZnSO 电解池: (-)Zn++2e→Zn 还原,阴极 (+)Cu →Cu++2e 氧化, 阳极 总反应:Zn++Cu一→Zn+Cu+ 电池充放电后,反应体系复原 9
9 电池充放电后,反应体系复原
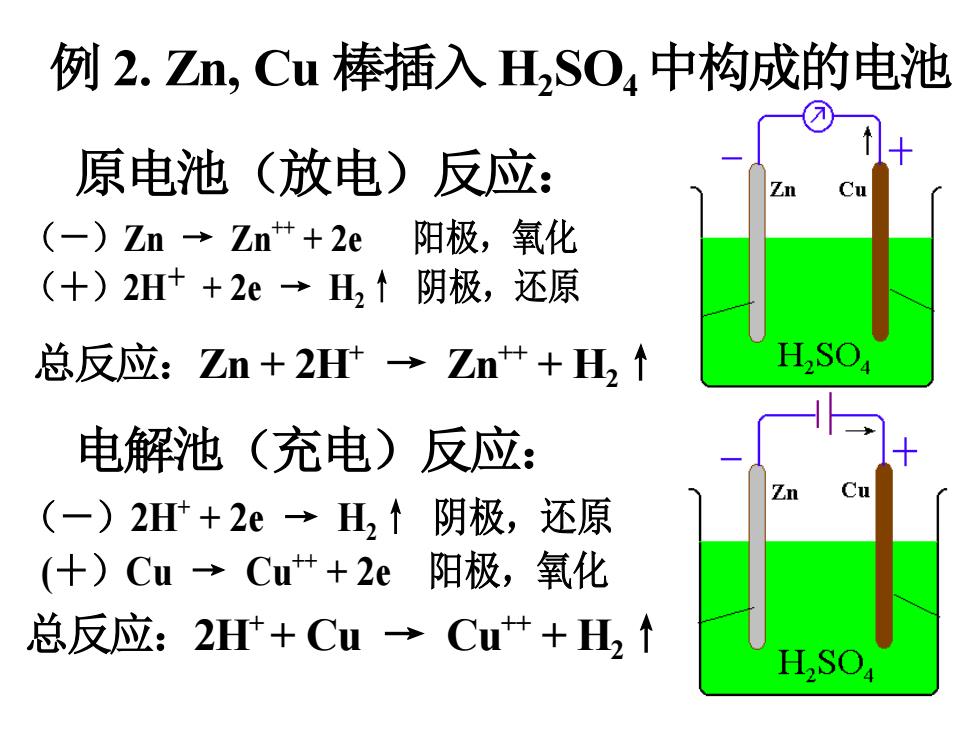
例2.Zn,Cu棒插入HSO4中构成的电池 原电池(放电)反应: (-)Zn→Zn++2e阳极,氧化 (+)2H++2e→H,↑阴极,还原 总反应:Zn+2H→Zn++H, 电解池(充电)反应: (-)2H+2e→H,↑阴极,还原 (+)Cu→Cu++2e阳极,氧化 总反应:2H+Cu→Cu艹+H,↑ H,SO
10 例 2. Zn, Cu 棒插入 H2 SO4中构成的电池 原电池(放电)反应: (-)Zn → Zn++ + 2e 阳极,氧化 (+)2H+ + 2e → H2↑ 阴极,还原 总反应:Zn + 2H+ → Zn++ + H2↑ 电解池(充电)反应: (-)2H+ + 2e → H2↑ 阴极,还原 (+)Cu → Cu++ + 2e 阳极,氧化 总反应:2H+ + Cu → Cu++ + H2↑