
习题:650页起 1,2,18,20,23,29
习题:650页起 1,2,18,20,23,29

§8.11可逆电极的分类 可逆电池是由可逆电极构成的,发生的反应是热 力学可逆反应。 (1) 简单电极 a) 金属-金属离子电极 例如:Zn|Zn艹(a),CuCu(a),Ag|Ag'(a)等。 电极反应:M++Ze→M 金属M与含有该金属离子+的溶液达成电化学 平衡。 与溶剂发生化学反应的金属不能作为电极,例如 Na,K,Ca等与水反应,不能在水溶液中作电极。 这类电极的电势与金属性质及溶液的浓度有关
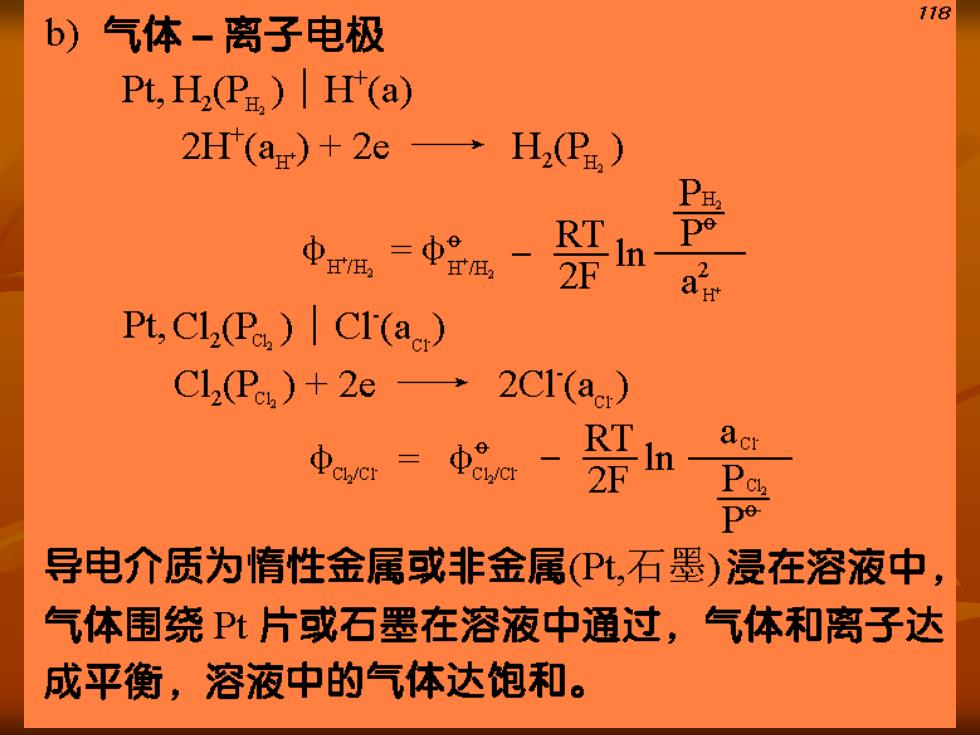
118 b)气体-离子电极 Pt,HP.)H'(a) 2H'(ar)+2e H2(P) RT De 2F Pt,Cl(P)Cl(a) Cl(P)+2e→ 2C1(a) RT acr 2F 导电介质为惰性金属或非金属PL,石墨)浸在溶液中, 气体围绕P片或石墨在溶液中通过,气体和离子达 成平衡,溶液中的气体达饱和

119 c)汞齐电极 碱金属与水反应激烈,不能直接浸入电解质水溶 液中作电极,但碱金属的电极电势是有理论意义的。 可以借助汞齐电极求出碱金属电极的电极电势。 例:Lewis和Kraus用以下方法求出金属钠与水溶液 中的Na的还原电势Φa。 电池(1)Na(s)NaI(乙基胺溶液)NaHg)(a) 阳极Na(s)→Na(乙基胺溶液)+e 阴极Na(乙胺液)+e Na(Hg)(a) 总反应:Na(s)aGNa(Hg)(a) 25℃时测得该电池电动势E,=0.8449V

电池(2): 120 H2go1K2)Hea,oe山 阳极 Na(Hg)(a)Na(m)+e 阴极 号Hg,C1,(s)+e一HgL)+CI(m 总反应: Na(Hg)(a)+Hg2Cl(s)Hg(L)+Na(m)+CI(m).(2) 测得E2=2.1582V(25℃) (1)+(2): Na(s)+Hg.Cl(s) Hg(L)+Na(m)+Cl(m).(3) 将此反应设计成电池,其电动势E3=E,+E2=3.30031V, [△G3=△G1+△,G2]

将反应(3)设计成如下假想电池: 121 Na(s)NaCl(m)Hg,C12(s),Hg(L) 此电池的电动势: E=中w电-中u=(中0e-中8s)-1has.a F aa.=a4=Y星(0=0.652×0.9972=0.4396 查表中=0.268V(298K) E,=E1+E2=3.0031=(中e-,8)+0.02110 中8w电-中,n=2.982V ,8n=we-2.982=0.268-2.982=-2.714V

122 对于一般的汞齐电极: M(Hg),(aM)M(av) 反应为MHg) →M24+Ze 是金属M的汞齐与溶液中金属离子M+达成电化学平衡, 这种电极的电势不仅和溶液中离子的浓度有关,也和汞齐 中金属的含量有关。汞齐中的汞不参加反应。 (2)金属-难溶盐电极 已经接触过的常见电极有: Ag-AgC1电极,Ag(s),AgC1(s)|CI; Ag+Cl(acr)AgCl(s)+e 甘汞电极,HgL),HgC1(s)CI; 2HgL)+2C1r(acr)→ Hg,Cl2(s)+2e Pb-PbSO,电极,Pb(s),PbSO,(s)SO4; Pb+SO (a) PbSO(s)+2e

123 还有金属-难溶氧化物电极也归入此类: Hg,HgO H;Hg+H,OHIgO+2H+2e Hg,HgO OH;Hg+2OH HgO+2H,O+2e 这类电极三相平衡共存,电极电势决定于金属,难 溶盐的性质及溶液中难溶盐负离子的浓度(如果为氧化 物电极,则决定于OI或广的浓度)。 例: 中AgCVAg PAgCl/Ag RT In ac 中Hg0,H*Hg 票 2 中HoHg,o=中g0y.0r T In ao

124 3)氧化-还原电极 实际上每个都发生氧化或还原反应,以 上所讲的氧化或还原是发生在两相或三相 中,这里所指的是发生在同一相中的氧化 还原反应。 将惰性电极Pt或石墨)浸入含有同一元 素的两种不同价态离子的溶液中做成的电 极。 例:Pt|Fe+,Fe+;FeH+eFeH Pt H,Mn,MnO; MnOa+8H+5e± Mn+4H,O

公 第三类电极 ◇电极反应 Fe3+ (a).Fe2+(az)Pt Fe (a)+e-Fe2+(a2) Cu2+).Cu'(a2)Pt Cu2+(a)+e-fCut (az) Sn4 (a).Sn2+(a2)Pt Sn+(a)+2e-Sn2+(a2) Pt电极 Pt电极 Fest(a) Cu2+(a) Sn4a】 +Fe2+(a.) Cu*(a) +Sn2+(a)