
第六章 化学动力学 绪论 1.化学热力学的研究对象和局限性 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: △,Ga/kJ.mol 号N,+3H,NH,(g) -16.63 H2+5O2→H2O) -237.19 热力学只能判断这两个反应都能发生,但如何使 它发生,热力学无法回答
1 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 + ⎯⎯→ + ⎯⎯→ 1 r m / kJ mol 16.63 237.19 G − − − 热力学只能判断这两个反应都能发生,但如何使 它发生,热力学无法回答。 1.化学热力学的研究对象和局限性 第六章 化学动力学 绪论

2.化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 例如: 动力学认为: N+IH,→NH,g) 需一定的T,P和催化剂 2 H,+0,H,00 点火,加温或催化剂 2
2 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 2.化学动力学的研究对象 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 + → + → 例如: 动力学认为: 需一定的T,P和催化剂 点火,加温或催化剂

3.化学动力学发展简史 •1848年 dlnK_△Ue dInk van't Hoff ke 提出: dT RT2 dT RT2 Kek如 1891年 Arrhenius k=Aexp( RT 设E,为与T无关的常数 1935年 Eyring?等提出过渡态理论 1960年 交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 3
3 •1848年 van’t Hoff 提出: 2 c a 2 d ln d ln d d K k E T RT T T U R = = b f c k k K = •1891年 Arrhenius a exp( ) E k A RT = − 设 Ea 为与T无关的常数 •1935年 Eyring等提出过渡态理论 •1960年 交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 3.化学动力学发展简史

化学动力学: 1.化学反应的速率 ,e+0(g24,0w 298K △,Gm1°=-273.19KJ.mol 反应速度r=0 常温常压下,加入催化剂Pd或Pt,生成水
4 化学动力学: 1. 化学反应的速率( ) ( ) 2 1 ( ) 2 2 2 H g + O g → H O l 298K rGm,1 0 = - 273.19KJ.mol-1 反应速度 r=0 常温常压下,加入催化剂 Pd 或 Pt,生成水

2.化学反应的机理 (reaction mechanism) 卤族元素反应:H2+X2→2HX H2+L2→2HⅡ 机理:(1)2→2I (2)2I+H,→ 2HⅡ H2+Cl2→2HC1 机理:(1)C2→2C1 (2)CI+H2→HCI+H (3)H+C2→HCl+CI (4)C1+C1→Cl2 5
5 2. 化学反应的机理(reaction mechanism) 卤族元素反应: H2 + X2 → 2HX H2 + I2 → 2HI 机理:(1)I2 → 2I H2 + Cl2 → 2HCl (2)2I + H2 → 2HI 机理:(1)Cl2 → 2Cl (2)Cl + H2 →HCl + H (3)H + Cl2 → HCl + Cl (4)Cl + Cl →Cl2

H2+Br2→2HBr 机理:(1)Br2→2Br (2)Br+H2→HBr+Br (3)H+HBr→H2+BI (4)Br+Br →Br2 分类(机理): (1) 基元反应(elementary reaction): 反应物微粒直接一步生成产物的反应 基元反应或简单反应 基元反应是组成化学反应的基本单元
6 H2 + Br2 → 2HBr 机理:(1)Br2 → 2Br (2)Br + H2 →HBr + Br (3)H + HBr → H2 + Br (4)Br +Br → Br2 分类(机理): (1)基元反应(elementary reaction): 反应物微粒直接一步生成产物的反应 ——基元反应或简单反应 基元反应是组成化学反应的基本单元

基元反应:L2→2I H2+CI→HCI+H (2)复杂反应: 由两个或两个以上基元反应构成的化学反应 复杂反应 复杂反应:H2+L2→2HI H2+C2→2HCI 分类(反应): (1)可逆反应: CH COOH+C:H:OHCH COOCH+H.O
7 基元反应:I2 → 2I H2 + Cl → HCl + H (2)复杂反应: 由两个或两个以上基元反应构成的化学反应 ——复杂反应 复杂反应:H2 + I2 → 2HI H2 + Cl2 → 2HCl 分类(反应): (1)可逆反应:
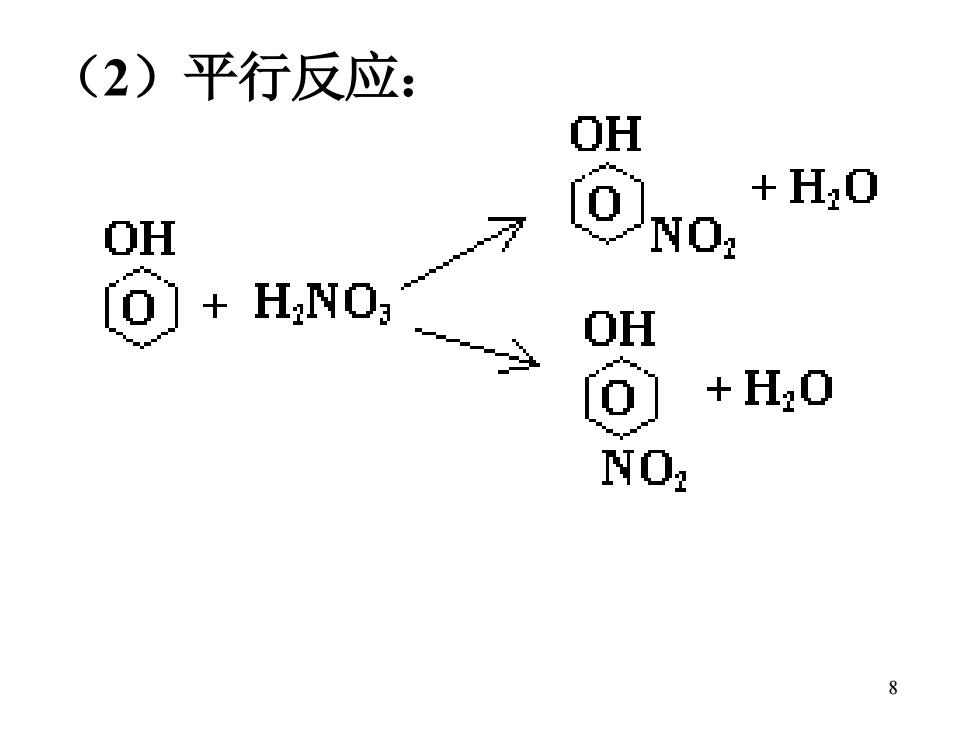
(2)平行反应: OH +H0 OH NO: ()HNO; OH +H20 NO: 8
8 (2)平行反应:
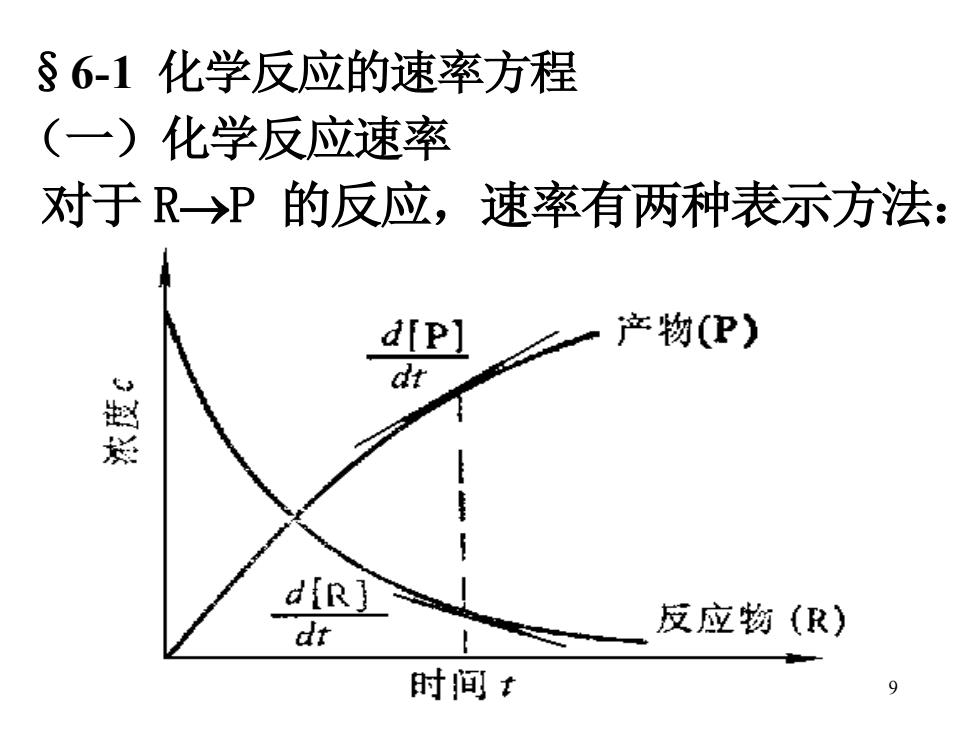
§6-1化学反应的速率方程 (一)化学反应速率 对于R→P的反应,速率有两种表示方法: d[P] 产物(P) dt diR] dt 反应物(R) 时间t 9
9 §6-1 化学反应的速率方程 (一)化学反应速率 对于 R→P 的反应,速率有两种表示方法:
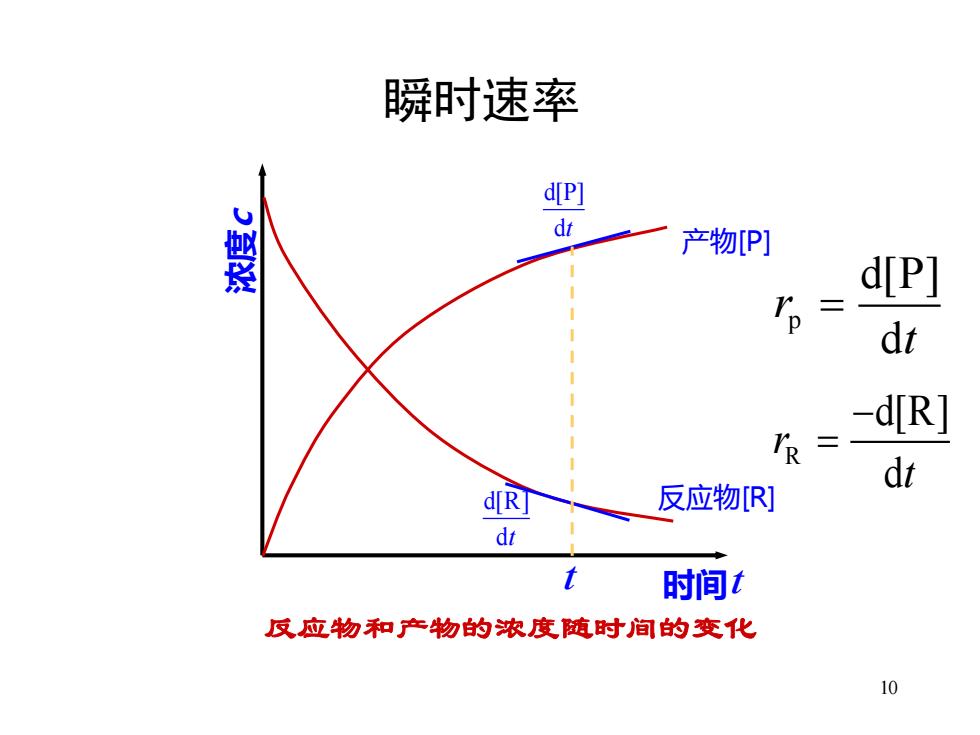
瞬时速率 d[P] dt 产物[P] d[P] dt -d[R] IR= di d[RJ 反应物R] dt 时间1 反应物和产物的浓度随时间的变化 10
10 瞬时速率 浓度 c 时间 t 反应物[R] d[P] dt d[R] dt 反应物和产物的浓度随时间的变化 产物[P] t R d[R] d r t − = p d[P] d r t =