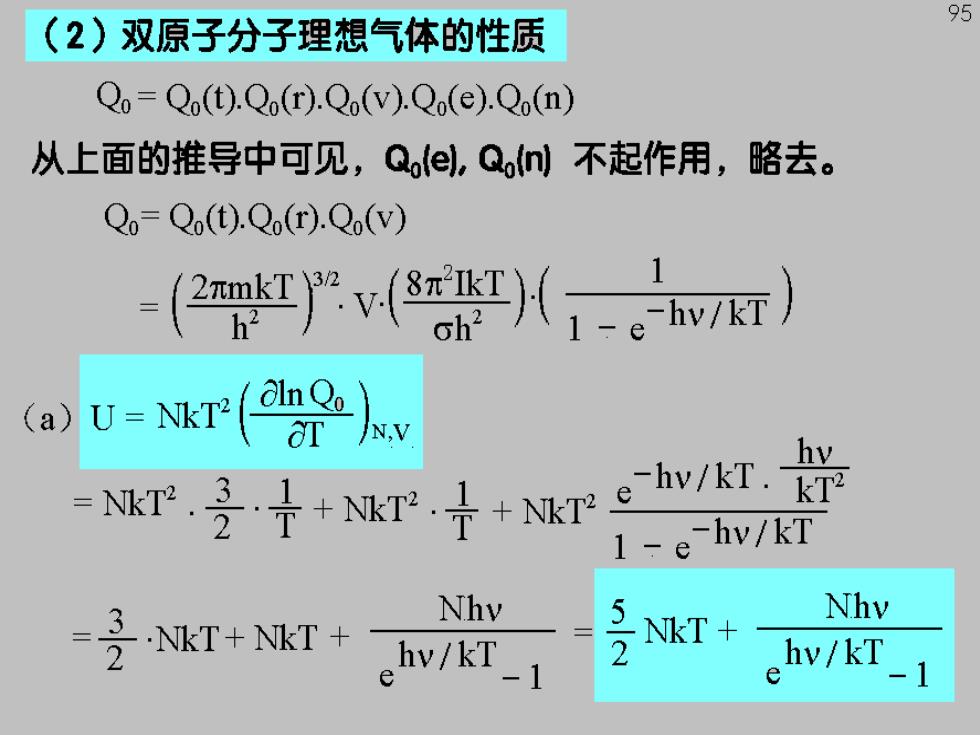
95 (2)双原子分子理想气体的性质 Qo=Q(t).Qo(r).Qo(V).Qo(e).Qo(n) 从上面的推导中可见,Qoel,Qo不起作用,略去。 Qo-Qo(t).Qo(r).Qo(V) -2严((,。7) (a) U-kr(e r受十aTwe灯 kT2 1-e-hv/kT NT NKT v/KT-1 Nhy Nhv NkT+ hv/kT e

当T较低时,兴>T,=8;为3000-6000K 96 分母值为e10~e20,后项可忽略, NKT 当T较高时,光<1;令赀=x,。1+x 则有: Nhv Nhv NkT ehv/kT_1 1+ hy 子NkT 可知双原子理想气体的摩尔内能低温时为 高温时为子RT

97 ,=(y (b) 高温时Cvw子Nk-子R,低温时Cm多Nk-之R 与实验结果相符合。 (3)第一定律的解释(统计解释)》 对于理想气体,是独立子体系 U=∑n8i 相依子体系还要增加一项位能) dU=edh:+nde,与dU=δQ-δW比较, 8dn=δ0,nde,=-δw

Σnd:是能级变化对内能的贡献,外界对体系做功, 将使能级发生变化,最明显的是平动能级与 V有关,V变化使c变化,这时将有功产生。 这一项可以证明如下: 、 ge KT ,则8=-kT(ln ni +1n Q) Q Ngi (点s-k灯(e :P=-(0-NT(e

令卡=k(=-(急 相当于一个粒子所呈现的压强。 当T,N不变时,d=-PdV,代入原式, nids;=->n Pdv =-nP:dv =-PdV =-δW, 各粒子显示的压力之和为P,既然证明了Σnds, 代表功,则∑dn,必定代表热量。 Q,8cdn[-kTh是g+lhQ】dn, -Kr (Iin Q)dn 做功后使能级发生移动但能级上的粒子数不变, 说明热量是由体系内的粒子在能级上重新分布而 改变的内能的量

99a (4)理想气体反应的平衡常数 a、平衡常数的统计表达式 aA+bB IL mM 独立子,等同系 =一 RT In K K·的表示热力学平衡常数。 △,Gt=1Gtm+mGtm-aGn-bGfm 而且有: G=-NTh是=-NT1n是+U

996 几种物质的平衡常数表达式必须选取一个共同坐标 即须用Q表示,而我们只知道Q,表示式,所以式中 要出现U,项。 G-NKT in O -NkT inO -+Uom △,Gt=-RTln QB力 其中A,Um=[IUgm(L)+mU M0] -[aUo (A)+bUcem (B)] 是在基态(或0K),(这时各种运动都处于基态)
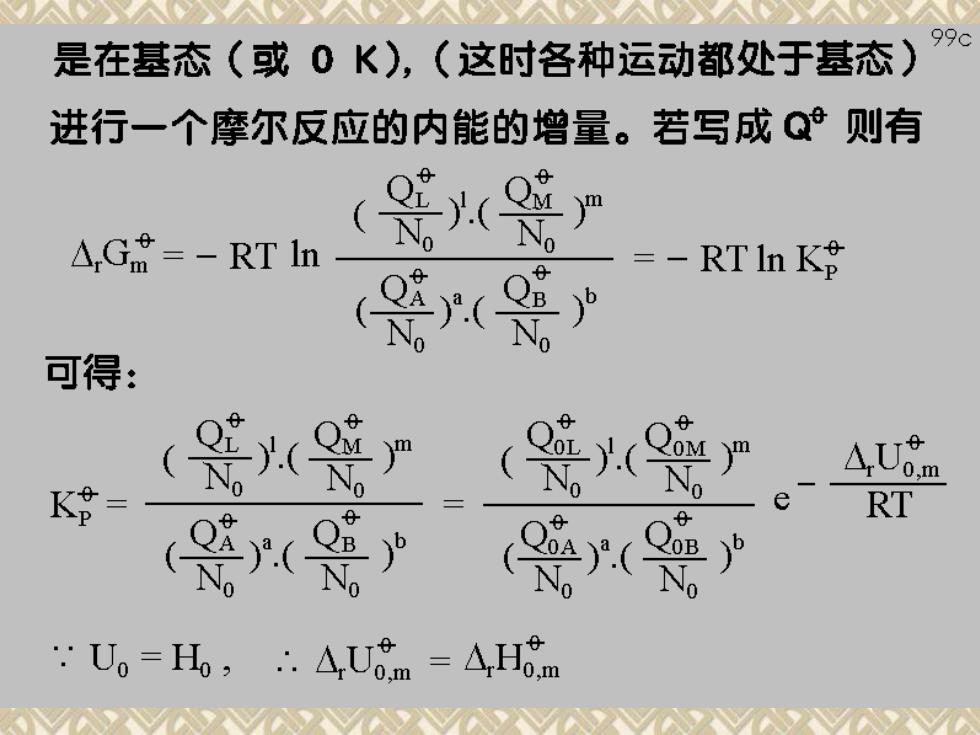
99c 是在基态(或0K),(这时各种运动都处于基态) 进行一个摩尔反应的内能的增量。若写成Q则有 △Gt=-RTln =-RT In K8 可得: K8= RT 6 .Uo=Ho,.A,Uom =AHo.m

99d 将Q。变换一下,可得平衡常数的统计表达式的 另一种形式: Qm=Q(0.Q(r).Q(v).Q(e).Q(n)=Q8(0-Q(①) =00(2vg.v No kT =fN 则有 代入K表达式: K9= AUom RT

99e 有时用单位体积内的分子数来表达平衡常数更方便。 PV -1 NkT,→义-号为单位体积内的分子数。 KN (是冷 导州 =K( 式中△v= (+m)-(a+b)