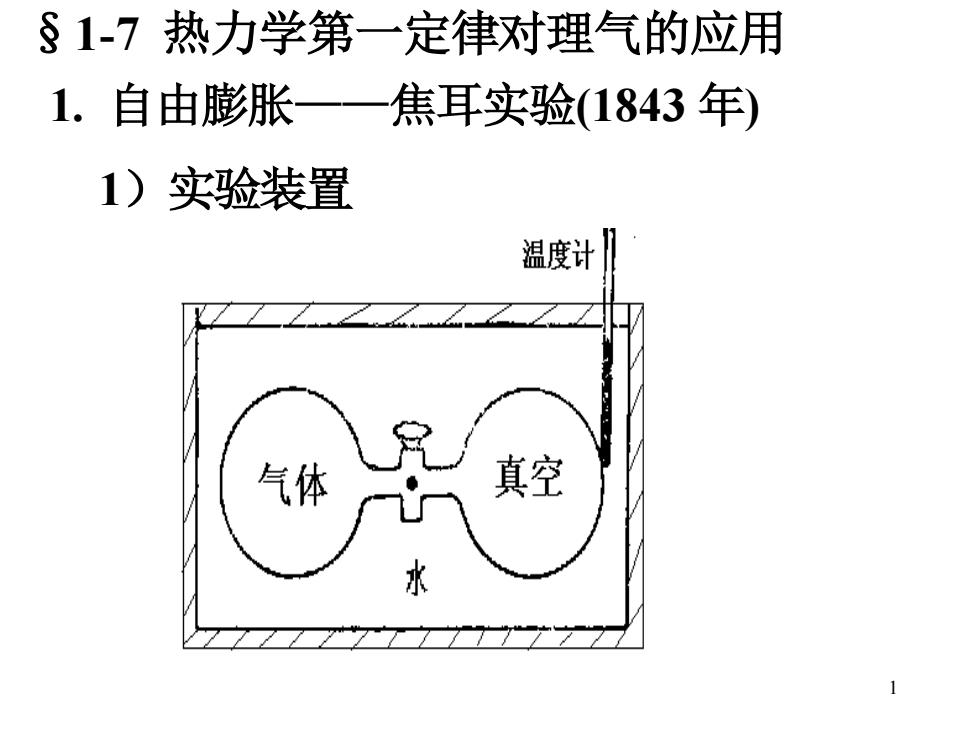
§1-7热力学第一定律对理气的应用 1.自由膨胀一一 焦耳实验(1843年) 1)实验装置 温度计 气体 真空 水 1
1 §1-7 热力学第一定律对理气的应用 1. 自由膨胀——焦耳实验(1843 年) 1)实验装置

2)热分析: 体系为理气,环境为水和容器 气体向真空膨胀,没有观察到水浴温度变化。 dT=0,Q=0; P外=0,W=0, 恒温过程: △U=Q-W=0 P,V变了,T不变,△U=0
2 2)热分析: P 外=0,W=0, 气体向真空膨胀,没有观察到水浴温度变化。 dT=0,Q=0; 体系为理气,环境为水和容器 恒温过程: ΔU=Q-W=0 P, V 变了,T 不变,ΔU=0

3)结论:理气的U与P,V无关,U(T) 论证:理气U=U(T,V) 由焦耳实验知:dU=0,dT=0,dV≠0 说明内能不随体积变化 同理,U=U(T,P) aw-Gr+S,aP 3
3 3)结论: 理气的 U 与 P,V 无关,U(T) 论证:理气 U=U(T,V) dV V U dT T U dU V T ( ) ( ) + = 由焦耳实验知:dU=0,dT=0,dV≠0 ( ) = 0 T V U 说明内能不随体积变化 同理,U=U(T,P) dP P U dT T U dU P T ( ) ( ) + =

由焦耳实验知:dU=0,dT=0,dP≠0 0 说明内能不随体积变化 结论:理想气体变化的内能只是T的函数, 而与P,V无关。 1
4 ( ) = 0 T P U 由焦耳实验知:dU=0,dT=0,dP≠0 说明内能不随体积变化 结论:理想气体变化的内能只是 T 的函数, 而与 P,V 无关

同理,△H=△U+△PV=△U+R(T2-T1) 理气:等T,△U=0,△H=0 说明:a)理气的△U(T)和△H(T) b)d-Gvd,C=(g7 AU=C,dT,无需等V anea,C,-(6 AH=Cn,无需等P 5
5 同理,ΔH=ΔU + ΔPV =ΔU + nR(T2 -T1) 理气:等 T,ΔU=0,ΔH=0 说明:a)理气的ΔU(T)和ΔH(T) b)dU=CvdT, V V T U C ( ) = = 2 1 T T U CV d T ,无需等 V dH=CpdT, P P T U C ( ) = , = 2 1 T T H CP dT ,无需等P

2.理想气体的特性和计算 1)△U(T),△H(T) U-CdT,Al-CdT 2)热容:Cm-Cm=R 3 单原子分子 R Cpm R 2 2 5 7 双原子分子 Cv,m R 2 Cp.m 7 高温 R 2 2
6 2. 理想气体的特性和计算 = 2 1 T T V U C dT , = 2 1 T T P H C dT 2)热容:Cp m – Cvm =R 单原子分子 CV m R 2 3 , = CP m R 2 5 , = 双原子分子 CV m R 2 5 , = CP m R 2 7 , = 高温 CV m R 2 7 , = CP m R 2 9 , = 1)ΔU(T),ΔH(T)
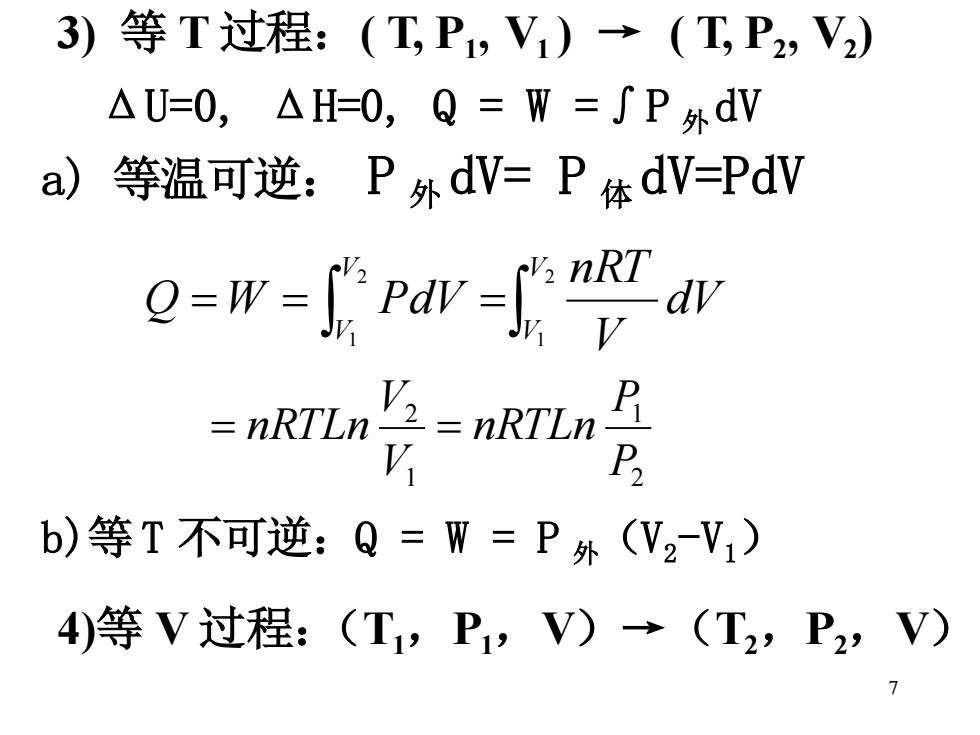
3) 等T过程:(T,P,V1)→(T,P2,V2) △U=0,△H=0,Q=W=∫P外dV a) 等温可逆:P外dV=P体dV=PdV w-Pava -ARTLn-nRTLn V P2 b)等T不可逆:Q=W=P外(V2V1) 4)等V过程:(T,P1,V)→(T2,P2,V)
7 3) 等 T 过程:( T, P1 , V1 ) → ( T, P2 , V2 ) ΔU=0, ΔH=0, Q = W =∫P 外dV b)等 T 不可逆:Q = W = P 外(V2 -V1) 4)等 V 过程:(T1,P1,V)→(T2,P2,V) a) 等温可逆: P 外 dV= P 体 dV=PdV = = = 2 1 2 1 V V V V dV V nRT Q W PdV 2 1 1 2 P P nRTLn V V = nRTLn =

w=0,AU=0=∫C,d=C,(2-T) H=0。=C,d=C(g,-T) 5)等压过程: △U=Cy(T2-T1) Qp=△H=Cp(T2-T1) W=P外(V2-V1) 3绝热过程 1)定义:体系与环境间没有热量交换的过程 例体系绝热膨胀 Q=0,△U=-W
8 ΔU = CV(T2 -T1) QP =ΔH = CP(T2 -T1) W = P 外(V2 -V1) 3.绝热过程 1) 定义:体系与环境间没有热量交换的过程 Q=0,ΔU=-W W=0, ( ) 2 1 2 1 U Q C dT Cv T T T T = V = V = − 5)等压过程: ( ) 2 1 2 1 H Q C dT CP T T T T = P = P = − 例 体系绝热膨胀

膨胀:V↑,P↓,体系对环境做功 使体系的△U0,U↑,T 特点:a)可以绝热可逆,绝热不可逆方式进行 b)绝热膨胀T↓,绝热压缩T↑ 9
9 特点:a)可以绝热可逆,绝热不可逆方式进行 膨胀:V↑ ,P↓,体系对环境做功 使体系的ΔU 0,U↑,T↑ b)绝热膨胀 T↓,绝热压缩 T↑

P =5P0 =P =298K Q=0,W,AU,AH =2 V=2dm3 V2 =? △U=Cy(T2-T1) △H=Cp(T2-T1) W=-△U nd -dy 可逆 应求出T1-T2,V1-V2间的关系 10
10 = = = ⎯⎯⎯⎯⎯→ = = = = ? ? 2 298 5 2 2 2 0, , , 3 1 1 1 V T P P V dm T K P P Q W U H ΔU= CV(T2 -T1) W=∫P 外dV=∫P 体 dV= 2 1 V V dV V nRT 应求出 T1 -T2,V1 -V2间的关系 W=-ΔU 可逆 ΔH=CP(T2 -T1)