
第十二章代谢调节 在自然界中,包括动物、植物和微生物,都是由糖类、脂类、蛋白质、核酸四大类基 本物质和有限的其它小分子物质构成的。虽然这些物质化学性质不同,功能各异,但它们 在生物体内的代谢过程并不是彼此孤立、互不影响的,而是互相联系、互相制约、彼此交 织在一起的。在正常的生物体内,不管是单细胞还是多细胞生物,也不管是原核生物还是 真核生物,这些错综复杂的代谢过程均能按其生长发育及适应外界环境的需要而有条不素 相互协调地进行,生成的产物既足以满足生物的需要 又不会过多而造成浪费 表现出 物机体对其代谢具有调节控制的机能,这说明生物在其进化过程中逐渐形成了一整套高 效、灵敏、经济、合理的调控系统。 第一节代谢途径的相互联系 生物体内各类物质代谢途径,相互影响,相互转化。糖、脂类和蛋白质之间可以互相 转化,当糖代谢失调时会立即影响到蛋白质代谢和脂类代谢。现将生物体内四类主要有机 物质:糖、脂类、蛋白质和核酸,代谢途径相互关系分别叙述如下 一,糖代谢与脂类代谢的相互联系 糖类和脂类郑是以碳氢元素为主的化合物,它们在代谢关系上十分密切。一般来说 在糖供给充足时,糖可大量转变为脂肪贮存起来,导致发胖。糖变为脂肪的大致步骤为 糖经酵解产生磷酸 羟丙酮,磷酸二羟丙酮可以还原为甘油:磷酸 二羟丙酮也能继续通过 糖酵解途径形成丙酮酸,丙酮酸氧化脱羧后转变成乙酰辅酶A,乙酰辅酶A可用来合成脂 肪酸,最后由甘油和脂肪酸合成脂肪。可见甘油三酯的每个碳原子都可以从糖转变而来。 如果用含糖类很多的饲料喂养家畜,就可以获得肥畜的效果:另外许多微生物可在含糖的 培养基中生长,在细胞内合成各种脂类物质,如某些酵母合成的脂肪可达干重的40% 脂肪转化成糖的过程首先是脂肪分解成甘油和脂肪酸 后两者分别按不同途径向 转化。甘油经磷酸化生成ā-磷酸甘油,再转变为磷酸二羟丙酮,后者经糖异生作用转化 成糖。脂肪酸经B一氧化作用,生成乙酰辅酶A。在植物或微生物体内形成的乙酰辅酶A 经乙醛酸循环生成琥珀酸,琥珀酸再经三羧酸循环形成草酰乙酸,草酰乙酸可脱羧形成丙 酮酸,然后通过糖异生作用即可形成糖。但在人和动物体内不存在乙醛酸循环,通常情况 下,乙酰辅酶A都是经三羧酸循环而氧化成CO,和H,O, 而不能转化成糖。因此对动物 言,只是脂肪中的甘油部分可转化为糖,而甘油占脂肪的量相对很少,所以生成的糖量末 对也很少。但脂防酸的氧化利用可以减少对糖的需求,这样,在糖供应不足时,脂肪可 代替糖提供能量,使血糖浓度不至于下降过多。可见,糖和脂肪不仅可以相互转化,在相 互替代供能上关系也是非常密切的。 354
354 第十二章 代谢调节 在自然界中,包括动物、植物和微生物,都是由糖类、脂类、蛋白质、核酸四大类基 本物质和有限的其它小分子物质构成的。虽然这些物质化学性质不同,功能各异,但它们 在生物体内的代谢过程并不是彼此孤立、互不影响的,而是互相联系、互相制约、彼此交 织在一起的。在正常的生物体内,不管是单细胞还是多细胞生物,也不管是原核生物还是 真核生物,这些错综复杂的代谢过程均能按其生长发育及适应外界环境的需要而有条不紊 相互协调地进行,生成的产物既足以满足生物的需要,又不会过多而造成浪费,表现出生 物机体对其代谢具有调节控制的机能,这说明生物在其进化过程中逐渐形成了一整套高 效、灵敏、经济、合理的调控系统。 第一节 代谢途径的相互联系 生物体内各类物质代谢途径,相互影响,相互转化。糖、脂类和蛋白质之间可以互相 转化,当糖代谢失调时会立即影响到蛋白质代谢和脂类代谢。现将生物体内四类主要有机 物质:糖、脂类、蛋白质和核酸,代谢途径相互关系分别叙述如下: 一、糖代谢与脂类代谢的相互联系 糖类和脂类都是以碳氢元素为主的化合物,它们在代谢关系上十分密切。一般来说, 在糖供给充足时,糖可大量转变为脂肪贮存起来,导致发胖。糖变为脂肪的大致步骤为: 糖经酵解产生磷酸二羟丙酮,磷酸二羟丙酮可以还原为甘油;磷酸二羟丙酮也能继续通过 糖酵解途径形成丙酮酸,丙酮酸氧化脱羧后转变成乙酰辅酶 A,乙酰辅酶 A 可用来合成脂 肪酸,最后由甘油和脂肪酸合成脂肪。可见甘油三酯的每个碳原子都可以从糖转变而来。 如果用含糖类很多的饲料喂养家畜,就可以获得肥畜的效果;另外许多微生物可在含糖的 培养基中生长,在细胞内合成各种脂类物质,如某些酵母合成的脂肪可达干重的 40%。 脂肪转化成糖的过程首先是脂肪分解成甘油和脂肪酸,然后两者分别按不同途径向糖 转化。甘油经磷酸化生成α-磷酸甘油,再转变为磷酸二羟丙酮,后者经糖异生作用转化 成糖。脂肪酸经β-氧化作用,生成乙酰辅酶 A。在植物或微生物体内形成的乙酰辅酶 A 经乙醛酸循环生成琥珀酸,琥珀酸再经三羧酸循环形成草酰乙酸,草酰乙酸可脱羧形成丙 酮酸,然后通过糖异生作用即可形成糖。但在人和动物体内不存在乙醛酸循环,通常情况 下,乙酰辅酶 A 都是经三羧酸循环而氧化成 CO2和 H2O,而不能转化成糖。因此对动物而 言,只是脂肪中的甘油部分可转化为糖,而甘油占脂肪的量相对很少,所以生成的糖量相 对也很少。但脂肪酸的氧化利用可以减少对糖的需求,这样,在糖供应不足时,脂肪可以 代替糖提供能量,使血糖浓度不至于下降过多。可见,糖和脂肪不仅可以相互转化,在相 互替代供能上关系也是非常密切的

二、糖代谢与蛋白质代谢的相互联系 糖是生物机体的重要碳源和能源。糖经酵解途径产生的磷酸烯醇式丙酮酸和丙酮酸, 以及丙酮酸脱我后经三我酸循环形成的ā,酮戊二酸、草酰乙酸,它们都可以作为氨基酸的 碳架。通过氨基化或转氨基作用形成相应的氨基酸,进而合成蛋白质。此外,由糖分解产 生的能量 也可供氨基酸和蛋白质合成之用 蛋白质可以降解形成氨基酸,氨基酸在体内可以转变为糖。许多氨基酸经脱氨后形成 丙酮酸、草酰乙酸、α酮戊二酸等,这些酮酸可通过三羧酸循环经由草酰乙酸转化为磷酸 烯醇式丙酮酸,然后再经糖的异生作用生成糖。 三、脂类代谢与蛋白质代谢的相互联系 生物体中的脂类除构成生物膜外,大多以脂肪的形式储存起米。脂肪分解产生甘油和 脂肪酸,甘油可转变为丙酮酸,再转变为草酰乙酸及α-酮戊二酸,然后接受氨基而转变为 丙氨酸、天冬氨酸及谷氨酸。脂肪酸可以桶时B.氧化生成乙酰铺酶A,乙酰铺酶A与草 酰乙酸缩合进入三羧酸循环,可产生ā酮戊二酸和草酰乙酸,进而通过转氨作用生成相应 的谷氨酸和天冬氨酸,从而与氨基酸代谢相联系 但是这种由脂肪酸合成氨基酸碳架结构的可能性是受一定限制的。实际上,当乙酰钝 酶A进入三羧酸循环,形成氨基酸时,需要消耗三羧酸循环中的有机酸,如无其他米源补 充,反应将不能进行下去。在植物和微生物中存在乙醛酸循环,可以由两分子乙酰辅酶A 合成一分子琥珀酸,用于回补三羧酸循环中的有机酸,从而促进脂肪酸合 成其酸。例加」 含有大量油脂的植物种子,在萌发时,由脂肪酸和铵盐形成氨基酸的过程进行得极为强烈 微生物利用醋酸或石油经类物质发酵生产氨基酸,可能也是通过这条途径。但在动物体内 不存在乙醛酸循环。一般来说,动物细胞不易利用脂肪酸合成氨基酸。 蛋白质转变为脂肪,在动物体内也能进行。生糖氨基酸,通过丙酮酸,可以转变为甘 油,也可以在氧化脱羧后转变为乙酰辅酶A,再经丙二酰途径合成脂肪酸。至于生酮氨是 酸如亮氨酸、异亮氨酸、 丙氨酸、酪氨酸等 在代谢过程中能生成乙酰乙酸,由乙酰乙 酸再缩合成脂肪酸,最后合成脂肪。另外,丝氨酸在脱去羧基后形成胆胺,胆胺在接受甲 硫氨酸给出的甲基后,即形成胆碱,胆碱是合成磷脂的成分。 四、核酸代谢与糖、脂类和蛋白质代谢的相互联系 核酸是遗传物质,在机体的遗传和变异及蛋白质合成中,起着决定性的作用。一般光 说,核酸不是重要的碳源、氮源和能源,但许多游离核苷酸在代谢中起着重要的作用。例 如ATP是能量的载体和提供磷酸基团的重要物质,UTP参与多糖的合成,CTP参与卵磷 脂的合成,GTP供给蛋白质肽链合成时所需要部分能量。此外,许多重要铺酶,例如,铺 酶A、烟酰胺核苷酸和异略嗪核苷酸等,都是腺嘌吟核苷酸的衍生物,腺嘌吟核苷酸还可 355
355 二、糖代谢与蛋白质代谢的相互联系 糖是生物机体的重要碳源和能源。糖经酵解途径产生的磷酸烯醇式丙酮酸和丙酮酸, 以及丙酮酸脱羧后经三羧酸循环形成的α-酮戊二酸、草酰乙酸,它们都可以作为氨基酸的 碳架。通过氨基化或转氨基作用形成相应的氨基酸,进而合成蛋白质。此外,由糖分解产 生的能量,也可供氨基酸和蛋白质合成之用。 蛋白质可以降解形成氨基酸,氨基酸在体内可以转变为糖。许多氨基酸经脱氨后形成 丙酮酸、草酰乙酸、α-酮戊二酸等,这些酮酸可通过三羧酸循环经由草酰乙酸转化为磷酸 烯醇式丙酮酸,然后再经糖的异生作用生成糖。 三、脂类代谢与蛋白质代谢的相互联系 生物体中的脂类除构成生物膜外,大多以脂肪的形式储存起来。脂肪分解产生甘油和 脂肪酸,甘油可转变为丙酮酸,再转变为草酰乙酸及α-酮戊二酸,然后接受氨基而转变为 丙氨酸、天冬氨酸及谷氨酸。脂肪酸可以通过β-氧化生成乙酰辅酶 A,乙酰辅酶 A 与草 酰乙酸缩合进入三羧酸循环,可产生α-酮戊二酸和草酰乙酸,进而通过转氨作用生成相应 的谷氨酸和天冬氨酸,从而与氨基酸代谢相联系。 但是这种由脂肪酸合成氨基酸碳架结构的可能性是受一定限制的。实际上,当乙酰辅 酶 A 进入三羧酸循环,形成氨基酸时,需要消耗三羧酸循环中的有机酸,如无其他来源补 充,反应将不能进行下去。在植物和微生物中存在乙醛酸循环,可以由两分子乙酰辅酶 A 合成一分子琥珀酸,用于回补三羧酸循环中的有机酸,从而促进脂肪酸合成氨基酸。例如, 含有大量油脂的植物种子,在萌发时,由脂肪酸和铵盐形成氨基酸的过程进行得极为强烈。 微生物利用醋酸或石油烃类物质发酵生产氨基酸,可能也是通过这条途径。但在动物体内 不存在乙醛酸循环。一般来说,动物细胞不易利用脂肪酸合成氨基酸。 蛋白质转变为脂肪,在动物体内也能进行。生糖氨基酸,通过丙酮酸,可以转变为甘 油,也可以在氧化脱羧后转变为乙酰辅酶 A,再经丙二酰途径合成脂肪酸。至于生酮氨基 酸如亮氨酸、异亮氨酸、苯丙氨酸、酪氨酸等,在代谢过程中能生成乙酰乙酸,由乙酰乙 酸再缩合成脂肪酸,最后合成脂肪。另外,丝氨酸在脱去羧基后形成胆胺,胆胺在接受甲 硫氨酸给出的甲基后,即形成胆碱,胆碱是合成磷脂的成分。 四、核酸代谢与糖、脂类和蛋白质代谢的相互联系 核酸是遗传物质,在机体的遗传和变异及蛋白质合成中,起着决定性的作用。一般来 说,核酸不是重要的碳源、氮源和能源,但许多游离核苷酸在代谢中起着重要的作用。例 如 ATP 是能量的载体和提供磷酸基团的重要物质,UTP 参与多糖的合成,CTP 参与卵磷 脂的合成,GTP 供给蛋白质肽链合成时所需要部分能量。此外,许多重要辅酶,例如,辅 酶 A、烟酰胺核苷酸和异咯嗪核苷酸等,都是腺嘌呤核苷酸的衍生物,腺嘌呤核苷酸还可
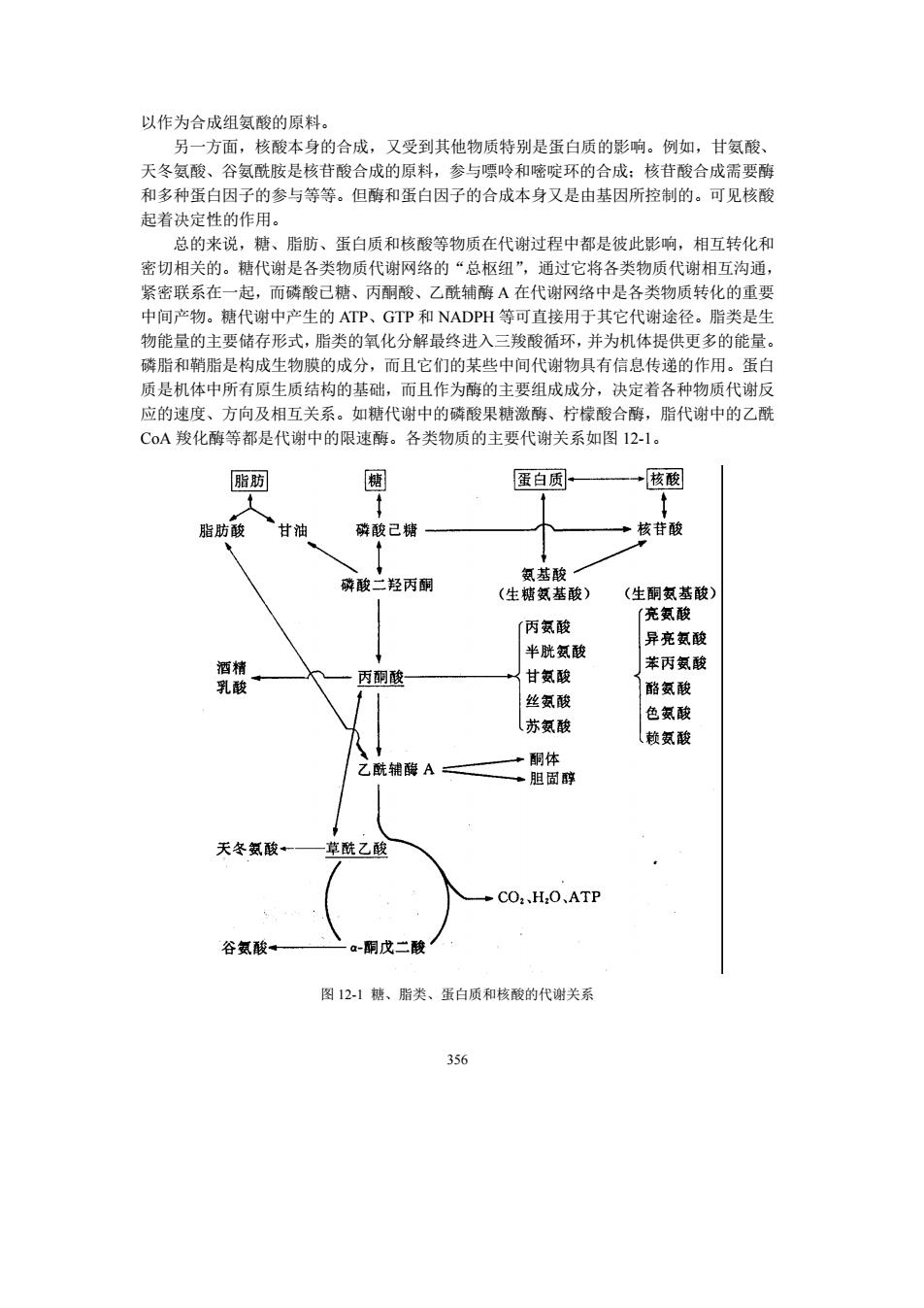
以作为合成组氨酸的原料。 另一方面,核酸本身的合成,又受到其他物质特别是蛋白质的影响。例如,甘氨酸、 天冬氨酸、谷氨酰胺是核苷酸合成的原料,参与嘌吟和嘧啶环的合成:核苷酸合成需要酶 和多种蛋白因子的参与等等。但酶和蛋白因子的合成本身又是由基因所控制的。可见核酸 起着决定性的作用。 总的来说,糖、酯肪、蛋白质和核酸等物质在代谢过程中都是彼此影响,相互转化和 密切相关的。糖代谢是各类物质代谢网络的“总枢纽”,通过它将各类物质代谢相互沟通, 紧密联系在一起,而磷酸已糖、丙嗣酸、乙酰辅醇A在代谢网络中是各类物质转化的重要 中间产物。糖代谢中产生的ATP、GIP和NADPH等可直接用于其它代谢途径。脂类是生 物能量的主要储存形式,脂类的氧化分解最终进入 三羧酸循环,并为机体提供更多的能量 磷脂和鞘脂是构成生物膜的成分,而且它们的某些中间代谢物具有信息传递的作用。蛋白 质是机体中所有原生质结构的基础,而且作为酶的主要组成成分,决定着各种物质代谢反 应的速度、方向及相互关系。如糖代谢中的磷酸果糖激酶、柠檬酸合酶,脂代谢中的乙酰 C0A羧化酶等都是代谢中的限速酶。各类物质的主要代谢关系如图12-1。 脂 蛋白质 →核酸 肪酸 甘油 磷酸己精 核苷酸 酸 丙酮 (生糖氨基酸) (生翻氨基酸 丙氨酸 充氨酸 异亮氨酸 半胱 酸 →甘氨酸 苯丙氨酸 丙酮酸 酪氨酸 丝氨酸 色额酸 苏额酸 乙酰辅碳A二 酮体 胆 天冬氨酸+ 酰乙酸 →C0H,0,ATP 谷酸 -酮戊二酸 图121糖、脂类、蛋白质和核酸的代谢关系 356
356 以作为合成组氨酸的原料。 另一方面,核酸本身的合成,又受到其他物质特别是蛋白质的影响。例如,甘氨酸、 天冬氨酸、谷氨酰胺是核苷酸合成的原料,参与嘌呤和嘧啶环的合成;核苷酸合成需要酶 和多种蛋白因子的参与等等。但酶和蛋白因子的合成本身又是由基因所控制的。可见核酸 起着决定性的作用。 总的来说,糖、脂肪、蛋白质和核酸等物质在代谢过程中都是彼此影响,相互转化和 密切相关的。糖代谢是各类物质代谢网络的“总枢纽”,通过它将各类物质代谢相互沟通, 紧密联系在一起,而磷酸已糖、丙酮酸、乙酰辅酶 A 在代谢网络中是各类物质转化的重要 中间产物。糖代谢中产生的 ATP、GTP 和 NADPH 等可直接用于其它代谢途径。脂类是生 物能量的主要储存形式,脂类的氧化分解最终进入三羧酸循环,并为机体提供更多的能量。 磷脂和鞘脂是构成生物膜的成分,而且它们的某些中间代谢物具有信息传递的作用。蛋白 质是机体中所有原生质结构的基础,而且作为酶的主要组成成分,决定着各种物质代谢反 应的速度、方向及相互关系。如糖代谢中的磷酸果糖激酶、柠檬酸合酶,脂代谢中的乙酰 CoA 羧化酶等都是代谢中的限速酶。各类物质的主要代谢关系如图 12-1。 图 12-1 糖、脂类、蛋白质和核酸的代谢关系

第二节代谢的调节 代谢调节(metabolic regulation),是生物在长期进化过程中,为适应环境需要而形成 ,其调节系统就愈复杂。在单细胞的微生物中只能 ,称为细胞水平的代谢调节 这为 最原始的调节方式:随者低等的单细胞生物进化到多细胞生物时出现了激素调节(细胞间 调节),激素可以改变细胞内代谢物质的浓度和某些酶的催化能力或含量,从而影响代谢 反应的速度:而高等生物和人类则有了功能更复杂的神经系统,在神经系统的控制下,通 过神经递质直接发生作用,或者改变某些激素的分泌,再通过各种激素相互协调,对整体 代谢进行综合调节。总之,就整个生物界来说,代谢的调节是在醇、细胞、激素和神经这 四个不同水平上进行的 各类调节作用点均在生物活动的最基本单位细胞中。所以细胞内的调节虽然是原始 的,但却是最基本的调节方式,是高级水平的神经和激素调节方式的基础。而且在细胞内 的各举代谢反应都是在酶的催化下讲行的。代谢反应性质、方式、速度,均决定于酶的性 质。细胞内的代谢除受酶的调节外,还包括细胞区域化及能荷的调节。 一、酶水平的调节 代谢反应是由酯催化讲行的,酸水平的调节是最灵敏和最有效的调节。酯水平的调节 也是目前研究得比较多、 了解得比较详细的代谢调节方式。酶水平的调节主要从酶的数量 和酶的活性两个方面影响细胞代谢。 (一)酶数量的调节 酶是生物反应的催化剂,酶的相对数量决定代谢反应的进程和方向。因此,酶本身也 必然受代谢调节的控制。通过酶的合成和降解,细胞内的酶含量和组分便发生变化,因而 对代谢过程起调节作用。生物细胞的这种通过变酶的合成和降解而调节酶的数量,被称 为 “粗调”。通过相调 细胞可以开动 或完全关闭某种酶的合成,或适当调整某种酶的合 成和降解速度,以适应对这种酶的需要 1醇合成的调节 酶是蛋白质,而蛋白质合成是由mRNA编码的,DNA经转录产生mRNA,再翻译成 蛋白质。可见酶合成首先在转录水平上进行调节。 生物体每个细胞都含有该生物整个生长发有过程所必需的遗传信息,但这些遗传信息 不是一下子全部表达出来,而是按其生长发有的需要或受外界条件的影响只表达出一部分 遗传信总,合成相应的蛋白质一酶。特别是当某种酶的底物存在时,便会发生诱导作用 导致作用于该底物酶的合成。这个底物称为诱导物(inducer),由诱导物促进而合成的酶 称为诱导酶(induced enzyme)。例如.大肠杆菌培养基中加入到糖作为唯一的碳源时,大 肠杆菌细胞即生成利用乳糖的醇类。但当培养基中加葡萄糖为唯一碳源时,则它只含有很 少的半乳糖苷酶(一种大肠杆菌利用乳糖的关键性酶) 352
357 第二节 代谢的调节 代谢调节(metabolic regulation),是生物在长期进化过程中,为适应环境需要而形成 的一种生理机能。进化程度愈高的生物,其调节系统就愈复杂。在单细胞的微生物中只能 通过细胞内代谢物浓度的改变来调节某些酶促反应速度,称为细胞水平的代谢调节,这是 最原始的调节方式;随着低等的单细胞生物进化到多细胞生物时出现了激素调节(细胞间 调节),激素可以改变细胞内代谢物质的浓度和某些酶的催化能力或含量,从而影响代谢 反应的速度;而高等生物和人类则有了功能更复杂的神经系统,在神经系统的控制下,通 过神经递质直接发生作用,或者改变某些激素的分泌,再通过各种激素相互协调,对整体 代谢进行综合调节。总之,就整个生物界来说,代谢的调节是在酶、细胞、激素和神经这 四个不同水平上进行的。 各类调节作用点均在生物活动的最基本单位细胞中。所以细胞内的调节虽然是原始 的,但却是最基本的调节方式,是高级水平的神经和激素调节方式的基础。而且在细胞内 的各类代谢反应都是在酶的催化下进行的,代谢反应性质、方式、速度,均决定于酶的性 质。细胞内的代谢除受酶的调节外,还包括细胞区域化及能荷的调节。 一、酶水平的调节 代谢反应是由酶催化进行的,酶水平的调节是最灵敏和最有效的调节。酶水平的调节 也是目前研究得比较多、了解得比较详细的代谢调节方式。酶水平的调节主要从酶的数量 和酶的活性两个方面影响细胞代谢。 (一)酶数量的调节 酶是生物反应的催化剂,酶的相对数量决定代谢反应的进程和方向。因此,酶本身也 必然受代谢调节的控制。通过酶的合成和降解,细胞内的酶含量和组分便发生变化,因而 对代谢过程起调节作用。生物细胞的这种通过改变酶的合成和降解而调节酶的数量,被称 为“粗调”。通过粗调,细胞可以开动或完全关闭某种酶的合成,或适当调整某种酶的合 成和降解速度,以适应对这种酶的需要。 1.酶合成的调节 酶是蛋白质,而蛋白质合成是由 mRNA 编码的,DNA 经转录产生 mRNA,再翻译成 蛋白质。可见酶合成首先在转录水平上进行调节。 生物体每个细胞都含有该生物整个生长发育过程所必需的遗传信息,但这些遗传信息 不是一下子全部表达出来,而是按其生长发育的需要或受外界条件的影响只表达出一部分 遗传信息,合成相应的蛋白质-酶。特别是当某种酶的底物存在时,便会发生诱导作用, 导致作用于该底物酶的合成。这个底物称为诱导物(inducer),由诱导物促进而合成的酶 称为诱导酶(induced enzyme)。例如,大肠杆菌培养基中加入乳糖作为唯一的碳源时,大 肠杆菌细胞即生成利用乳糖的酶类。但当培养基中加葡萄糖为唯一碳源时,则它只含有很 少的半乳糖苷酶(一种大肠杆菌利用乳糖的关键性酶)

与酶合成诱导情形相反的是酶的阻遏(r心pression),即由于某些代谢产物的存在而阻 止细胞内某种酶的合成。例如,将大肠杆菌培养在只含有无机铵盐(NH)及单一碳源(如 简萄糖)中时,大肠杆菌能合成所有的含氨物质,包括合成蛋白质所需要的20种氨基酸。 如色氨酸),则利用NH:和碳源合成色氨 的酶系便 (corepressor). 1961年,F.Jacob和.Mood根据酶合成的诱导和阻遏现象,提出了操纵子学说, 用来说明酶合成的调节。 所谓操纵子(0 o)是指染色体上控制蛋白质(酶)合成的功能单位,它是由一个 或多个功能相关的结构基因和控制基因组成的。这些基因串连排列在染色体上参与转录过 程(图12-2)。结构基因是作为转录成mRNA的模板,以后由mRNA翻译成相应的酶蛋白: 控制基因是由操纵基因和启动基因组成的,操纵基因在结构基因旁边,是被激活阻遏物的 结合位点,由它来开动和关闭合成相应酶的结构基因,启动基因在操纵基因旁边,是RNA 聚合酶结合的位点。在操纵子的前边是产生阳遏蛋白的调节基因。当操纵基因“开动”时, 它管辖的结 基因能通过转录 译而合成某种酶 蛋 当操纵基因“关闭 结构基 因不能合成这种醇蛋白。而操纵基因的“开 与“关 受调节基因产生的阻蛋白的控制 阻遏蛋白可以感受来自外界环境的变化,即受一些小分子诱导物或辅阻遏物的控制。通常 酶合成的诱导物就是酶作用的底物,而辅阻遏物是酶作用的最终产物。这些小分子能以某 种方式与阻谒蛋白分子结合,使阻谒蛋白产生构象变化,从而决定它是否处于活性状态。 5端 几个相关的结构基因 3端 节基因口启动子1纵基因ABc 产生阻遏物 图12-2原核生物操纵子结构模型 (1)酶合成的诱导乳糖操纵子大肠杆菌能够利用乳糖作为它的唯一碳源,这 就要求乳糖进入大肠杆菌细胞内,并将乳糖水解为半乳糖和葡萄糖。大肠杆菌DNA上乳 糖操纵子有三个结构基因,分别决定 种与乳糖降解相关的醇:Z为半乳糖 感为平乳郑葡:Y为半弱,使养中的P半时,水 过E.c0细胞壁和原生质膜而进入细胞内:这两种酶在乳糖利用中是必需的。A为硫代半 乳糖苷转乙酰酶,把乙酰C0A上的乙酰基转到B半乳糖苷上,形成乙酰半乳糖,在乳糖 的利用中并非必需。 研究乳糖操纵子突变体已了解到操纵子的一些工作细节。在没有乳糖时,调节基因通 过转录、译而形成阻遏蛋白,这种有活性的阻過蛋白与操纵基因结合,则操纵基因使“关 闭”,三个分解乳糖的结构基因就不能进行转录,更谈不上翻译合成相应的酶(图12-3)。 358
358 与酶合成诱导情形相反的是酶的阻遏(repression),即由于某些代谢产物的存在而阻 止细胞内某种酶的合成。例如,将大肠杆菌培养在只含有无机铵盐(NH4 +)及单一碳源(如 葡萄糖)中时,大肠杆菌能合成所有的含氮物质,包括合成蛋白质所需要的 20种氨基酸。 但如果在培养基中加入某种氨基酸(如色氨酸),则利用 NH4 +和碳源合成色氨酸的酶系便 迅速消失。这种现象就是酶合成的阻遏作用。阻遏酶生成的物质(色氨酸)称为辅阻遏物 (corepressor)。 1961 年,F.Jacob 和 J.Monod 根据酶合成的诱导和阻遏现象,提出了操纵子学说, 用来说明酶合成的调节。 所谓操纵子(operon)是指染色体上控制蛋白质(酶)合成的功能单位,它是由一个 或多个功能相关的结构基因和控制基因组成的。这些基因串连排列在染色体上参与转录过 程(图 12-2)。结构基因是作为转录成 mRNA 的模板,以后由 mRNA 翻译成相应的酶蛋白; 控制基因是由操纵基因和启动基因组成的,操纵基因在结构基因旁边,是被激活阻遏物的 结合位点,由它来开动和关闭合成相应酶的结构基因,启动基因在操纵基因旁边,是 RNA 聚合酶结合的位点。在操纵子的前边是产生阻遏蛋白的调节基因。当操纵基因“开动”时, 它管辖的结构基因能通过转录和翻译而合成某种酶蛋白;当操纵基因“关闭”时,结构基 因不能合成这种酶蛋白。而操纵基因的“开”与“关”受调节基因产生的阻遏蛋白的控制, 阻遏蛋白可以感受来自外界环境的变化,即受一些小分子诱导物或辅阻遏物的控制。通常 酶合成的诱导物就是酶作用的底物,而辅阻遏物是酶作用的最终产物。这些小分子能以某 种方式与阻遏蛋白分子结合,使阻遏蛋白产生构象变化,从而决定它是否处于活性状态。 5′端 几个相关的结构基因 3′端 产生阻遏物 与阻遏物结合 控制基因开闭 图 12-2 原核生物操纵子结构模型 (1)酶合成的诱导 乳糖操纵子 大肠杆菌能够利用乳糖作为它的唯一碳源,这 就要求乳糖进入大肠杆菌细胞内,并将乳糖水解为半乳糖和葡萄糖。大肠杆菌 DNA 上乳 糖操纵子有三个结构基因,分别决定一种与乳糖降解相关的酶:Z 为半乳糖苷酶,水解乳 糖为半乳糖和葡萄糖;Y 为β-半乳糖苷透性酶,使培养基中的β-半乳糖苷(乳糖)能透 过 E. coli 细胞壁和原生质膜而进入细胞内;这两种酶在乳糖利用中是必需的。A 为硫代半 乳糖苷转乙酰酶,把乙酰 CoA 上的乙酰基转到β-半乳糖苷上,形成乙酰半乳糖,在乳糖 的利用中并非必需。 研究乳糖操纵子突变体已了解到操纵子的一些工作细节。在没有乳糖时,调节基因通 过转录、翻译而形成阻遏蛋白,这种有活性的阻遏蛋白与操纵基因结合,则操纵基因便“关 闭”,三个分解乳糖的结构基因就不能进行转录,更谈不上翻译合成相应的酶(图 12-3a)。 调节基因 启动子 操纵基因 A B C RNA 聚 合酶结合 RNA 聚合 酶结合位点
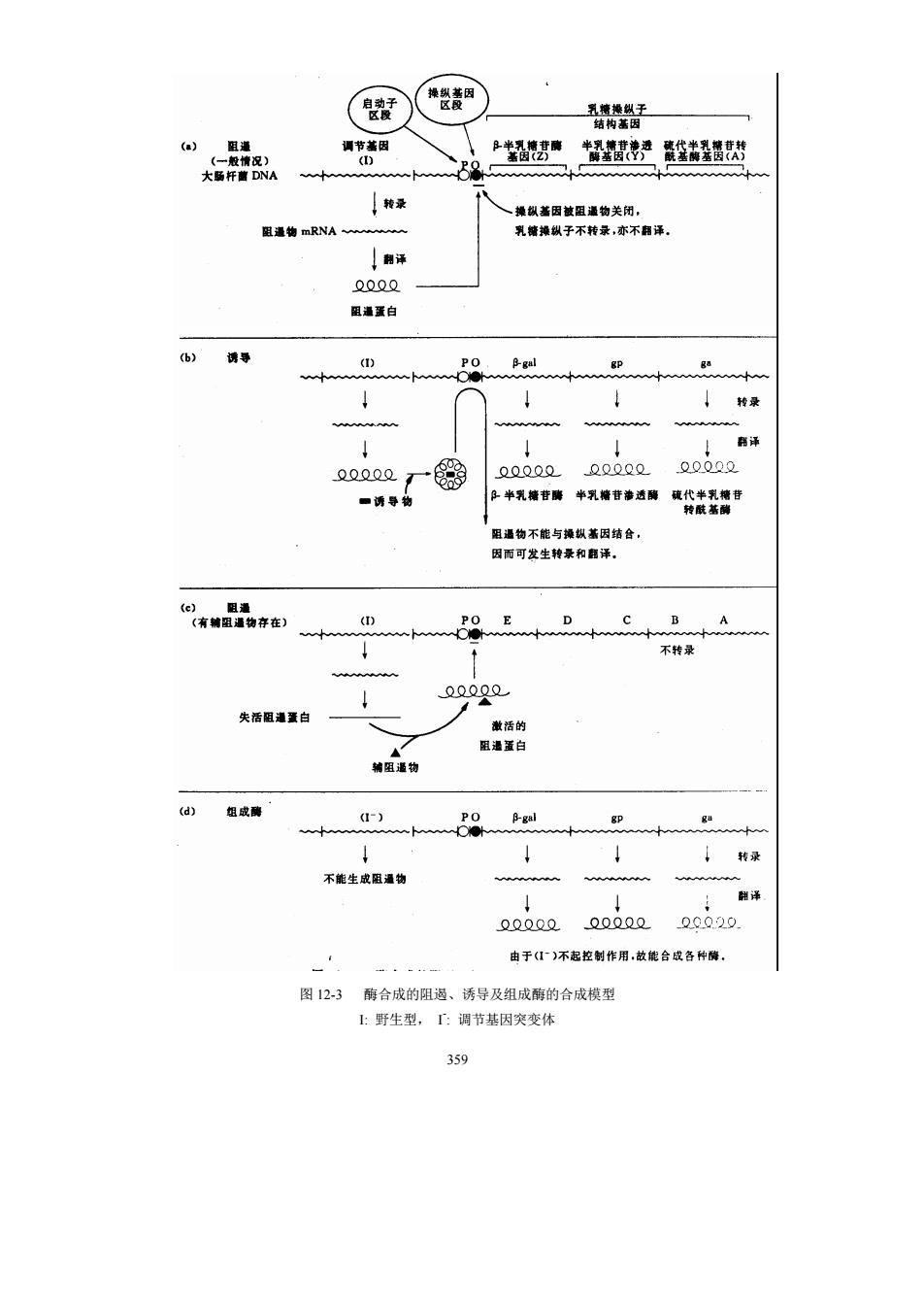
(赞 五格子 艺经整整器 种录 操纵善因被纽递物关阅, 里通物mRNA 乳精操纵于不转录,不有译 泽 9o9o 阻通置白 D PO ↓转录 n厂器 20000Q00Q2 ■诱导物 收价表腰 阻通物不能与换枫盖因结合。 因而可发生转录和翻泽。 有销阻物夺在) B A 不特录 00g0 失活阻速重白 阻通蛋白 精宝适物 (d组忠酶 ↓转录 不能生成阻通物 Q0.000200QQ20.020. 由于1~不起空制作用,故能合成各种酶. 图123酶合成的阻遇、诱导及组成酶的合成模型 1:野生型,:调节基因突变体 359
359 图 12-3 酶合成的阻遏、诱导及组成酶的合成模型 I: 野生型, I - : 调节基因突变体

但是,当大肠杆南培养基中有乳糖时,乳糖就成为锈导物与阻遏蛋白结合,使其空间结构 改变,阻過蛋白处于失活的构象,不能与操纵基因结合,于是操纵基因便“开放”了,这 样结合在启动基因上的RNA聚合酶就可以向前滑动,对三个乳糖结构基因进行转录,并 翻译出三种相应的酶蛋白分子(图12-3b)。 (2)酶合成的阻 色氨酸操纵子 这是调节色氨酸合成的一个操纵子。色氨酸 合成分五步完成,每一步需要一种酶,这五种酶分别是由五个结构基因E、D、C、B、A 编码的,这五个基因彼此相邻,可被转录在一条多顺反子mRNA上,当此多顺反子mRNA 被翻译时,这五种酶依次协调地以等摩尔的量进行合成。翻译在转录完成前即开始。当大 肠杆菌培养基中不含有色氨酸时,色氨酸操纵子前面的调节基因经过转录、翻译而形成没 有活性的阻遏蛋白 不能与操纵基因结合,因而操纵基因便“开放” 就可以转录 并翻译色氨酸操纵子上的五个结构基因,生成色氨酸合成所需要的五种酶。但是,当大肠 杆菌培养基中有色氨酸时,色氨酸作为辅阻遏物与阻遏蛋白结合,使阻遏蛋白由没有活性 的构象变成有活性的构象,能与操纵基因结合,操纵基因便“关闭”,这样就阻碍了RNA 聚合酶与启动基因结合(这里的启动基因与操纵基因有部分重叠),结果不能转录出 mRN 酶的生成也 就停止了(图12 酶合成的诱导和阻遏与基因关系的学说,即操纵子学说已为许多实验证实,并被普过 接受。概括来讲,阻遏物与操纵基因结合导致结构基因不转录。阻遏物又有两种状态:激 活态和失活态。激活态的阻過物与诱导物结合后失活,导致酶的诱导合成:失活态的阻過 物与铺阻谒物结合后被激活,导致酶合成的阻调。这种调节是负调节作用 (3)组成 当调节基因发生突变时形成的阻遏蛋白失去与操纵基因结合的功能 结果是不管需要与否 都合成相应的酶(图12-3d) 种酶称为组成酶。 这种突变体称为 组成突变体。与此相对的,如果调节基因发生突变产生的阻遏物失去与诱导物结合的能力, 那么即使有透导物存在,也不发生透导作用,这种突变体称为超阻遏突变体。 (4)分解代谢阻遏作用当用含有葡萄糖和乳糖的培养基作为碳源培养大肠杆茵时, 在葡萄糖没有被利用完之前,菌体内B,半乳糖苷酶的合成便受阻遏,这是因为葡萄糖的降 湿物 te 通过降低胞 cAMP )的含量,阻 了这 的诱导 这种阻過称为分解代谢阻遏作用。现己知道,环腺苷酸在酶合成调节中起重要作用。在这 里调节基因的产物为cAMP受体蛋白(cAMP receptor protein,CRP),也称降解物基因活化 蛋白(catabolite gene activator protein,.CAP)。与前述负调节方式不同,CAP起的是正调节 作用。当它与CAMP结合并被激活,CAP-CAMP复合物结合到启动子上,并助RNA系 合酶有效地与启动子结合, 促进转录进行(图124) (5)衰减作用除了调节基因产物对转录的正、负调控(如CAP蛋白和阻遏蛋白》 之外,还有另一种在转录水平上调节基因表达的衰减作用(attenuation),用以终止和减 弱转录。在基因上这种调节的作用部位称为衰减子(attenuator),衰减子是一种位于结构 基因上游前导区的终止序列,该机制首先是从色氨酸操纵子的研究中弄清持的。目前已知 除色氨酸外,其它许多与氨基酸代谢相关的操纵子的有关基因中都存在衰减子的调节位 点 360
360 但是,当大肠杆菌培养基中有乳糖时,乳糖就成为诱导物与阻遏蛋白结合,使其空间结构 改变,阻遏蛋白处于失活的构象,不能与操纵基因结合,于是操纵基因便“开放”了,这 样结合在启动基因上的 RNA 聚合酶就可以向前滑动,对三个乳糖结构基因进行转录,并 翻译出三种相应的酶蛋白分子(图 12-3b)。 (2)酶合成的阻遏 色氨酸操纵子 这是调节色氨酸合成的一个操纵子。色氨酸 合成分五步完成,每一步需要一种酶,这五种酶分别是由五个结构基因 E、D、C、B、A 编码的,这五个基因彼此相邻,可被转录在一条多顺反子 mRNA 上,当此多顺反子 mRNA 被翻译时,这五种酶依次协调地以等摩尔的量进行合成。翻译在转录完成前即开始。当大 肠杆菌培养基中不含有色氨酸时,色氨酸操纵子前面的调节基因经过转录、翻译而形成没 有活性的阻遏蛋白,不能与操纵基因结合,因而操纵基因便“开放”,这样就可以转录, 并翻译色氨酸操纵子上的五个结构基因,生成色氨酸合成所需要的五种酶。但是,当大肠 杆菌培养基中有色氨酸时,色氨酸作为辅阻遏物与阻遏蛋白结合,使阻遏蛋白由没有活性 的构象变成有活性的构象,能与操纵基因结合,操纵基因便“关闭”,这样就阻碍了 RNA 聚合酶与启动基因结合(这里的启动基因与操纵基因有部分重叠),结果不能转录出 mRNA,酶的生成也就停止了(图 12-3c)。 酶合成的诱导和阻遏与基因关系的学说,即操纵子学说已为许多实验证实,并被普遍 接受。概括来讲,阻遏物与操纵基因结合导致结构基因不转录。阻遏物又有两种状态:激 活态和失活态。激活态的阻遏物与诱导物结合后失活,导致酶的诱导合成;失活态的阻遏 物与辅阻遏物结合后被激活,导致酶合成的阻遏。这种调节是负调节作用。 (3)组成酶 当调节基因发生突变时形成的阻遏蛋白失去与操纵基因结合的功能, 结果是不管需要与否,都合成相应的酶(图 12-3d),这种酶称为组成酶。这种突变体称为 组成突变体。与此相对的,如果调节基因发生突变产生的阻遏物失去与诱导物结合的能力, 那么即使有诱导物存在,也不发生诱导作用,这种突变体称为超阻遏突变体。 (4)分解代谢阻遏作用 当用含有葡萄糖和乳糖的培养基作为碳源培养大肠杆菌时, 在葡萄糖没有被利用完之前,菌体内β-半乳糖苷酶的合成便受阻遏,这是因为葡萄糖的降 解物(catabolite)通过降低胞内环腺苷酸(cAMP)的含量,阻遏了这三种酶的诱导合成, 这种阻遏称为分解代谢阻遏作用。现已知道,环腺苷酸在酶合成调节中起重要作用。在这 里调节基因的产物为 cAMP 受体蛋白(cAMP receptor protein, CRP),也称降解物基因活化 蛋白(catabolite gene activator protein,CAP)。与前述负调节方式不同,CAP 起的是正调节 作用。当它与 cAMP 结合并被激活,CAP-cAMP 复合物结合到启动子上,并帮助 RNA 聚 合酶有效地与启动子结合,促进转录进行(图 12-4)。 (5)衰减作用 除了调节基因产物对转录的正、负调控(如CAP蛋白和阻遏蛋白) 之外,还有另一种在转录水平上调节基因表达的衰减作用(attenuation),用以终止和减 弱转录。在基因上这种调节的作用部位称为衰减子(attenuator),衰减子是一种位于结构 基因上游前导区的终止序列,该机制首先是从色氨酸操纵子的研究中弄清楚的。目前已知 除色氨酸外,其它许多与氨基酸代谢相关的操纵子的有关基因中都存在衰减子的调节位 点

CAP苦 0操纵子 结构因 储公金 0鲨 白 0Q0Q0000Q000 图124降解物基因活化蛋白(CAP)在酶合成中的正调控 除转录水平能调节酶的数量外,在转录产物的加工和运输及翻译水平上同样可以调节 酶的数量。如真核生物mRNA转录后的加工,mRNA由细胞核向细胞质的运输,mRNA 在细胞中的定位和组装等过程是基因表达重要的调节步骤:翻译水平上mRNA通过本身 核苷酸组成和排列(如SD序列),反义RNA的活性,mRNA的稳定性等讲行调节。 2.酶降解的调节 酶合成的诱导和阻遏作用可以调节酶的数量,相反酶的降解速度也能调节细胞内酶的 含量。酶的降解是由特异的蛋白质水解酶催化的。在细胞内常含有各种水解酶,其水解生 白质的种类和速度随细胞的生长状态和环境条件而不断变化。如大肠杆菌在指数生长期, 蛋白酶的总活性较低,但当大肠杆菌由于营养缺乏而处于静止期时,便诱导合成蛋白水解 酶,分解细胞内不需要的蛋白质:植物种子在萌发时蛋白酶的合成速度也明显增加,用于 分解种子中的贮藏蛋白质供幼苗生长之用。 细胞内酶的数量决定于其合成速度与降解速度的比值,是多种因素综合作用的结果。 酶数量的多少受基因转录和翻译的控制,是比较缓慢的过程,需数小时才能完成,所以称 为“粗调”。细胞内还有更直接更迅速的调节方式,即酶活性的调节。 (二)酶活性的调节 酸活性的调节包括酸原激活、酯的共价修饰、反馈抑制及前馈激活第方面 1.酶原激活 在细胞内首先合成无活性酶的前体(酶原),再通过蛋白酶的作用释放出一些氨基酸 或小肽,转变成有活性的酶蛋白, 一村积称为原激活(a ngen)。在匠 激活是不可逆的过程。 凝乳蛋白原是由245个氨基酸残基组成的单链酶蛋白 链内有五对二硫健,这条肽链不具有酶活性。当酶原经胰蛋白酶作用,切断Ag1s和l©: 之间的肽键,就转变成有活性的π胰凝乳蛋白酶,再通过π胰凝乳蛋白酶的自身作用, 切去一段二肽(Ser1和Arg15),生成6-胰凝乳蛋白酶,进而切去一段二肽(Thr147和Asm14s) 后转变成更加稳定且具有活性的ā-胰凝乳蛋白酶,肽链本身也从单链转变成三链结构
361 图12-4 降解物基因活化蛋白(CAP)在酶合成中的正调控 除转录水平能调节酶的数量外,在转录产物的加工和运输及翻译水平上同样可以调节 酶的数量。如真核生物 mRNA 转录后的加工,mRNA 由细胞核向细胞质的运输,mRNA 在细胞中的定位和组装等过程是基因表达重要的调节步骤;翻译水平上 mRNA 通过本身 核苷酸组成和排列(如 SD 序列),反义 RNA 的活性,mRNA 的稳定性等进行调节。 2.酶降解的调节 酶合成的诱导和阻遏作用可以调节酶的数量,相反酶的降解速度也能调节细胞内酶的 含量。酶的降解是由特异的蛋白质水解酶催化的。在细胞内常含有各种水解酶,其水解蛋 白质的种类和速度随细胞的生长状态和环境条件而不断变化。如大肠杆菌在指数生长期, 蛋白酶的总活性较低,但当大肠杆菌由于营养缺乏而处于静止期时,便诱导合成蛋白水解 酶,分解细胞内不需要的蛋白质;植物种子在萌发时蛋白酶的合成速度也明显增加,用于 分解种子中的贮藏蛋白质供幼苗生长之用。 细胞内酶的数量决定于其合成速度与降解速度的比值,是多种因素综合作用的结果。 酶数量的多少受基因转录和翻译的控制,是比较缓慢的过程,需数小时才能完成,所以称 为“粗调”。细胞内还有更直接更迅速的调节方式,即酶活性的调节。 (二)酶活性的调节 酶活性的调节包括酶原激活、酶的共价修饰、反馈抑制及前馈激活等方面。 1. 酶原激活 在细胞内首先合成无活性酶的前体(酶原),再通过蛋白酶的作用释放出一些氨基酸 或小肽,转变成有活性的酶蛋白,这一过程称为酶原激活(activation of zymogen)。酶原 激活是不可逆的过程。例如,胰凝乳蛋白酶原是由245个氨基酸残基组成的单链酶蛋白, 链内有五对二硫键,这条肽链不具有酶活性。当酶原经胰蛋白酶作用,切断Arg15和Ile16 之间的肽键,就转变成有活性的π-胰凝乳蛋白酶,再通过π-胰凝乳蛋白酶的自身作用, 切去一段二肽(Ser14和Arg15),生成δ-胰凝乳蛋白酶,进而切去一段二肽(Thr147和Asn148) 后转变成更加稳定且具有活性的α-胰凝乳蛋白酶,肽链本身也从单链转变成三链结构

2.酶的化学修饰 在酶的化学修饰中比价修饰占右重要地位。地价修饰(covalent m0 dificati0n)是指在 专一酶的催化下,某种小分子基团可以共价结合到被修饰酶的特定氨基酸残基上,而改变 酶的活性。共价修饰是可逆过程,小分子基团可在酶的催化下水解去除,发生逆转。表121 列出了一些可被化学修饰调节的酶。 表12-1一些可被化学修饰调节的酶 酶名称 修饰机理 变化 睛原磷酸化酶 陵酸化/脱磷酸化 增加/降低 磷酸化激酶 磷酸化/脱磷酸化 增加/降化 熊原合成酶 磷酸化/脱磷酸化 降低/增加 丙酮酸脱氢酶 磷酸化/脱磷酸化 增加/降低 谷氨酰胺合成 腺苷酰化/脱腺苷酰化 降低/增加 原酸化砖是酶很化学修饰的曲刑例子。原作为性牌水化合物,广存在于 人和动物体内。糖原在糖原磷酸化酶作用下发生磷酸解产 磷酸萄萄糖。此酶有两种形 式:即有活性的磷酸化酶a和无活性的磷酸化酶b,二者可以互相转变。磷酸化酶b在 磷酸化酶b激酶催化下,接受ATP上的磷酸基团转变为磷酸化酶a而活化:磷酸化酶a也 可在磷酸化酶磷酸(酯)酶催化下转变为磷酸化酶b而失活。酶被修饰的基团是丝氨 酸的轻基。 磷酸化酶b ATP- Pi 酸化酶b激南 人磷酸化酶a磷酸酯酶 ADp¥ 酶促化学修饰反应往往是多个反应配合进行的。在生物体内,有些反应是连锁进行的 在这些连锁反应中,一个酶被修饰后,连续地发生其他酶被激活,导致原始调节因素的效 率逐级放大,这样的连锁代谢反应系统叫级联放大反应或级联系统(cascade system)。如 肾上腺素或胰高血糖素对磷酸化酶b激酶的激活就屈这种类型。激素把改变细胞生理活 动的信息传递给细胞膜上的受体,激素与受体结合后使腺苷酸环化酶活化,由腺苷酸环化 薛催化ATP生成cAMP:再把这一信息传递给细胞内的某些蛋白 质或酶系统,在这里是依 赖于cAMP的蛋白激酶A(protein kinaseA,PKA)。因此将激素称为第一信使,而将cAM 称为第二信使。活化的蛋白激酶A使碳酸化酶b激酶激活:磷酸化酶b激酶又使碳酸化 酶b转变为激活态磷酸化酶a:磷酸化酶a使糖原分解为1磷酸葡萄糖。这样,由激 素的作用开始,最后导致糖原的分解。上述一系列变化便构成一个“级联系统”,可用图 12-5表示。 362
362 2. 酶的化学修饰 在酶的化学修饰中共价修饰占有重要地位。共价修饰(covalent modification)是指在 专一酶的催化下,某种小分子基团可以共价结合到被修饰酶的特定氨基酸残基上,而改变 酶的活性。共价修饰是可逆过程,小分子基团可在酶的催化下水解去除,发生逆转。表12-1 列出了一些可被化学修饰调节的酶。 表12-1一些可被化学修饰调节的酶 酶名称 修饰机理 变 化 糖原磷酸化酶 磷酸化/脱磷酸化 增加/降低 磷酸化酶b激酶 磷酸化/脱磷酸化 增加/降化 糖原合成酶 磷酸化/脱磷酸化 降低/增加 丙酮酸脱氢酶 磷酸化/脱磷酸化 增加/降低 谷氨酰胺合成酶 腺苷酰化/脱腺苷酰化 降低/增加 糖原磷酸化酶是酶促化学修饰的典型例子。糖原作为贮藏性碳水化合物,广泛存在于 人和动物体内。糖原在糖原磷酸化酶作用下发生磷酸解产生1-磷酸葡萄糖。此酶有两种形 式:即有活性的磷酸化酶 a和无活性的磷酸化酶 b,二者可以互相转变。磷酸化酶 b 在 磷酸化酶 b 激酶催化下,接受ATP上的磷酸基团转变为磷酸化酶a而活化;磷酸化酶 a 也 可在磷酸化酶 a 磷酸(酯)酶催化下转变为磷酸化酶 b 而失活。酶被修饰的基团是丝氨 酸的羟基。 磷酸化酶 b ATP Pi 磷酸化酶 b 激酶 磷酸化酶 a 磷酸酯酶 ADP H2O 磷酸化酶 a 酶促化学修饰反应往往是多个反应配合进行的。在生物体内,有些反应是连锁进行的。 在这些连锁反应中,一个酶被修饰后,连续地发生其他酶被激活,导致原始调节因素的效 率逐级放大,这样的连锁代谢反应系统叫级联放大反应或级联系统(cascade system)。如 肾上腺素或胰高血糖素对磷酸化酶 b 激酶的激活就属这种类型。激素把改变细胞生理活 动的信息传递给细胞膜上的受体,激素与受体结合后使腺苷酸环化酶活化,由腺苷酸环化 酶催化ATP生成cAMP;再把这一信息传递给细胞内的某些蛋白质或酶系统,在这里是依 赖于cAMP的蛋白激酶A(protein kinase A,PKA)。因此将激素称为第一信使,而将cAMP 称为第二信使。活化的蛋白激酶A使磷酸化酶 b激酶激活;磷酸化酶 b 激酶又使磷酸化 酶 b 转变为激活态磷酸化酶 a ;磷酸化酶 a 使糖原分解为1-磷酸葡萄糖。这样,由激 素的作用开始,最后导致糖原的分解。上述一系列变化便构成一个“级联系统”,可用图 12-5表示

肾上腺素(或胰高血糖素) 除凭化所÷除苷酸环化降(有活性) ATPcAMP+PPi(10 蛋白激酶(无活力)一蛋白激酶(有活力)(10 黄税光市磷酸紫学黄P(10的 院石州雾( 糖原一1磷酸葡萄糖 图125磷酸化酶激活的级联放大反应 在这些连锁的酶促反应过程中,前一反应的产物是后一反应的催化剂,每进行一次共 价修饰反应 就 次放大,如果假 每一级反应放大10倍,即1个餐分子引起100个 分子发生反应(实际上,酶的转换数比这大得多),那么从激素促进cAMP生成的反应开 始,到磷酸化酶生成为止,经过四次放大后,调节效应就放大了10倍了。由此可见, 极微量的激素对酶活性控制是十分灵敏的。 3。反情物制 反馈现象是普遍存在的。简单来说 种运动的效果对这 的影响就是反馈,通 常区分为“正反馈”和“负反馈”,凡是一种运动的效果对于这种原始运动的影响是促进 性的称为正反馈:反之,所发生抑制性的影响称为负反馈 在细胞内当一个酶促反应产物积累过多时,由于质量作用定律的关系,能抑制其本身 的合成,这种抑制属简单的抑制,它不牵涉到酶结构的改变。如ā一淀粉酶催化淀粉水解 成麦芽糖,过多的麦芽糖能够抑制α一淀粉酶的活性,使淀粉水解的速度下降。又如己糖 激酶催化葡萄糖转变为6 磷酸葡萄糖的反应中 当后者积累过多 更减慢。但是在 多个酶促系列反应中,终产物可对反应序列前头的酶发生和制作用,这称为反赏抑串 (feedback inhibition).这种反馈抑制作用是改变疼蛋白构象的结果。通常受控制的疼是反 应系列开头的醇,是一种调节酶或变构酶,有时也叫“标兵醇”(pacemaker enzyme),因 为整个反应序列是受这个酶调节的。如糖酵解中的磷酸果糖激酶是控制糖酵解的标兵酶。 又如,在大肠杆菌中。 由于天冬氨酸和氨基甲酰磷酸合成胞苷三磷酸(CTP 的反应 H 受CTP反馈调节的(图12-6)。当CTP的代谢利用较低时,CTP便在细胞内积累,这时 CTP便对这个反应序列的开头的酶即天冬氨酸转氨基甲酰酶起反馈抑制作用,结果抑制 CTP本身的生成:反之,如果CTP被高度利用,这时CTP在细胞内不积累,也就不起反 馈抑制调节,反应继续进行以生成所需要的CTP。 363
363 肾上腺素(或胰高血糖素) ↓ 腺苷酸环化酶 → 腺苷酸环化酶(有活性) (无活性) ↓ ATP → cAMP + PPi ( 10 2) ↓ 蛋白激酶(无活力)→蛋白激酶(有活力) ( 10 4) ↓ 磷酸化酶激酶 磷酸化酶激酶-P ( 10 6) (无活性) ATP ADP (有活性) ↓ 磷酸化酶 b 磷酸化酶 a ( 10 8) (无活性) ATP ADP (有活性) ↓ 糖原 → 1-磷酸葡萄糖 图12-5 磷酸化酶激活的级联放大反应 在这些连锁的酶促反应过程中,前一反应的产物是后一反应的催化剂,每进行一次共 价修饰反应,就产生一次放大,如果假设每一级反应放大100倍,即1个酶分子引起100个 分子发生反应(实际上,酶的转换数比这大得多),那么从激素促进cAMP生成的反应开 始,到磷酸化酶 a 生成为止,经过四次放大后,调节效应就放大了10 8倍了。由此可见, 极微量的激素对酶活性控制是十分灵敏的。 3.反馈抑制 反馈现象是普遍存在的。简单来说,一种运动的效果对这种运动的影响就是反馈,通 常区分为“正反馈”和“负反馈”,凡是一种运动的效果对于这种原始运动的影响是促进 性的称为正反馈;反之,所发生抑制性的影响称为负反馈。 在细胞内当一个酶促反应产物积累过多时,由于质量作用定律的关系,能抑制其本身 的合成,这种抑制属简单的抑制,它不牵涉到酶结构的改变。如α-淀粉酶催化淀粉水解 成麦芽糖,过多的麦芽糖能够抑制α-淀粉酶的活性,使淀粉水解的速度下降。又如己糖 激酶催化葡萄糖转变为 6-磷酸葡萄糖的反应中,当后者积累过多时,反应便减慢。但是在 多个酶促系列反应中,终产物可对反应序列前头的酶发生抑制作用,这称为反馈抑制 (feedback inhibition).这种反馈抑制作用是改变酶蛋白构象的结果。通常受控制的酶是反 应系列开头的酶,是一种调节酶或变构酶,有时也叫“标兵酶”(pacemaker enzyme),因 为整个反应序列是受这个酶调节的。如糖酵解中的磷酸果糖激酶是控制糖酵解的标兵酶。 又如,在大肠杆菌中,由于天冬氨酸和氨基甲酰磷酸合成胞苷三磷酸(CTP)的反应,是 受 CTP 反馈调节的(图 12-6)。当 CTP 的代谢利用较低时,CTP 便在细胞内积累,这时 CTP 便对这个反应序列的开头的酶即天冬氨酸转氨基甲酰酶起反馈抑制作用,结果抑制 CTP 本身的生成;反之,如果 CTP 被高度利用,这时 CTP 在细胞内不积累,也就不起反 馈抑制调节,反应继续进行以生成所需要的 CTP