
2)混合实际气体中组分化学势 纯B:B(T,P)=μB(T)+RTL fB=YBPB 混合物:业B(T,P)=ug9(T)+RTnA fe =YePe 路易斯一伦道尔近似公式:fB=fBxB ∫B:混合实气中,B组分的逸度 fB: 纯态B处于混合实气的T和P下, B组分单独存在时的逸度
1 2)混合实际气体中组分化学势 纯 B:μB (T,P)=μB θ (T)+ RTLn P f B B B PB f = 混合物:μB (T,P)=μB θ (T)+ RTLn P f B B B PB f = 路易斯—伦道尔近似公式: B B B f f x = B f :混合实气中,B 组分的逸度 B f : 纯态 B 处于混合实气的 T 和 P 下, B 组分单独存在时的逸度

X:B组分在混合实气中的摩尔分数 可由相同T,P下纯态B的f与B在 混合实际气体中的摩尔分数,计算混合 实际气体中B在T,P下的逸度fB 虽然近似,适用许多气体 ∫B:B组分在T和混合总压P时的逸度 fB:B组分在T和混合压力P时纯态下的逸度 fB=fBXB=YaPXE≈YBPa 适用:低压 2
2 虽然近似,适用许多气体 f B B P = B f :B 组分在 T 和混合总压 P 时的逸度 B f : B 组分在 T 和混合压力 P 时纯态下的逸度 B B B B PxB B PB f f x = = 适用:低压 XB:B 组分在混合实气中的摩尔分数 可由相同 T,P 下纯态 B 的 B f 与 B 在 混合实际气体中的摩尔分数,计算混合 实际气体中 B 在 T,P 下的逸度 B f

fB计算: a)B组分在混合气总压P,T→兀,日→YB b)fe=J8xB,f8=YBP,fe =Y8PB 例:在400℃,30397KPa下,合成甲醇反应 CO (g)+2H20 (g)-CHOH (g) 已知Tc,Pc,求Yco,YH,0,YcH,oH 由T,P→,兀→YB 说明:适用混合实气总压P<100P=10Pa
3 B f 计算: a)B 组分在混合气总压 P,T→π,θ→γB ° b) , B B B f f x = B B B B PB f P f = , = 例:在 400℃,30397KPa 下,合成甲醇反应 CO(g) + 2H2 O(g)→ CH3 OH(g) 已知 TC ,PC ,求 CO H2 O CH3 O H , , 由 T,P→θ,π→γB 说明:适用混合实气总压 P<100Pθ=104 Pa

§3.2稀溶液中的两个经验定律 1.拉乌尔定律(Raoult) 100℃水,饱和蒸汽压P*=P9=100KPa 加入NaCl,P〈P* 1887年,拉鸟尔提出定量关系: PA=P*XA PA:溶液中溶剂的蒸汽压 P*A:纯溶剂的蒸汽压 X4:溶液中溶剂A的摩尔分数 4
4 §3.2 稀溶液中的两个经验定律 1.拉乌尔定律(Raoult) 100℃水,饱和蒸汽压 P*=Pθ=100KPa 加入 NaCl,P < P* 1887 年,拉乌尔提出定量关系: PA:溶液中溶剂的蒸汽压 P*A:纯溶剂的蒸汽压 XA:溶液中溶剂 A 的摩尔分数 PA =P*AXA
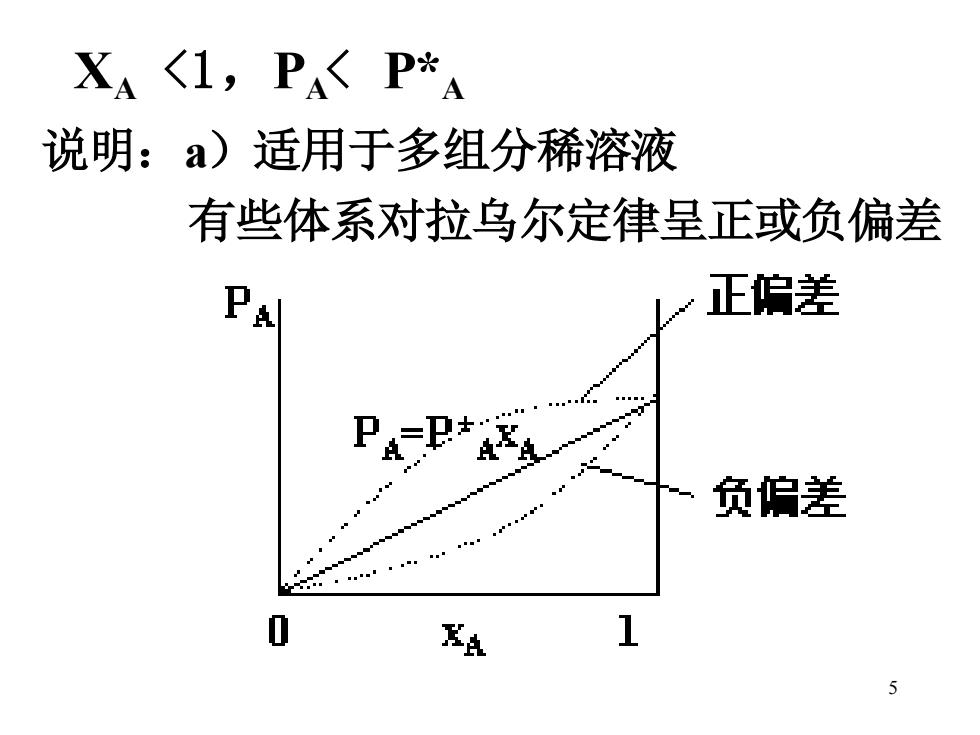
XA〈1,PP*A 说明:a)适用于多组分稀溶液 有些体系对拉乌尔定律呈正或负偏差 正偏姜 负伯差 尽点 1 5
5 XA <1,PA < P*A 说明:a)适用于多组分稀溶液 有些体系对拉乌尔定律呈正或负偏差

b)若溶质也是挥发的,溶剂和溶质都符合拉 鸟尔定律 PA=PRAXA PB-P*EXE 9 P=PA+PB 理想液体混合物 如:苯一甲苯 c)另一种形式 P*A-PP*A-P*AXA=P*AXB P-P=x 适用:溶质浓度 P m.≤0.01 molKg 6
6 b)若溶质也是挥发的,溶剂和溶质都符合拉 乌尔定律 PA =P*AXA PB =P*BXB P= PA + PB ——理想液体混合物 如:苯—甲苯 c)另一种形式 P*A- PA = P*A- P*A XA = P*A XB B A A A x P P P = − * * 适用:溶质浓度 mB≤0.01molKg-1

d) 求非挥发性溶质的分子量M 稀液:nA》nB PA-PA =XB≈ nB二 We /M B P nA W M MR- WEMA PA P-PA 注意:溶质为非缔合分子
7 d)求非挥发性溶质的分子量 MB A A B B A B B A A A W M W M n n x P P P / / * * = = − A A A A B A B P P P W W M M − = * 注意:溶质为非缔合分子 稀液:nA 》nB

2.亨利定律(1808年) 定义:在一定温度的稀溶液中,当气液达平 衡时,挥发性溶质在气相中的分压与其在溶 液中的溶解度成正比 PB-KxXB P:平衡时溶液中挥发物质的分压 x:挥发溶质在溶剂中的摩尔分数 K、:亨利系数,与T,P,溶剂及溶质的性质有关 说明:a)适用稀溶液,且越稀越好 8
8 2. 亨利定律(1808 年) 定义:在一定温度的稀溶液中,当气液达平 衡时,挥发性溶质在气相中的分压与其在溶 液中的溶解度成正比 PB:平衡时溶液中挥发物质的分压 xB:挥发溶质在溶剂中的摩尔分数 Kx:亨利系数,与 T,P,溶剂及溶质的性质有关 说明:a)适用稀溶液,且越稀越好 PB =KX xB

b)溶质B在气相和液相的分子状态相同 如:溶质HC1苯:HCI适用 水:H,C,不适用 c)溶质浓度不同,K值也不同 PB-KXB-KmB-KCCB K≠Km≠Kc d)适合混合气体的溶解,每种气体都 符合亨利定律
9 b)溶质 B 在气相和液相的分子状态相同 如:溶质 HCl 苯:HCl 适用 水:H + ,Cl- ,不适用 c)溶质浓度不同,KH值也不同 PB =Kx xB =Km mB =KC CB Kx≠Km≠KC d)适合混合气体的溶解,每种气体都 符合亨利定律

§3.3理想液体混合物中组分的化学势 1.理想液体混合物的定义 在一定温度下,每个组分在全部浓度范 围内都遵守拉乌尔定律,且每种组分的气体 视为理想气体 微观:分子大小相同,分子间作用力相同 特点:a)各组分性质相似,化学结构相似 b)分子间作用力相似 A-A=A-B=B-B 理想液体混合物是客观存在的 10
10 §3.3 理想液体混合物中组分的化学势 1. 理想液体混合物的定义 在一定温度下,每个组分在全部浓度范 围内都遵守拉乌尔定律,且每种组分的气体 视为理想气体 微观:分子大小相同,分子间作用力相同 特点:a)各组分性质相似,化学结构相似 b)分子间作用力相似 A-A=A-B=B-B 理想液体混合物是客观存在的