
06 §7.4基元反应的反应速率理论简介 反应速率的理论很多,但都不够完满。其中 研究较多,对部分反应较成熟的速率理论有两个: 10 简单碰撞理论—氵 在分子运动论基础上, 以硬球碰撞为模型,也叫硬球碰撞理论。 ②过渡态理论一在统计热力学、量子力学 基础上发展起来的速率理论

107 简单碰撞理论(1918) Leuis研究双分子、气相基元反应,得到了 与阿氏公式相似的公式。 (1)基本观点: a)把分子看成刚球,无内部运动,分子接触碰撞 才有可能起反应。 实际分子接近时斥力加大,就改变方向使分子远 离,即完成一次碰撞。两分子所能达到的最小距 离称为碰撞直径(有效直径),碰撞直径稍大于 分子直径(或稍大于两分子的半径和)

108 b)只有活性分子碰撞才能反应。活性分子是 指高能量的分子,或称激烈碰撞才能反应,这 种能发生反应的激烈碰撞一一称作有效碰撞。 有效碰撞率(q):有效碰撞占总碰撞的分数 (碰撞分数),不发生反应的碰撞只传递能量。 ©)发生碰撞的两个分子沿质心连线方向上的相 对平动能超过一定值(E。)时才是有效碰撞。 Ec:临界能,或称阈能

109 不同的反应有不同阈能。相对平动能≥E。时 才是有效碰撞。 两个分子的运动方向都在质心连线方向时为 迎头碰撞,这时体系总的相对平动能与质心连 线方向的相对平动能相同:否则应修正成质心 连线方向的相对平动能。碰撞后能否发生反 应,只取决于质心连线方向上的相对平动能是 否大于Ec
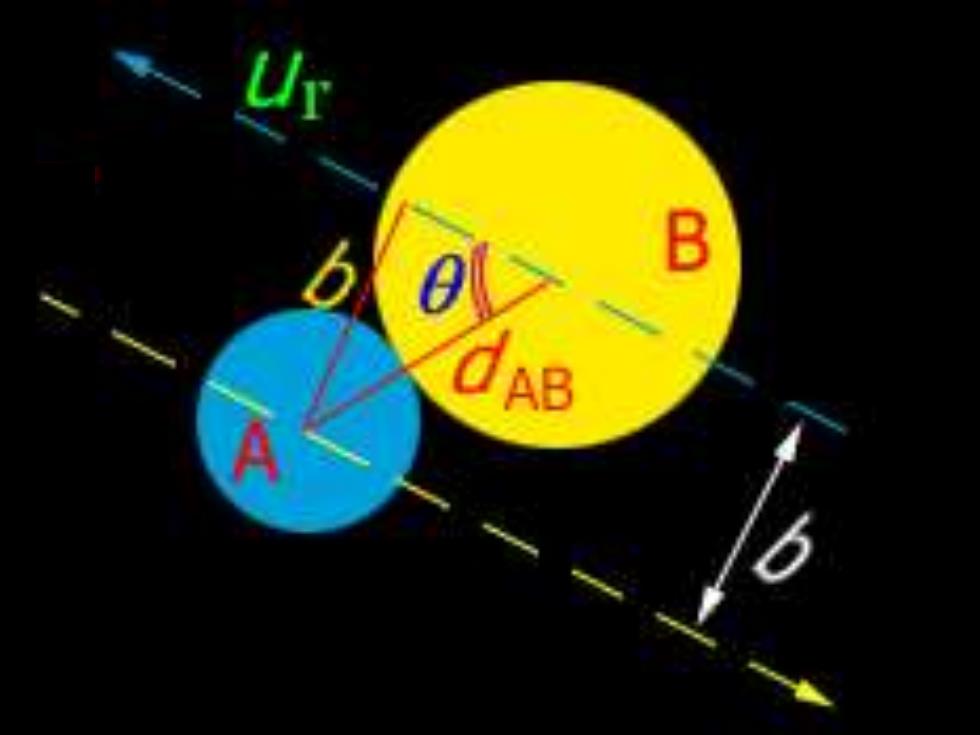
AB

(2)具体推算 111 a)t 碰撞频率乙AB:单位时间,单位体积内分子的 碰撞次数为碰撞频率。 例:A+B→P (气相基元反应) 单位体积内的分子数目(密度):nA,ns 分子半径:rA,B 平均运动速度:uA,uB 有效碰撞直径:d=ra+rB 碰撞截面:6=πd d为两分子刚好碰撞的距离

11 若B分子不动,A以uA的速度运动,在单位时 间内πduA的圆筒内的所有B分子都与这 个A分子碰撞了,即一秒钟内一个A分子与 B分子的碰撞次数为:πduA·ng 0 单位体积内na个A分子的碰撞次数为 元dua.nA·ngo 实际上B也在运动,若以AB的相对运动速 度代替uA,则表示AB都在运动的碰撞次数 了(相当于把坐标原点设在B分子上)

113 A、B分子间的相对运动速度与它们 的运动方向有关。有三种极端情况: 0° B .180° B UAB -UA-UB, UAB =UA UB UAB-V U -UB 虽然粒子的运动方向各不相同,但可 以认为其运动方向的平均值是90°的直角。 由分子运动论知,气相分子的平均运动速度 8kT 8kT 兀1m 元mA 元mB UAB m mB

114 代入后可得碰撞频率为: ZAB=元.d'.nA.nB 8kT mB 若反应为 A+AP:-1 8 RT 为避免重复计算除以2。则 -2

115 b)有效碰撞频率ZAs*: 令q为有效碰撞数占总碰撞数的分数 ZAB*-ZAB.q 根据气体分子运动论的推导和Boltzmann 分布定律,体系中能量高于E。的分子 所占的分数为 N* N RT