
01 第七章化学动力学 绪论: 化学热力学 化学动力学 化学反应的速率 化学反应的机理

02 298K时 (1)H(g)+20,(g)→H,00 △,G盘=-273.19KJ.mol (2)HCl(sIn)+NaOH(sln)-NaCl(sIn)+H,O(sIn) △,Gt2=-79.91KJ.mol
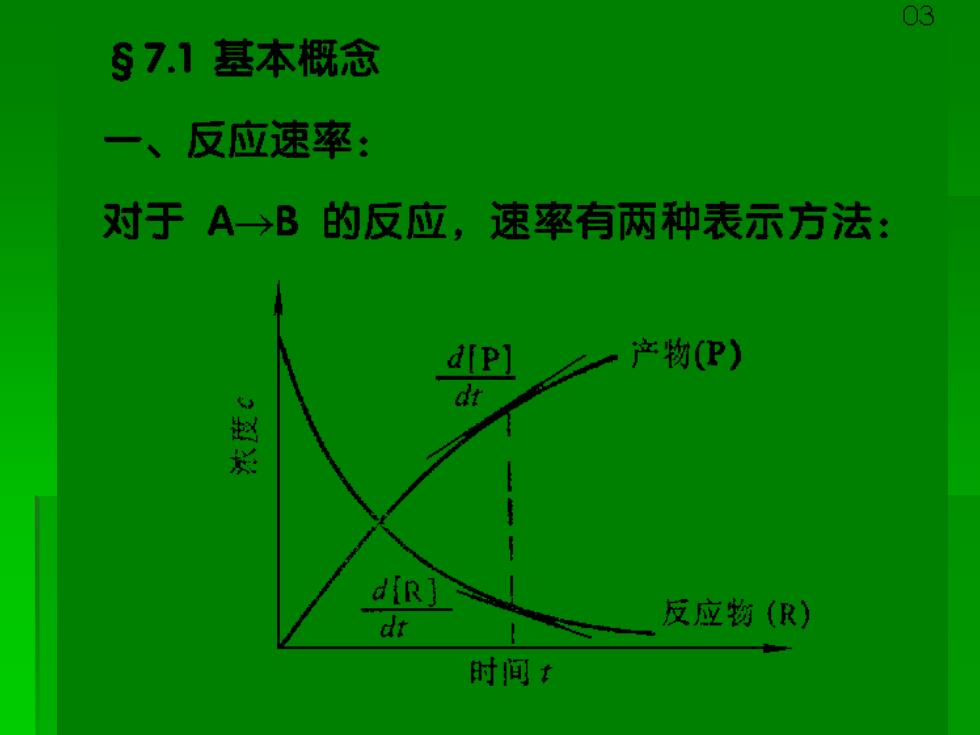
03 §7.1基本概念 一、反应速率: 对于A→B的反应,速率有两种表示方法: d[P) 产物(P) dt d(R] dr 反应物(R) 时间

04 对于一般反应, aA- >bB t=0 0 t=t nA nB 定义反应进度 0 -a b 上式对t微商,可得反应进度随t的变化率: de 1 dt a dt b dt

05 定义: 反应速率为单位体积内反应进度 随时间的变化率。 即: r- dt bV dt V为反应体系的体积,一般情况下反应 体积是恒定的,整理后: 8 dt d dC 1 dCB a dt dt

可用浓度随时间的变化率表示反应速率,但要除以 反应式系数才能使不同物质浓度表示的速率相等。 对于任一反应: aA+bB> gG+hH → ∑MB dCa r-a 1 dCB 1 dC 1 dC dt dt g dt h dt Vi dt V为反应式中第i种物质的计量系数,反应物的V:前 加负号

07 例:2N2O5→4NO2+O2 2 dt r的量纲为:[浓度][时间或者写作 mole.dm3.s1。对于气相反应,可用分压 代替浓度表示反应速率。 1 dP r=vi dt 对理想气体,PCRT,故r。fRT),是RT 的函数

08 对上述反应 p- dt dt 二、基元反应,反应分子数,复杂反应 (1)基元反应: 如果一个化学反应,是反应物的微粒 (原子、分子、离子.)直接作用, 一步直接实现化学反应,这个化学反 应叫基元反应,也叫元反应或简单反应

09 例: C4H6+C2H4→C6H1o 丁二烯乙烯 环己烯 是基元反应,但大多数写出的化学反应方程式, 只代表反应的计量结果。 例:H,十CL,→2HC1经研究发现是分步完成的。 C12+M→2C1+M C1+H2 →HCI+H H.+Cl →HCI+C 2C1+M →C12+M 基元反应是组成化学反应的基本单元
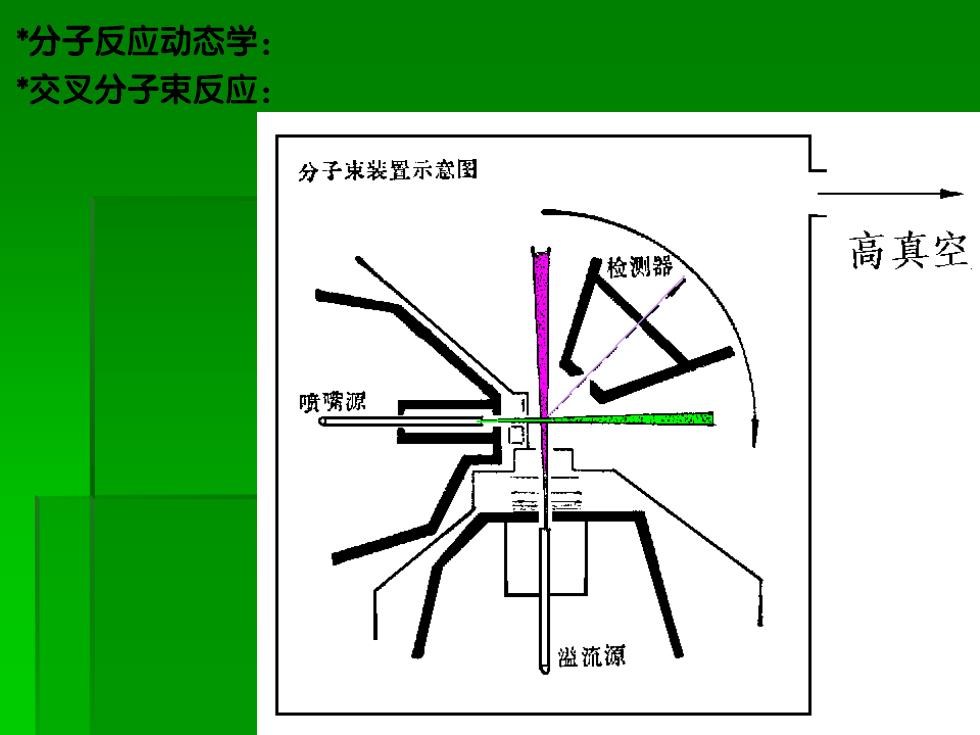
分子反应动态学: *交叉分子束反应: 分子束装置示念图 【检测器 高真空 喷嘴源 溢流源