
199 四、链反应(连锁反应) (1)定义:是一类特殊反应。反应一旦开始, 就会象链子般一环接一环地连续发生 一氵 系列变化,使反应自动地进行下去。 这类反应包含活性物质的生成和消失, 如自由基反应。 (2)步骤:反应分三步,)链的引发:链的传递: i)链的终止(或称作自由基销毁) )链的引发(产生自由基) 链反应中,引发是比较困难的,必须有外界条件, 例如加热,或用特定的光辐射等手段才能引发, 也就是说必须有一定的外加能量

例:H,+Br2→2HBr为链反应,是自由基反应 引发:Br,+M→2Br·+M引发可能性大 H2+M→2H+M引发可能性非常小 EH-H=435KJ>>EBr-Br=139KJ )链的传递和生长 引发产生了自由基,自由基与反应物分子交替作用的 过程,是旧的自由基消失,又有新的自由基产生,从 而使化学反应能进行下去。 例:H,+Br·→HBr+H E=88 KJ H·+B2→HBr+Br. E<10KJ 第一个反应生成的自由基是第二个反应的反应物: 第二个反应生成的自由基是第一个反应的反应物

特点:①这种反应很快,活化能很低,0~40KJ 分子间反应的活化能一般100~400KJ。 ②总是有自由基参加反应,自由基不消失。 i链的终止:自由基化合为正常分子的步骤 有两种途径: a)两个自由基通过气相第三体复合为分子(气相销毁) b)自由基与器壁碰撞生成稳定分子(器壁销毁) 例: H·+HBr→Br.+H2E=16.7KJ 阻止 2Br·+M →Br2+M E=0, M吸收自由基放出的能量,使其终止

前一个反应以乎为链传递,但是这个反应是前面链 传递的逆反应,消耗产物,把很活泼的H·自由基变 为不太活泼的B·自由基。虽然没能阻止链的传递, 但消耗产物阻得了反应进行。由于H·太活泼,故 生成H2的可能性很小。 可以控制自由基反应链的终止来控制反应。 (3)链反应的分类 直链反应(单链):链传递过程中,自由基数目不 变,消失一个同时又生成另一个,反应稳速进行, 生成HBr的反应即为直链反应。 202
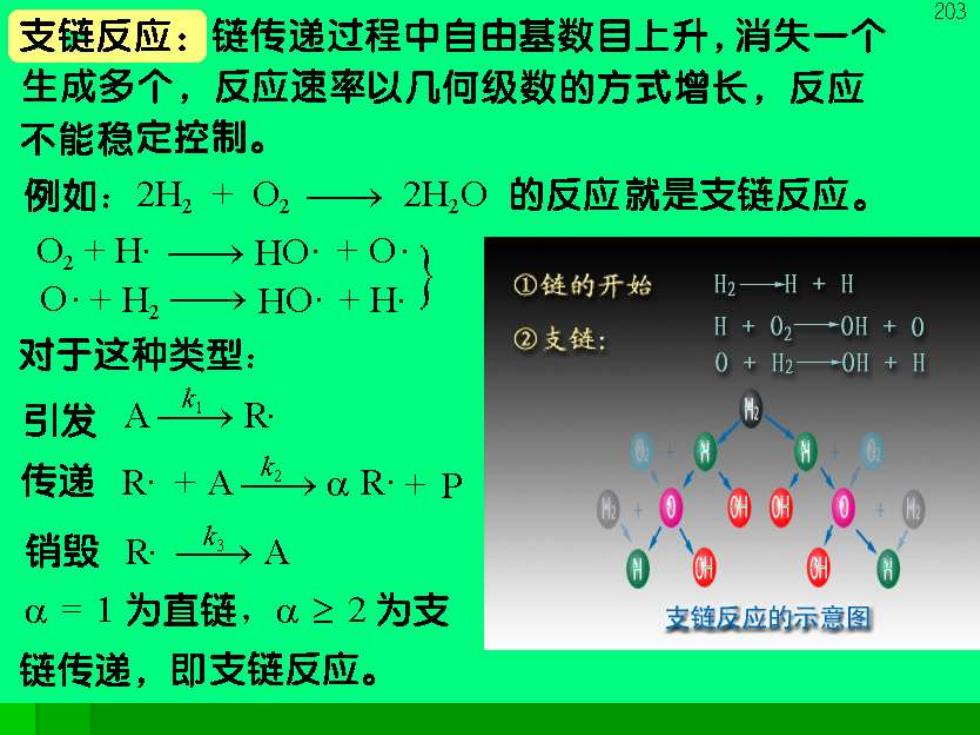
203 支链反应:链传递过程中自由基数目上升,消失一个 生成多个,反应速率以几何级数的方式增长,反应 不能稳定控制。 例如:2H2+O2→ 2H,O的反应就是支链反应。 8+H二》 O2+H. ①链的开始 H2→H+H H+02→0H+0 对于这种类型: ②支链: 0+H2→0H+H 引发 A在R 传递R十A→aR+P 销毁R A 0=1为直链,0≥2为支 支链反应的示意图 链传递,即支链反应

204 (4)链反应的速率方程 以HBr生成反应为例: ①Br2+Mk→2Br.+M链引发 ② Br.+H HBr+H. 3) H.+Br2一 HBr Br. 链传递 4)H +HBrH+Br. 链阻止 5 2Br.+M Br2+M 链终止 各式的速率方程如下: 1 dCBr dt 2 dt = f2 dCBr= dt dt dt dCu-k2 CBr.CH2 dt

dCBr2 dCHBr 205 r3= dt dt dt dCBrk CaCBr2 dt 4=1 dC= dCHBL dCn, dt dt dCBr. dt dt kaCH.CHBr 1 dCBr. dCBr2 2 dt dt ksCpr.CM 总反应速率可以用产物的生成速率或反应物的消耗 速率表示。 HBr在上面(2),(3),(4)三步中生成及消耗。 对于H2+B 2→2HBr这样的总反应式 1 r= dCHBr 2 dt dCk Cr.CCu.CCn.Cm(1) dt

式中 CBr. CB: 不易测定,但可假定其稳定不变,即 dCBr.0 dC dt dt =0, (稳态假设)。实验也发现,【 自 由基反应一旦引发,极短时间(10°秒)就可以用稳定 的速率进行。 dCCMkCu.CkaCu.Cr dt -Cr.C22kC6CM=0·(2) CCCn.C.Cu.C03) dt (2)+(3) 2k1 CBr2 CM-2 ks CBr.CM=0 kiCBI2 12 CBr. 代入(3)

207 12 12 k C Ca.-k3 KACHBr 将CB.,CH,代入(1)中,经推导和整理后可得到速率 方程。 12 1/2 +kC, KACHBr 11/2 ks C -ka k3

12 208 2k2 12 dt 12 这个结果与实验测定的结果: dCHBr dt 1+ KCHBE 是一致的,即理论推导结果与实验测定结果一致, 说明原理论假定合理。其中 12 k=2k2 KA k'= (1)与(5):(2)与(4)互为逆反应, k2=K2 k=K14 利用实验测定之k,k,及平衡常数K1,K2, 可算出速率常数k2,k4