
101 二、胶体溶液 多相分散体系,胶体,是一类物理化学 性质特殊的高度分散体系,是物质以一定 分散程度存在的一种物质状态。 分散系 分散相一被分散的物质 分散介质 胶体:分散相颗粒范围为1nm100nm为粗分散系

分类(按聚集状态): 102 分散介质 分散相 名称 举例 乳状液 牛奶、人造黄油 g 泡沫 奶酪、灭火用泡沫 溶胶 AgI溶胶、金溶胶 g 雾、云 气溶胶 烟、尘 固态乳状 硅酸凝胶、珍珠 液、凝胶 g 固体泡沫 泡沫塑料 固溶胶 合金、有色玻璃 胶体范围很广,这里主要讨论这类分散系的形 成、破坏及各种物理、化学性质。 下面着重讨论水为分散介质的疏水溶胶 (简称溶胶或胶体溶液)

103 9.5溶胶的制备与净化 原则上讲任何难溶物皆可制成溶胶,只要分散颗粒的 大小处在限定的范围内即可。 (一)制备 分散法: 研磨法:把粗粒研细,防止小颗粒粘结,加入稳 定剂: 胶溶法: 把新制备的沉淀物(多是疑胶)洗涤, 加入适当的电解质作稳定剂: 3 超声波分散法:高频机械振荡使分散均匀

104 凝聚法: ①化学法: AgNO,(稀溶液)+KI(稀溶液)→AgI(溶胶)+KNO 2 变更溶剂法:在不同溶剂中溶解度不同,使之成 胶粒大小析出。例, 松香在乙醇中溶解度大,将乙醇溶 液滴入水中,由于溶解度变低,溶 质以胶粒大小析出形成松香溶胶。 3 电弧法:把制溶胶的金属制成电极 浸入水中,发生电弧使金属气化, 被水冷却成胶粒
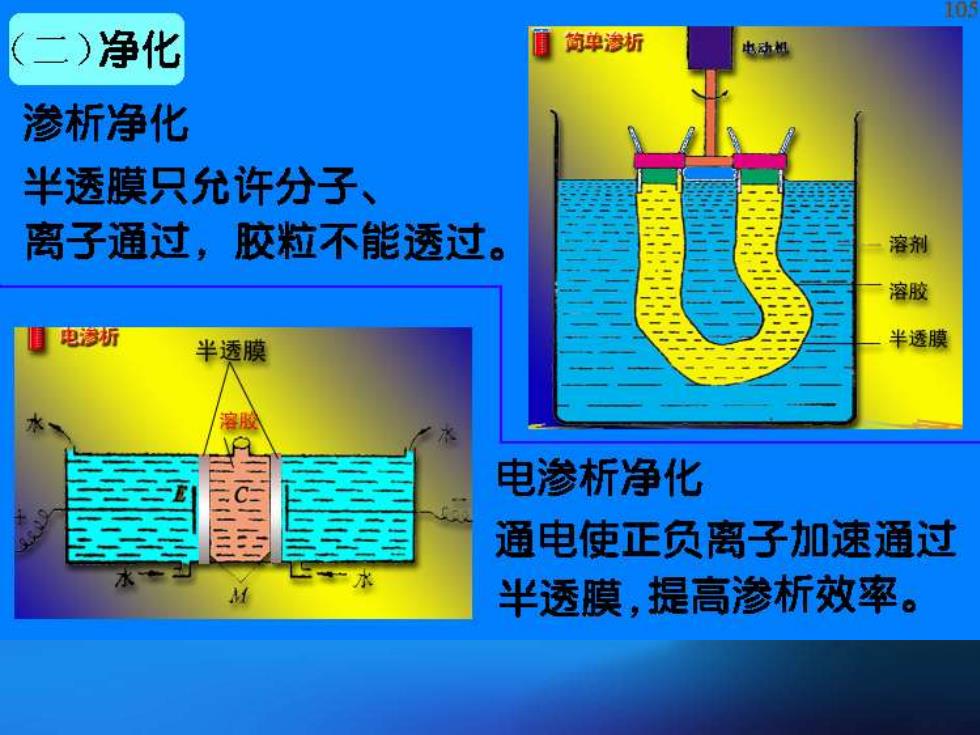
(二)净化 ■简单渗折 电动相 渗析净化 半透膜只允许分子、 离子通过,胶粒不能透过。 溶剂 溶胶 电渗祈 半透膜 半透膜 电渗析净化 通电使正负离子加速通过 半透膜,提高渗析效率

§9.6溶胶的动力性质和光学性质 胶体为一不均匀的多相体系,但有极高的表面自由 能和极大的物理界面,热力学的观点认为是极不稳定 的体系 一易于聚沉。但有时又相当稳定,这是因为 高分散胶粒的复杂性,高分散和结构复杂这两个因素 不但稳定了胶体,而且赋予溶胶特殊的性质。 (一)动力性质 布朗运动:由于介质分子的热运动不断碰 撞胶粒,使胶粒时时刻刻以不同的速度、沿不同 的方向作无序运动。加入稳定剂可使胶粒不粘结 变大,这种不规则运动使溶胶相对稳定

扩散和渗透压:由于布朗运动,溶胶有扩散作用 则有渗透压,公式与稀溶液相同,π RT n:体积为V的溶胶溶液中溶胶的量(摩尔)。 由于溶胶不稳定,浓度不能很大,因而其扩散和渗 透压都不明显。 ③沉降和沉降平衡:分散系中的颗粒会受重力作用而 沉降,但溶胶的胶粒受重力和布朗运动两个因素的 影响而达成一种平衡,其浓度随高度变化,其变化 关系符合Boltzmann公式。 具有一定浓度梯度的平衡称为沉降平衡,沉降平 衡的公式为:

108 RT no n:高度为h处的粒子密度: n。: 容器底部即=0处粒子的密度: 号rR(P于PgN, R:粒子半径 p:密度, g:重力常数, N: 阿氏常数

(二)光学性质 10 只讨论丁达尔(Tyndall)现象与瑞雷Rayleigh)公式。 一束汇聚的光通过胶体溶 液,从侧面可见一光锥,称为 Tyndall现象,产生Tyndall 业红色 现象的原因是由于光散射。 淡 蓝色 光通过分散系时有三种作用:①光的吸 收,CuSO,溶液显蓝色是因为Cu+吸收橙 色光所致。②光的反射,分散系的粒子大 于光的波长,发生反射,使光不能透过, 悬浊液和乳浊液的混浊不透光即是

③光的散射,分散粒子小于光的波长时 会绕过粒子向各方向传播,反生散射。溶 胶的粒子一般小于100nm,小于可见紫 外光波长(400nm),故可见光照射到溶胶 时,溶胶粒子对光散射,这种散射光也称 乳光,就是Tyndall现象。Tyndall现象不 是溶胶特有,真溶液也有,但是十分不明 显,这一现象可用于区分真溶液和溶胶。 可用超显微镜从侧面观察Tyndal1现象以 便研究胶粒的聚沉过程、沉降速度及电泳 现象等。超显微镜是专门用于观察胶粒运 动情况的,目镜中看到的只是粒子散射光 的亮点,并不是胶粒本身