
第一章 化学热力学基本定律与函数
第 一 章 化学热力学基本定律与函数

物理化学是化学学科中研究化学体系 行为最一般规律和理论的学科。是化学理 论的基础。 结构化学 量子化学 化学热力学(含统计热力学) 化学动力学 电化学 胶体与界面化学 催化化学 光化学
物理化学是化学学科中研究化学体系 行为最一般规律和理论的学科。是化学理 论的基础。 结构化学 量子化学 化学热力学(含统计热力学) 化学动力学 电化学 胶体与界面化学 催化化学 光化学

§1.化学热力学的科学框架 一、 概述 热功转换规律→热力学1、2定律→平衡热力 学函数关系,3定律→逸度与活度(实际体)。 经典热力学+应用学科理论→化学热力学 溶液热力学,冶金热力学,化工热力学,材料热 力学等。 20世纪:非平衡热力学
§1. 化学热力学的科学框架 一、概述 热功转换规律→热力学1、2定律→平衡热力 学函数关系,3定律→逸度与活度(实际体)。 经典热力学+应用学科理论→化学热力学→ 溶液热力学,冶金热力学,化工热力学,材料热 力学等。 20世纪:非平衡热力学

二、化学热力学的研究对象 化学热力学就是用热力学的基本原理研 究化学变化、相变化的最普遍规律。 化学热力学的研究对象就是: 一切客现实体及其变北视律 体系与环境 体系:被研究的物质与空间 环境:与体系发生关联的物质与空间 体系分为三类: 封闭体系,开放体系,孤立体系
二、化学热力学的研究对象 化学热力学就是用热力学的基本原理研 究化学变化、相变化的最普遍规律。 化学热力学的研究对象就是: 一切客观实体及其变化规律 体系与环境 体系:被研究的物质与空间 环境:与体系发生关联的物质与空间 体系分为三类: 封闭体系,开放体系,孤立体系

分类的依据是: 体系与环境间的物质、能量的交换情况 封闭体系:有能量传递,无物质传递 开放(敞开)体系:有能量传递,有物质传递 孤立(隔离)体系:无能量传递,无物质传递 2.过程:在一定条件下,体系由始态变化至末 态,称体系经历了一个(变化)过程,实现变化 的具体步骤称为途径。 过程分类:
分类的依据是: 体系与环境间的物质、能量的交换情况 封闭体系:有能量传递,无物质传递 开放(敞开)体系:有能量传递,有物质传递 孤立(隔离)体系:无能量传递,无物质传递 2. 过程:在一定条件下,体系由始态变化至末 态,称体系经历了一个(变化)过程,实现变化 的具体步骤称为途径。 过程分类:

(1)按变化性质分类: ★简单状态变化(低级变化)过程 ★相态变化(中级变化)过程 ★化学变化(高级变化)过程 (2)按环境条件分类: ◆恒容过程:体系的体积恒定不变 ◆恒压过程:p始=P未=P外=C0nst ◆恒温过程:T始=T未=T外=const ◆绝热过程:体系与环境间无热交换 ◆自由膨胀过程:P外=0 ◆循环过程:始、末态为同一状态
(1)按变化性质分类: ★简单状态变化(低级变化)过程 ★相态变化(中级变化)过程 ★化学变化(高级变化)过程 (2)按环境条件分类: ◆恒容过程:体系的体积恒定不变 ◆恒压过程:p始= p末=p外=const ◆恒温过程: T始= T末=T外=const ◆绝热过程:体系与环境间无热交换 ◆自由膨胀过程:p外=0 ◆循环过程:始、末态为同一状态

(3)按过程本质分类 ▲可逆过程一平衡(准平衡)过程 ▲不可逆过程 非平衡过程 三、化学热力学方法 化学热力学方法就是状态函数法 1.体系的性质与类型 性质:描述体系状态的物理量 ▲容量性质:与体系物质量多少有关的物理量 ▲强度性质:与体系物质量多少无关的物理量
(3)按过程本质分类 ▲ 可逆过程 平衡(准平衡)过程 ▲ 不可逆过程 非平衡过程 三、化学热力学方法 化学热力学方法就是 状态函数法 1.体系的性质与类型 性质:描述体系状态的物理量 ▲容量性质:与体系物质量多少有关的物理量 ▲强度性质:与体系物质量多少无关的物理量

2.状态与状态函数 性质描述体系状态,状态是由性质决定。 稳定平衡态 平衡态 状态 亚稳平衡态 非平衡态 平衡态必须同时满足: 热平衡(T体一T外=0), 力平衡(不作功), 质平衡(无相变和化学反应)
2. 状态与状态函数 性质描述体系状态,状态是由性质决定。 稳定平衡态 平衡态 状态 亚稳平衡态 非平衡态 平衡态必须同时满足: 热平衡(|T体-T外|=0), 力平衡(不作功), 质平衡(无相变和化学反应)

状态函数的特点: (1)状态一定,状态函数一定; (2)状态函数变化量只与始末态有关,与体系 由始态到末态的变化途径无关。即,具有 数学上的全微分性质: dX=Xk-X始=x 如:△T=T2-T1
状态函数的特点: (1)状态一定,状态函数一定; (2)状态函数变化量只与始末态有关,与体系 由始态到末态的变化途径无关。即,具有 数学上的全微分性质: X X X X X X = 末 − 始 = 末 始 d 如:△T = T2 – T1
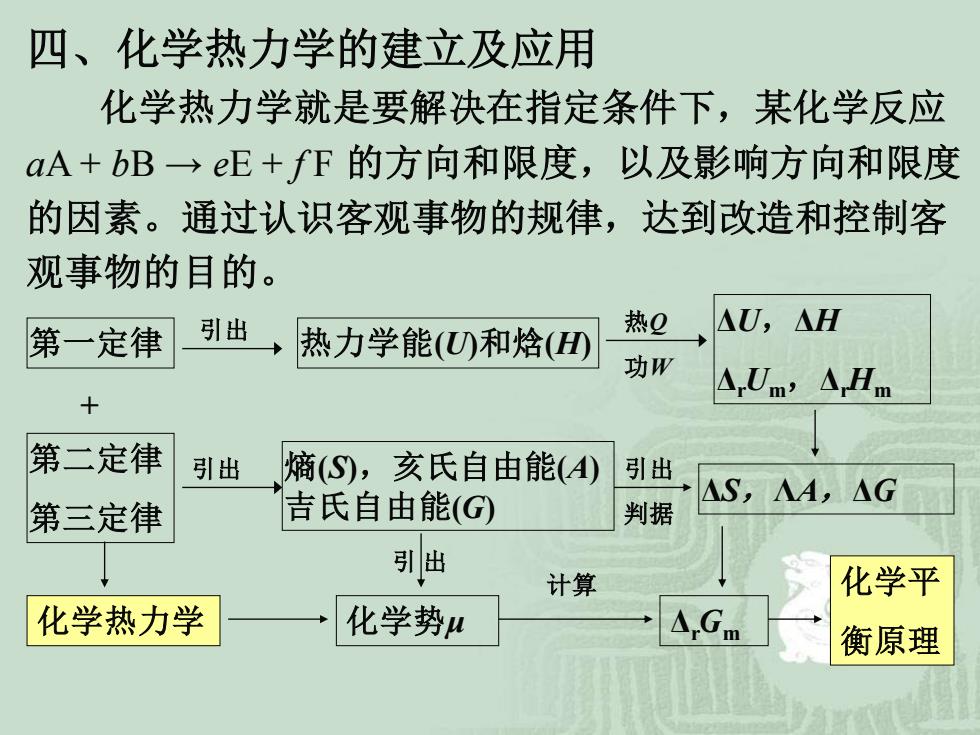
四、化学热力学的建立及应用 化学热力学就是要解决在指定条件下,某化学反应 aA+bB→eE+fF的方向和限度,以及影响方向和限度 的因素。通过认识客观事物的规律,达到改造和控制客 观事物的目的。 第一定律 引出 热力学能(U和焓(0 热2 △U,△H 功W A,Um,△Hm 第二定律 引出 熵(S),亥氏自由能(4) 引出 第三定律 吉氏自由能(G △S,A,△G 判据 引出 计算 化学平 化学热力学 化学势u △Gm 衡原理
第一定律 第二定律 第三定律 热力学能(U)和焓(H) ΔU,ΔH ΔrUm,ΔrHm 引出 热Q 功W 引出 熵(S),亥氏自由能(A) 吉氏自由能(G) ΔS,ΛA,ΔG 引出 判据 化学势μ ΔrGm 引 出 计算 化学平 衡原理 化学热力学 + 四、化学热力学的建立及应用 化学热力学就是要解决在指定条件下,某化学反应 aA + bB → eE + f F 的方向和限度,以及影响方向和限度 的因素。通过认识客观事物的规律,达到改造和控制客 观事物的目的