
第十章p区元素 (一) Chapter 1p-block elements (
第十章 p 区元素(一) Chapter 10 p-block elements (一)

本章教学要求 1.了解p区元素的特点: 2.了解p区元素的存在、制备及用途; 3。掌握重点元素硼、铝、碳、硅、氮和磷的单质及其 化合物的性质,会用结构理论和热力学解释它们的 某些化学现象: 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6.了解惰性电子对效应概念及其应用
本章教学要求 1.了解 p 区元素的特点; 2.了解 p 区元素的存在、制备及用途; 3.掌握重点元素硼、铝、碳、硅、氮和磷的单质及其 化合物的性质,会用结构理论和热力学解释它们的 某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6.了解惰性电子对效应概念及其应用
10.1概述 Generality 10.2天然资源、单质的提取和用途 Natural recourses elementary substance 本章内 abstraction and applications 10.3 硼 Boron Aluminum 10.5 碳 Carbon 10.6 硅 Silicon 10.7 氮磷 Nitrogen 10.8 Phosphorus 10.9 长周期元素 Long-period elements
10.1 概述 Generality 10.2 天然资源、单质的提取和用途 Natural recourses , elementary substance abstraction and applications 10.3 硼 Boron 10.4 铝 Aluminum 10.5 碳 Carbon 10.6 硅 Silicon 10.7 氮 Nitrogen 10.8 磷 Phosphorus 10.9 长周期元素 Long-period elements
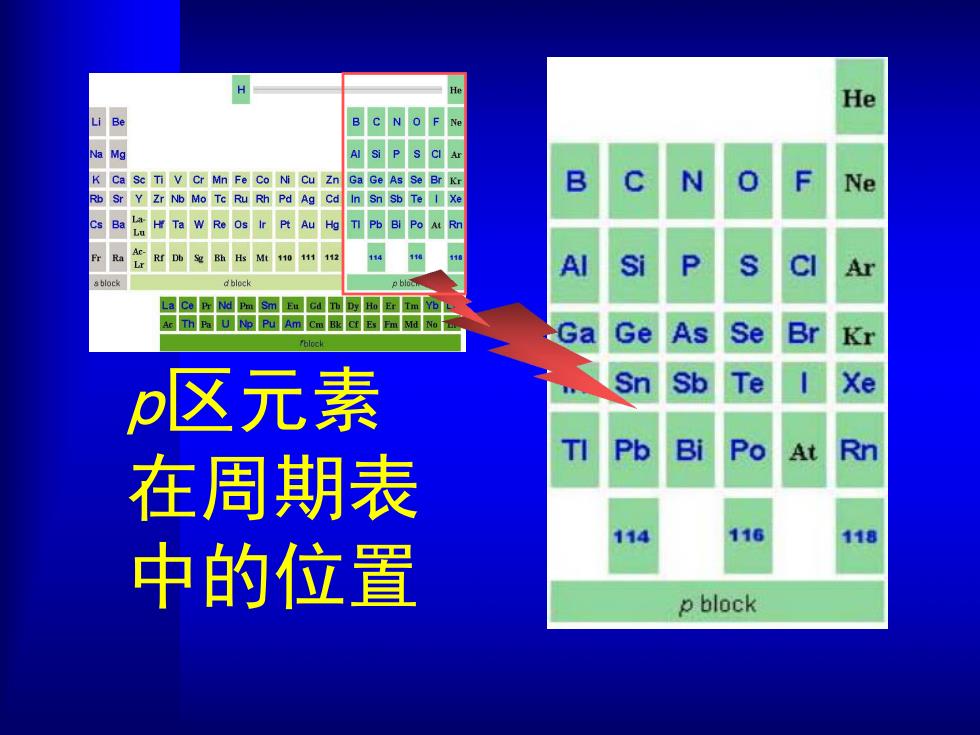
He B C N O F M S P S C A K Ca Se Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr e Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe H Ta W Re Os ir Pt Au TI Pb BI Po AL Rn Si LaC m Sm Eu Gd T Ho Er Im% Ac Th Pa U Np Pu Am Cm Bk cf Es Fm Md No Ga Ge As Se Br Kr p区元素 Sb Te Xe Pb Bi Po At Rn 在周期表 116 118 中的位置 p block
p区元素 在周期表 中的位置

P区元素的化学以其多样性为特点: 。唯一同时包括金属和非金属元素的一个区 。包括“不活泼的单原子气体一稀有气体” ●无机非金属材料库:C一C复合材料,人造金刚石,半导体硅,分 子筛(铝硅酸盐),高能燃料(N,H)(见下页图) ●有毒的小元素群 多有同素异形体 成键的多样性:如乙硼烷的3c2e键等 周期表中的规律性:惰性电子对效应,对角线规则等 Ga Ge As Se 有益微量元素 In Sn Sb Te 可能是有益微量元素 Ti Pb Bi Po
● 唯一同时包括金属和非金属元素的一个区 ● 包括 “不活泼的单原子气体—稀有气体” ● 无机非金属材料库:C—C复合材料,人造金刚石,半导体硅,分 子筛(铝硅酸盐),高能燃料(N2H4)(见下页图) ● 有毒的小元素群 ● 多有同素异形体 ● 成键的多样性:如乙硼烷的 3c2e 键等 ● 周期表中的规律性:惰性电子对效应,对角线规则等 Ga In Tl Ge Sn Pb As Sb Bi Se Te Po 有益微量元素 可能是有益微量元素 P区元素的化学以其多样性为特点:

碳-碳复合材料 人造金刚石 Supercage Cubic cage Sodalite cag 分子筛 高能燃料科 ranoFET 光子带隙材料 硅单晶材料 太阳电池材料 纳米半导体材料
光子带隙材料 硅单晶材料 太阳电池材料 纳米半导体材料 分子筛 碳-碳复合材料 高能燃料 人造金刚石
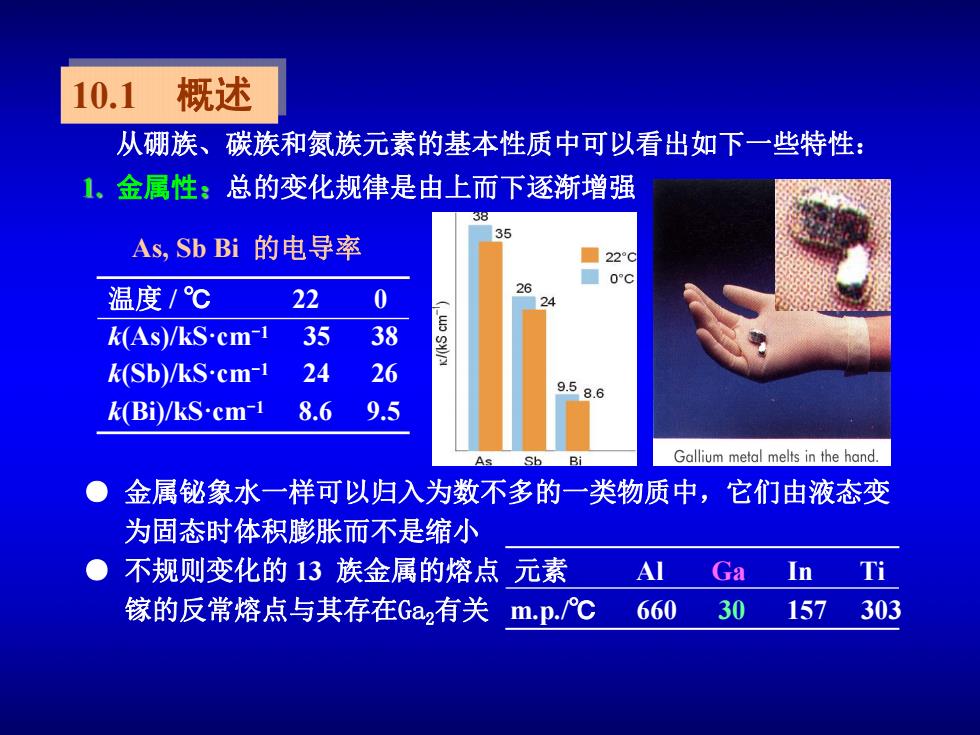
10.1 概述 从硼族、碳族和氮族元素的基本性质中可以看出如下一些特性: 1 金属性:总的变化规律是由上而下逐渐增强 38 35 As,SbBi的电导率 220 温度/℃ 22 0 26 24 k(As)/kS.cm-1 35 38 k(Sb)/kS.cm-1 24 26 9.58.6 k(Bi)/kS.cm-1 8.6 9.5 Gallium metal melts in the hand. ● 金属铋象水一样可以归入为数不多的一类物质中,它们由液态变 为固态时体积膨胀而不是缩小 ● 不规则变化的13族金属的熔点元素 AI Ga In Ti 镓的反常熔点与其存在Ga2有关 mp./℃ 660 30 157303
10.1 概述 ● 金属铋象水一样可以归入为数不多的一类物质中,它们由液态变 为固态时体积膨胀而不是缩小 ● 不规则变化的 13 族金属的熔点 元素 Al Ga In Ti 镓的反常熔点与其存在Ga2有关 m.p./℃ 660 30 157 303 温度 / ℃ 22 0 k(As)/kS·cm-1 35 38 k(Sb)/kS·cm-1 24 26 k(Bi)/kS·cm-1 8.6 9.5 As, Sb Bi 的电导率 金属性 总的变化规律是由上而下逐渐增强 从硼族、碳族和氮族元素的基本性质中可以看出如下一些特性:

2.氧化态: 三族中15个元素都可达到各自的族氧化态,但出现了 惰性电子对效应(inert-pair effect),即: 4s13 稳定性增大 低氧化态相对 Ga Ge As In Sn Sb 定性增大 TI Pb Bi 性电子对稳 4s2 5s1-3 5s2 6s1-3 6s2 原子序数大的p区元素高氧化态不稳定,它可以归结于: ●形成高氧化态化合物时,需要激发能(s2pm→s'p*) ●原子序数大的元素本身固有的成键能力比较差(电子云重叠程 度差;内层电子排斥力较大)
氧化态 三族中 15 个元素都可达到各自的族氧化态,但出现了 惰性电子对效应(inert-pair ef ect),即: 原子序数大的 p 区元素高氧化态不稳定,它可以归结于: ● 形成高氧化态化合物时,需要激发能 (s 2pn →s 1pn+1) ● 原子序数大的元素本身固有的成键能力比较差(电子云重叠程 度差;内层电子排斥力较大) Ga Ge As In Sn Sb Tl Pb Bi 4s 2 5s 2 6s 2 低 氧 化 态 相 对 稳 定 性 增 大 4s 1-3 5s 1-3 6s 1-3 惰 性 电 子 对 稳 定 性 增 大
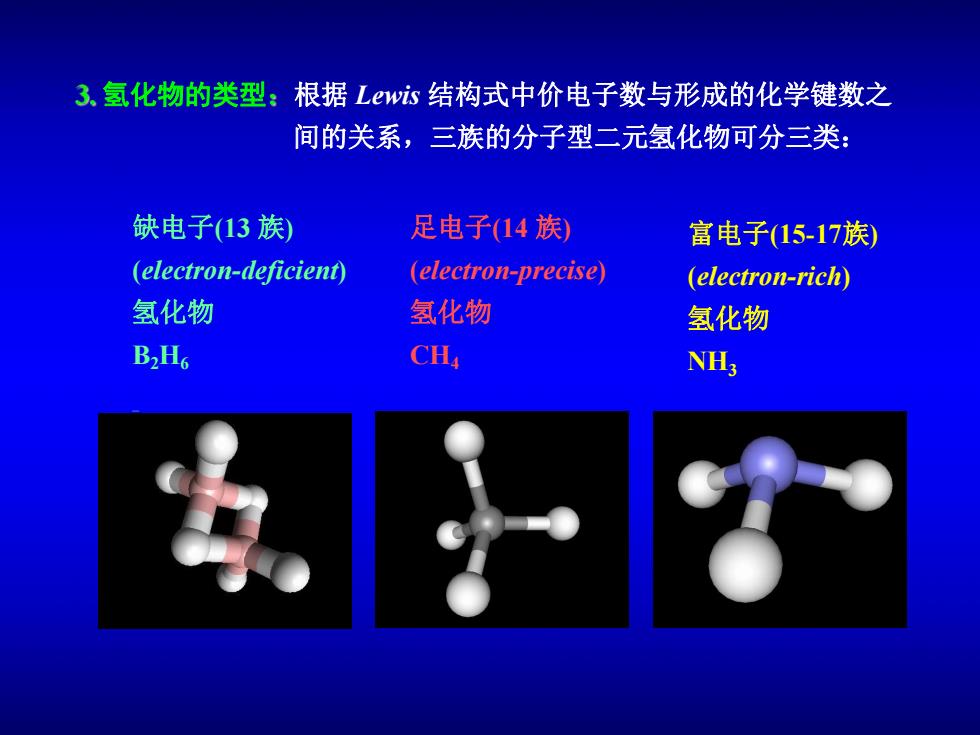
3、氢化物的类型:根据Lw心结构式中价电子数与形成的化学键数之 间的关系,三族的分子型二元氢化物可分三类: 缺电子(13族) 足电子(14族 富电子(15-17族) (electron-deficient) (electron-precise (electron-rich 氢化物 氢化物 氢化物 B2H6 CH, NH;
氢化物的类型 根据 Lewis 结构式中价电子数与形成的化学键数之 间的关系,三族的分子型二元氢化物可分三类: 缺电子(13 族) (electron-deficient) 氢化物 B2H6 足电子(14 族) (electron-precise) 氢化物 CH4 富电子(15-17族) (electron-rich) 氢化物 NH3
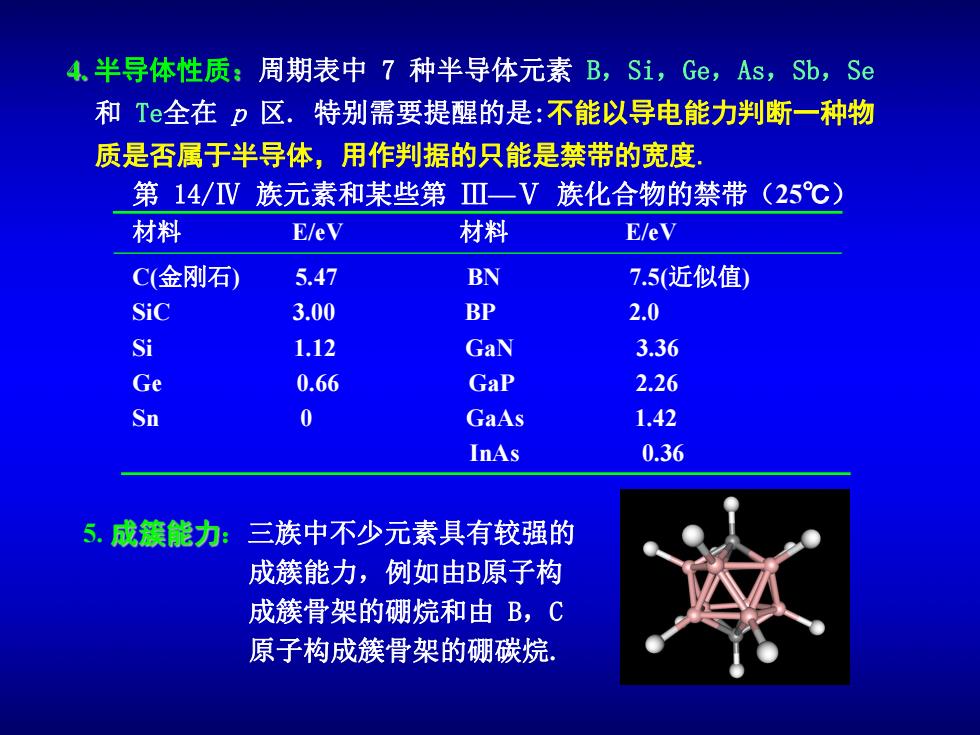
4.半导体性质:周期表中7种半导体元素B,Si,Ge,As,Sb,Se 和Te全在p区.特别需要提醒的是:不能以导电能力判断一种物 质是否属于半导体,用作判据的只能是禁带的宽度: 第14/V族元素和某些第Ⅲ一V族化合物的禁带(25℃) 材料 E/eV 材料 E/eV C(金刚石) 5.47 BN 7.5(近似值) Sic 3.00 BP 2.0 Si 1.12 GaN 3.36 Ge 0.66 GaP 2.26 Sn 0 GaAs 1.42 InAs 0.36 成簇能力: 三族中不少元素具有较强的 成簇能力,例如由B原子构 成簇骨架的硼烷和由B,C 原子构成簇骨架的硼碳烷
半导体性质 周期表中 7 种半导体元素 B,Si,Ge,As,Sb,Se 和 Te全在 p 区. 特别需要提醒的是:不能以导电能力判断一种物 质是否属于半导体,用作判据的只能是禁带的宽度. 第 14/Ⅳ 族元素和某些第 Ⅲ—Ⅴ 族化合物的禁带(25℃) 材料 E/eV 材料 E/eV C(金刚石) 5.47 BN 7.5(近似值) SiC 3.00 BP 2.0 Si 1.12 GaN 3.36 Ge 0.66 GaP 2.26 Sn 0 GaAs 1.42 InAs 0.36 5. :三族中不少元素具有较强的 成簇能力,例如由B原子构 成簇骨架的硼烷和由 B,C 原子构成簇骨架的硼碳烷