
第16章 氨磷砷 Chapter 16 Nitrogen, Phosphorus and Arsenic
第16章 氮 磷 砷 Chapter 16 Nitrogen, Phosphorus and Arsenic

本章教学要求 重点掌握氮和磷的单质及其氢化物、卤化物、氧化 物、含氧酸及其盐的结构、性质、制备和应用。 2.了解砷的重要化合物的性质和应用
本章教学要求 1.重点掌握氮和磷的单质及其氢化物、卤化物、氧化 物、含氧酸及其盐的结构、性质、制备和应用。 2.了解砷的重要化合物的性质和应用

16.1元素的基本性质 本章内容 16.2氮和氮的化合物 16.3 磷及其化合物 16.4砷
16.1 元素的基本性质 16.2 氮和氮的化合物 16.3 磷及其化合物 16.4 砷
He Mg A Ca Sc TI V Cr Mn Fe Co M Cu Zn G B Ne Sr Y Zr Nb Mo Te Ru Rh Pd Ag Cd n Sb Ba u Si P b La Ce Pr Nd pm Sm En cd Th Dy He Er Tm Yb L Ar Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Ge As Se Br Kr 氮族元素 Sb Te Pb Bi Po At Rn 在周期表 116 118 中的位置 p block
氮族元素 在周期表 中的位置

16.2氮和氮的化合物 16.2.1氮Nitrogen) ●氨是大气的主要成分,大规模制备是通过分馏液态空气实现的.但因需 求量太大仍然促使人们谋求建立某种成本更低的制备工艺 ●最大的用途是用于制造氮肥、其他含氮化合物和作保护气体.高纯N2要 进一步除水和氧.液氮(b.p.-196℃)是一种重要的致冷剂 可作低温恒温浴的化合物举例 t/℃ 化合物 t/c 化合物 +6.55 环己烷 -63.5 氯仿 0.00 水 -83.6 乙酸乙酯 -8.6 水杨酸甲酯 .96.7 二氯甲烷 -22.95 四氯化碳 -126.6 甲基环己烷 -45.2 氯苯 -160 已戊烷 Oxygen-permeable Nitrogen membrane Oxygen 惰性气氛手套箱 Oxygen 氮氧膜分离器示意图
l氮 是大气的主要成分,大规模制备是通过分馏液态空气实现 的. 但因需 求量太大仍然促使人们谋求建立某种成本更低的制备工艺. l最大的用途是用于制造氮肥、其他含氮 化合物和作保护气体. 高纯 N2 要 进一步除水和氧. 液氮( b.p. -196 ℃ )是一种重要的致冷剂. 惰性气氛手套箱 氮-氧膜分离器示意图 t/ ℃ 化合物 t/ ℃ 化合物 +6。55 环己烷 - 63。5 氯仿 0。00 水 - 83。6 乙酸乙酯 - 8。6 水杨酸甲酯 - 96。7 二氯甲烷 - 22。95 四氯化碳 - 126。6 甲基环己烷 - 45。2 氯苯 - 160 己戊烷 可作低温恒温浴的化合物举例 16.2 氮和氮的化合物 16.2.1 氮(Nitrogen)
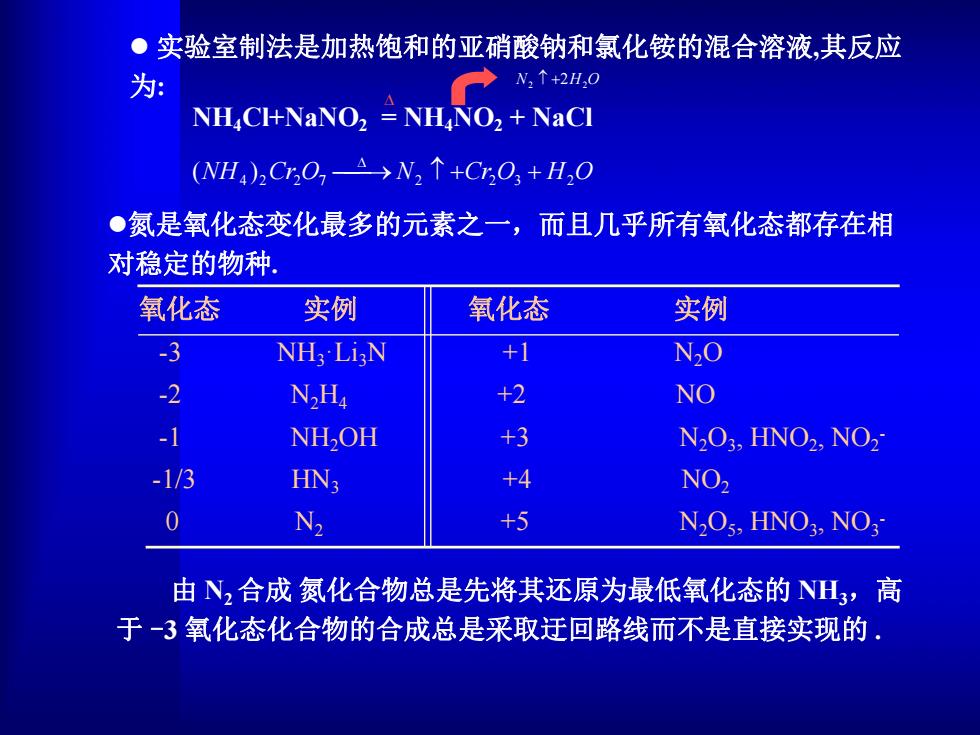
●实验室制法是加热饱和的亚硝酸钠和氯化铵的混合溶液,其反应 为: N:↑+2H,0 NHCH+NaNO2 NHNO,NaCI (NH4)2CrO,A→N2↑+CO+H,O ●氮是氧化态变化最多的元素之一,而且几乎所有氧化态都存在相 对稳定的物种 氧化态 实例 氧化态 实例 3 NH:Li N +1 NO -2 N2Ha +2 NO -1 NH,OH +3 N2O3,HNO2,NO2 -1/3 HN3 +4 NO2 0 N +5 N2O5,HNO3,NO3 由N2合成氮化合物总是先将其还原为最低氧化态的NH3,高 于-3氧化态化合物的合成总是采取迂回路线而不是直接实现的
l氮是氧化态变化最多的元素之一,而且几乎所有氧化态都存在相 对稳定的物种. 由 N2合成 氮化合物总是先将其还原为最低氧化态的 NH3,高 于 -3 氧化态化合物的合成总是采取迂回路线而不是直接实现的 . 氧化态 实例 氧化态 实例 -3 NH3·Li3N +1 N2O -2 N2H4 +2 NO -1 NH2OH +3 N2O3 , HNO2 , NO2 - -1/3 HN3 +4 NO2 0 N2 +5 N2O5 , HNO3 , NO3 - l 实验室制法是加热饱和的亚硝酸钠和氯化铵的混合溶液,其反应 为: NH4Cl+NaNO2 = NH4NO2 + NaCl N2 2H2O (NH4 )2Cr2O7 N2 Cr2O3 H2O
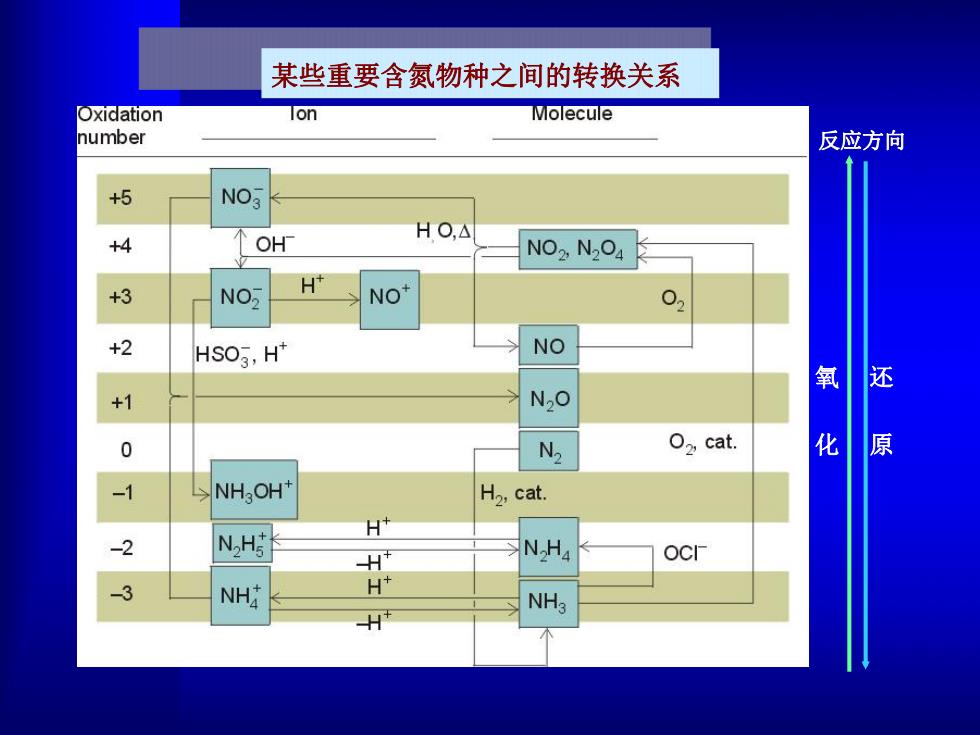
某些重要含氮物种之间的转换关系 Oxidation lon Molecule number 反应方向 +5 NO3 HO,△ +4 OH NO2,N2O4 NO H" +3 NO 02 +2 HSO3,H* NO 氧 还 +1 N2O 0 N2 O2 cat. 化 原 -1 NH OH+ H2,cat. H+ -2 NH H NH4 OCI 3 NH NH3
还 原 氧 化 反应方向 某些重要含氮物种之间的转换关系
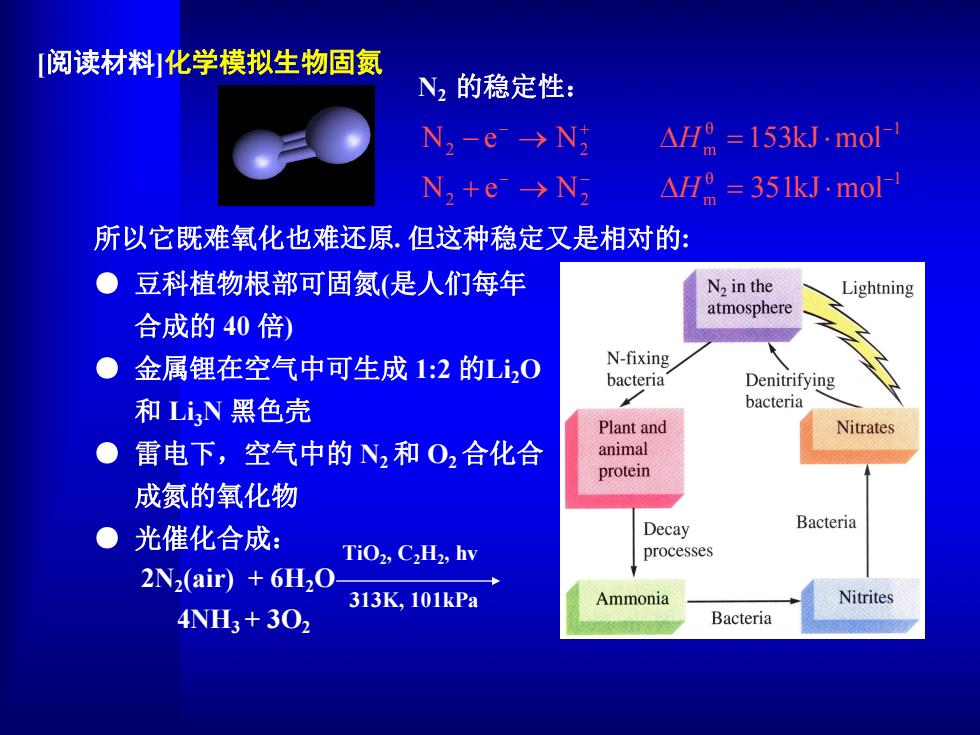
阅读材料化学模拟生物固氨 N2的稳定性: N2-e>N △H0=153kJmo N2te→N △HR=351 kJ.mol- 所以它既难氧化也难还原.但这种稳定又是相对的: ● 豆科植物根部可固氮(是人们每年 N2 in the Lightning atmosphere 合成的40倍) ●金属锂在空气中可生成1:2的Li0 N-fixing bacteria Denitrifying 和LiN黑色壳 bacteria Plant and Nitrates 雷电下,空气中的N2和O2合化合 animal protein 成氮的氧化物 Decay Bacteria 光催化合成: TiO2,C2H2,hv processes 2N2(air)+6H20 313K,101kPa Ammonia Nitrites 4NH3+302 Bacteria
θ 1 2 2 m θ 1 2 2 m N e N 351kJ mol N e N 153kJ mol H H N2 的稳定性: 所以它既难氧化也难还原. 但这种稳定又是相对的: ● 豆科植物根部可固氮(是人们每年 合成的 40 倍) ● 金属锂在空气中可生成 1:2 的Li2O 和 Li3N 黑色壳 ● 雷电下,空气中的 N2和 O2合化合 成氮的氧化物 ● 光催化合成: TiO2 , C2H2 , hv 313K, 101kPa 4NH3 + 3O2 2N2(air) + 6H2O [阅读材料]化学模拟生物固氮
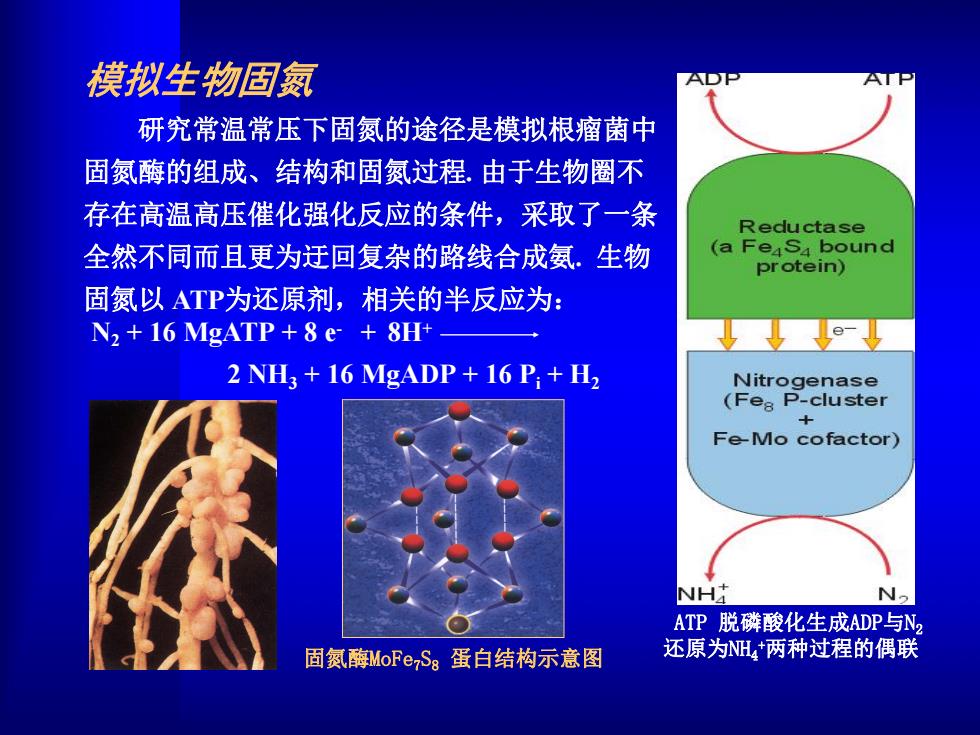
模拟生物固氮 研究常温常压下固氮的途径是模拟根瘤菌中 固氮酶的组成、结构和固氨过程.由于生物圈不 存在高温高压催化强化反应的条件,采取了一条 Reductase 全然不同而且更为迁回复杂的路线合成氨.生物 (a Feasa bound protein) 固氮以ATP为还原剂,相关的半反应为: N2+16 MgATP+8 e 8H+- 2 NH+16 MgADP+16 P;+H, Nitrogenase (Fe8 P-cluster Fe-Mo cofactor) NH N2 ATP脱磷酸化生成ADP与N 固氮酶MoFe7S8蛋白结构示意图 还原为NH+两种过程的偶联
ATP 脱磷酸化生成ADP与N2 还原为NH4 +两种过程的偶联 模拟生物固氮 研究常温常压下固氮的途径是模拟根瘤菌中 固氮酶的组成、结构和固氮过程. 由于生物圈不 存在高温高压催化强化反应的条件,采取了一条 全然不同而且更为迂回复杂的路线合成氨. 生物 固氮以 ATP为还原剂,相关的半反应为: N2 + 16 MgATP + 8 e - 2 NH3 + 16 MgADP + 16 Pi + H2 + 8H+ 固氮酶MoFe7S8 蛋白结构示意图
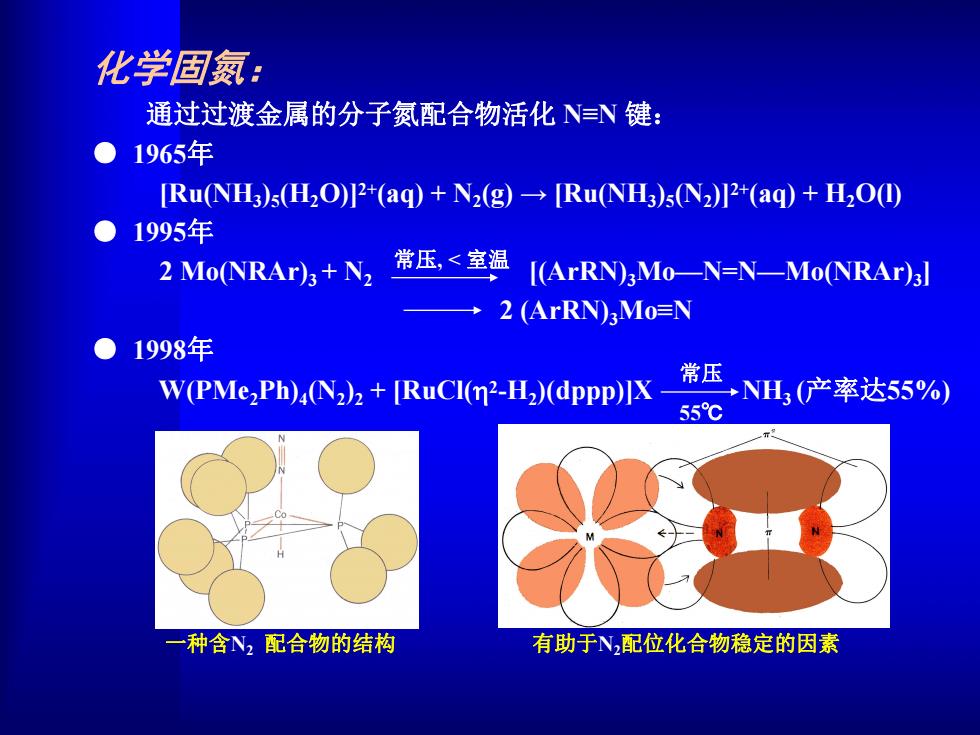
化学固氮: 通过过渡金属的分子氮配合物活化NN键: 1965年 [Ru(NH3)s(H2O)+(aq)+N2(g)[Ru(NH3)5(N2)]2+(aq)+H2O(I) 1995年 2 Mo(NRAr)3+N2 常压,<室温 [(ArRN)aMo-N=N-Mo(NRAr)3] →2(ArRN3Mo=N 1998年 W(PMe2Ph)4(N2)2+[RuCI(n2-H2)(dppp)]X 常压 NH3产率达55% 55℃ 一种含N2配合物的结构 有助于N配位化合物稳定的因素
化学固氮: 通过过渡金属的分子氮配合物活化 N≡N 键: ● 1965年 [Ru(NH3)5(H2O)] 2+(aq) + N2(g) → [Ru(NH3)5(N2)] 2+(aq) + H2O(l) ● 1995年 2 Mo(NRAr)3 + N2 [(ArRN)3Mo—N=N—Mo(NRAr)3] 2 (ArRN)3Mo≡N ● 1998年 W(PMe2Ph)4(N2)2 + [RuCl(2-H2)(dppp)]X NH3 (产率达55%) 常压 55℃ 常压, < 室温 一种含N2 配合物的结构 有助于N2配位化合物稳定的因素