
第一章酸碱化学 1.元素在周期表中的酸碱性 2.酸碱质子理论和酸碱概念的相对性 3.Lewis酸碱 4.软硬酸碱
第一章 酸碱化学 1. 元素在周期表中的酸碱性 2. 酸碱质子理论和酸碱概念的相对性 3. Lewis酸碱 4. 软硬酸碱
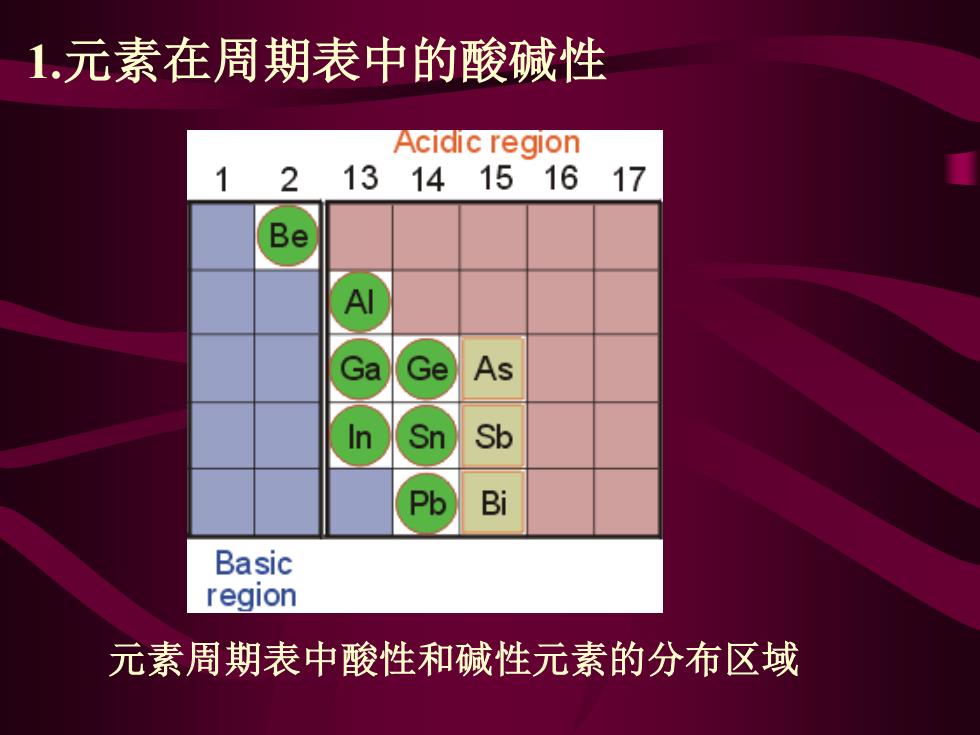
1.元素在周期表中的酸碱性 Acidic region 1 2 1314151617 Be Ga Ge As In Sn Sb Pb Bi Basic region 元素周期表中酸性和碱性元素的分布区域
元素周期表中酸性和碱性元素的分布区域 1.元素在周期表中的酸碱性
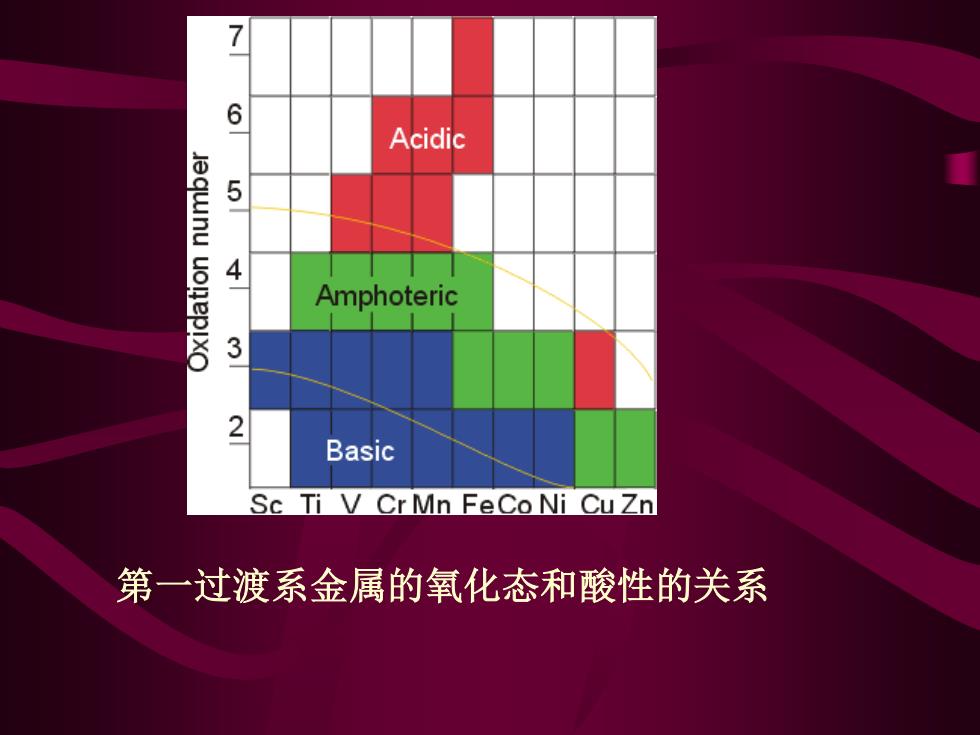
7 6 Acidic 5- Amphoteric 3 2 Basic Sc Ti V Cr Mn FeCo Ni CuZn 第一过渡系金属的氧化态和酸性的关系
第一过渡系金属的氧化态和酸性的关系

2.酸碱概念的相对性 醋酸为碱: CH COOH+H2SO4〉 CH COOH2*+HSO 醋酸为酸:CH COOH+H2O H,O++CHCOO
2. 酸碱概念的相对性 醋酸为碱: CH3COOH +H2SO4 ⎯→ CH3COOH2 ++ HSO4 − 醋酸为酸: CH3COOH + H2O ⎯→ H3O+ + CH3COO−
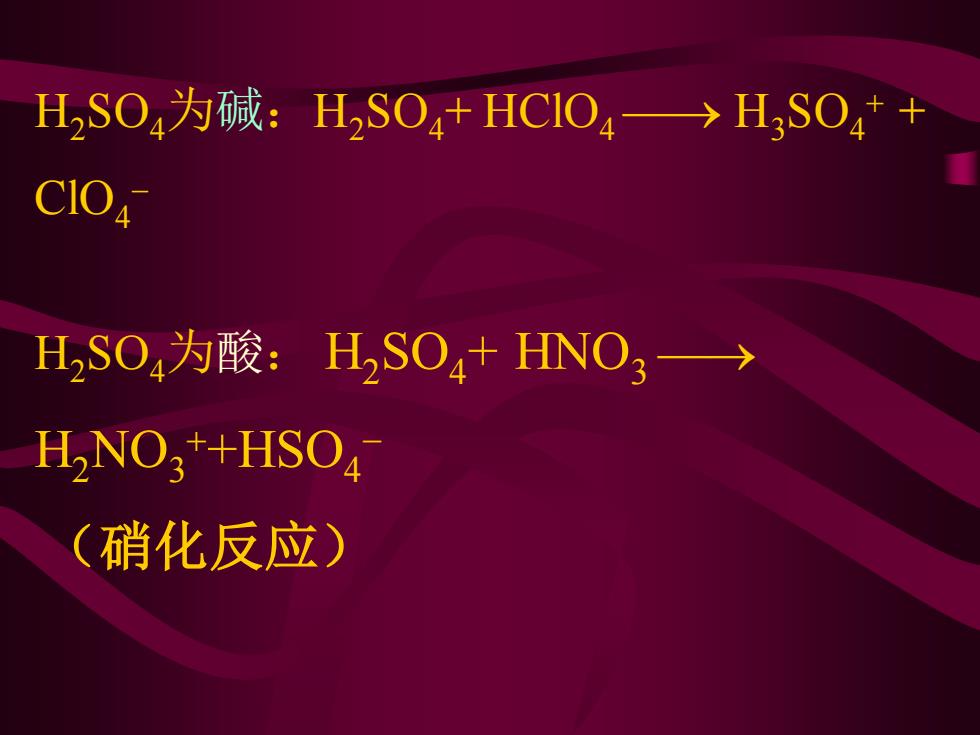
HSO4为碱:H2SO4+HCO4→>H,SO4+ CIO H2SO4为酸:H2SO4+HNO3) H2NO3+HSO4 (硝化反应)
H2SO4为碱:H2SO4+ HClO4 ⎯→ H3SO4 + + ClO4 − H2SO4为酸: H2 SO4 + HNO3 ⎯→ H2NO3 ++HSO4 − (硝化反应)

溶剂的拉平效应(leveling effect) HI+H20->H30++I- HBr+H20→H0++Br HI和Br均被拉平为H,O+,在水溶液中 不能区分HI和HBr的强弱
溶剂的拉平效应(leveling effect) HI+H2 O ⎯→ H3 O++I − HBr+H2 O ⎯→ H3 O++Br− HI和HBr均被拉平为H3 O+ ,在水溶液中 不能区分HI和HBr的强弱
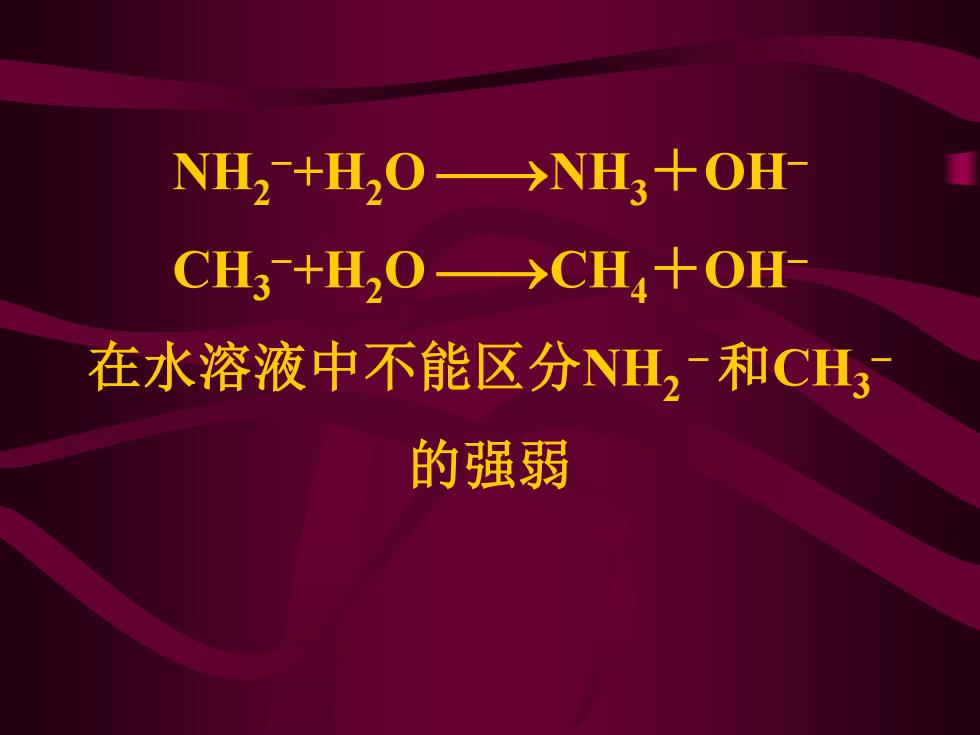
NH2+H2O→NH3+OH CH3+H2O→CH4+OH 在水溶液中不能区分NH2和CH3 的强弱
NH2 −+H2O ⎯→NH3+OH− CH3 −+H2O ⎯→CH4+OH− 在水溶液中不能区分NH2 −和CH3 − 的强弱

水中 K>1的酸,都被水拉平; 而pK。>14的共轭碱也被水拉平 pK在0到14不能被拉平之间 水的分辨宽度为14 液氨中 2NH3—NH2+NH4+】 K=33 液氨的分辨宽度为33
水中 Ka >1的酸,都被水拉平; 而pKa >14的共轭碱也被水拉平 pKa在0到14不能被拉平之间 水的分辨宽度为14 液氨中 2NH3⎯⎯ NH− 2 + NH4 + pK=33 液氨的分辨宽度为33

Fluorosulfuric acid Hydrofluoric acid Sulfuric acid Formic acid Acetic acid Ethanol Water DMSO Ammonia -20 -10 0 10 20 30 40 Effective pH in water 常用溶剂的分辨宽度
常用溶剂的分辨宽度
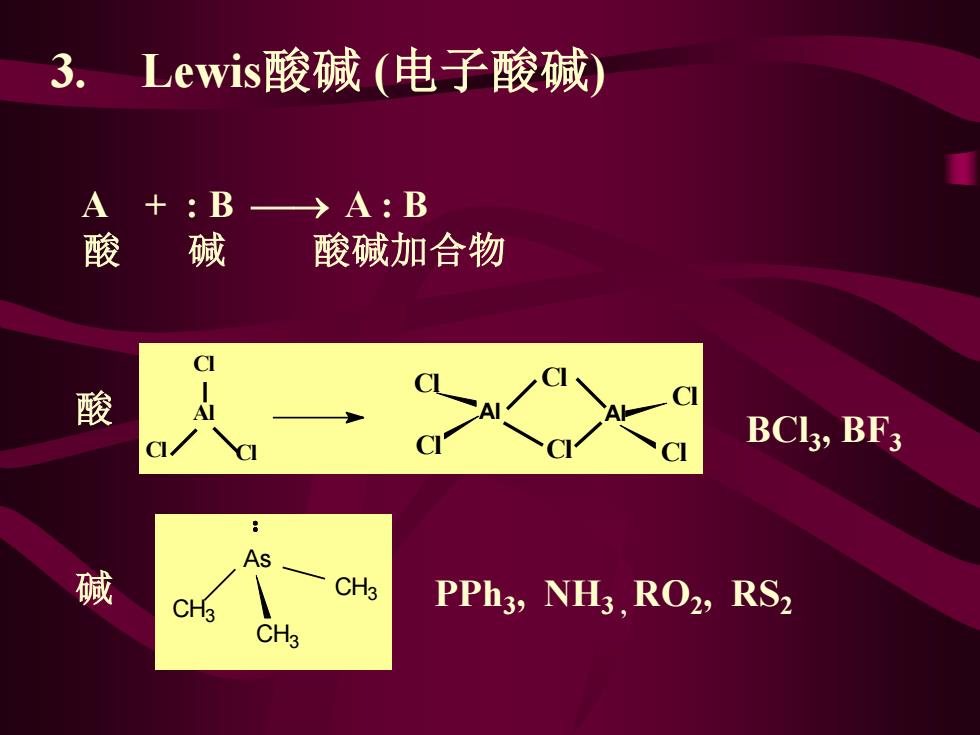
3.Lewis酸碱(电子酸碱) A+:B→A:B 酸碱 酸碱加合物 CI 酸 C BCl3,BF3 As 碱 CH3 PPh3,NH3.RO2,RS2 CH3
3. Lewis酸碱 (电子酸碱) A + : B ⎯→ A : B 酸 碱 酸碱加合物 As CH3 CH3 CH3 Al Al Cl Cl Cl Cl Cl Cl Al Cl Cl Cl BCl3 , BF3 PPh3 , NH3 , RO2 , RS2 酸 碱