
第六章配位化合物 [引言]配位化合物的存在范围极为广泛,在生产生活 中起着重要作用。对它的研究,形成了无机化学的 一个重要分支学科一配位化学。并成为引人瞩目 的化学领域之一。 第一节配位化合物的组成和命名 、配合物定义:中心元素与可给出电子对或多个不定域电子 的物种以配位键形成的化合物。 二、组成:一般情况下,由外界和内界组成。 1.内界:由中心元素与配位体以配位键组成的单元。 2.外界:其它部分。 3.中心元素:又称配合物形成体,为价层有空轨道的原子或离子 4.配位体:含有孤电子对或π电子的物种。 配位原子:配位体中与中心元素直接键合的原子。 5.配位数:直接与中心元素直接键合的配位原子的数目
第六章 配位化合物 [引言]配位化合物的存在范围极为广泛,在生产生活 中起着重要作用。对它的研究,形成了无机化学的 一个重要分支学科——配位化学。并成为引人瞩目 的化学领域之一。 第一节 配位化合物的组成和命名 一、配合物定义:中心元素与可给出电子对或多个不定域电子 的物种以配位键形成的化合物。 二、组成:一般情况下,由外界和内界组成。 1.内界:由中心元素与配位体以配位键组成的单元。 2.外界:其它部分。 3.中心元素:又称配合物形成体,为价层有空轨道的原子或离子 4.配位体:含有孤电子对或π电子的物种。 配位原子:配位体中与中心元素直接键合的原子。 5.配位数:直接与中心元素直接键合的配位原子的数目

三、配合物的命名(自学) 符合一般无机物命名原则。 1、总顺序: 配体数目(大写),配体名称,“合”,中心元素名(氧化 态) 多配体间用“,”分开 2.多配体命名顺序: ①无机配体在前,有机配体在后; ②阴离子配体在前,阳离子、中性配体随后; ③同类配体:按配位原子符号的英文字母顺序排列: 若配位原子也相同,少原子数配体在前;若原子数 亦同,则按其结构式中与配位原子相连原子的符号
三、配合物的命名(自学) 符合一般无机物命名原则。 1、总顺序: 配体数目(大写),配体名称, “合” ,中心元素名(氧化 态) 多配体间用“·”分开 2.多配体命名顺序: ①无机配体在前,有机配体在后; ②阴离子配体在前,阳离子、中性配体随后; ③同类配体:按配位原子符号的英文字母顺序排列; 若配位原子也相同,少原子数配体在前;若原子数 亦同,则按其结构式中与配位原子相连原子的符号 英文字母顺序排列

第二节配位化合物的结构 、 价键理论—一VB法应用 Ag (NHs)2"Zn (NHa)42 FeF63- Fe(CN)。3 1.外轨型和内轨型配合物。 2.低自旋和高自旋配合物。 3.中心元素的杂化类型与其电子层结构和配体中配位原子的电 负性有关。 “般配位原子的电负性值小,易给出电子对,对中心元素的 结构影响较大,可能发生重排。 4.配位数规律: 中心元素电荷+1+2 +3 +4 常见配位数 24(6) 6(4)6(8) 5.几何异构、旋光异构 不同配体在中心元素周围空间排列位置不同产生的异构现象
第二节 配位化合物的结构 一、价键理论——VB法应用 Ag(NH3)2 + Zn(NH3)4 2+ FeF6 3- Fe(CN)6 3- 1.外轨型和内轨型配合物。 2.低自旋和高自旋配合物。 3.中心元素的杂化类型与其电子层结构和配体中配位原子的电 负性有关。 一般 配位原子的电负性值小,易给出电子对,对中心元素的 结构影响较大,可能发生重排。 4.配位数规律: 中心元素电荷 +1 +2 +3 +4 常见配位数 2 4(6) 6(4) 6(8) 5.几何异构、旋光异构 不同配体在中心元素周围空间排列位置不同产生的异构现象

H:N H:N HN NH3 顺式 反式 小结:VB法对配合物的几何构型分析较直观和满意,但不能说 明其颜色、稳定性与d电子的关系。 第三节配合物的晶体场理论(了解) 立论:配体对中心元素的结构发生影响,简并的d轨道发生分裂 一、d轨道能级的分裂 八面体场中d轨道的分裂 二、分裂能及影响因素 分裂后最高d轨道与最低d轨道之间的能量差。 分裂能与中心元素的电荷和配体的性质等有关。P92
顺式 反式 小结:VB法对配合物的几何构型分析较直观和满意,但不能说 明其颜色、稳定性与d电子的关系。 第三节 配合物的晶体场理论(了解) 立论:配体对中心元素的结构发生影响,简并的d轨道发生分裂 一、d轨道能级的分裂 八面体场中d轨道的分裂 二、分裂能及影响因素 分裂后最高d轨道与最低d轨道之间的能量差。 分裂能与中心元素的电荷和配体的性质等有关。P92 H3 N Cl Cl NH3 Pt H3 N Cl H3 N Cl Pt
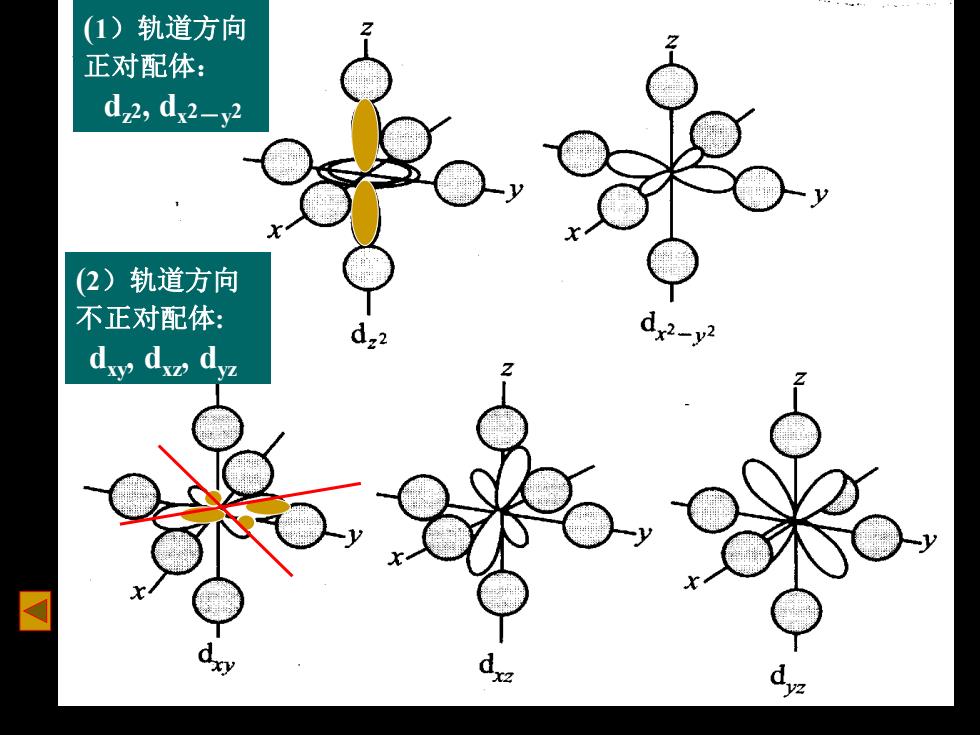
(1)轨道方向 正对配体: d2,d2-y2 (2)轨道方向 不正对配体: d.2 d2-y2 dy d dyz
(1)轨道方向 正对配体: dz2, dx2-y2 (2)轨道方向 不正对配体: dxy, dxz, dyz
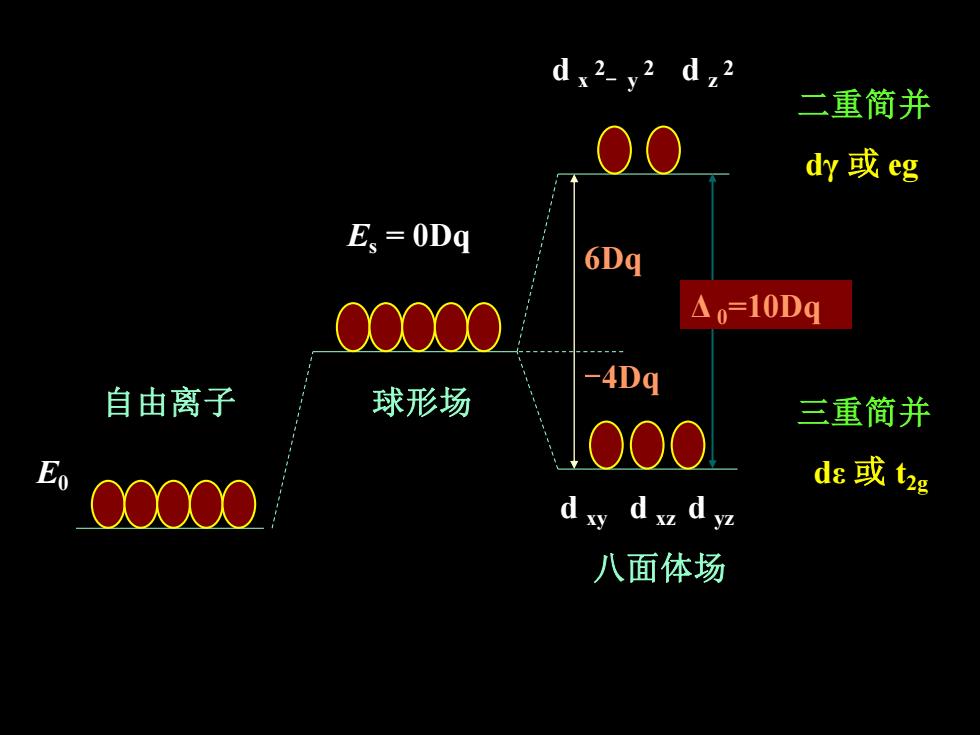
d,2 二重简并 O dy或eg Es =0Dg 6Dq △=10Dq -4Dq 自由离子 球形场 三重简并 000 00000 de或t2g dxy dxz dyz 八面体场
二重简并 dγ 或 eg 三重简并 dε 或 t E0 2g 6Dq -4Dq d x 2 - y 2 d z 2 d xy d xz d yz 自由离子 Es = 0Dq 球形场 八面体场 Δ 0=10Dq

三、电子排布与高、低自旋 中心元素电子的排布遵循原子结构电子排布原理,并受分裂 能的影响。 d4~?则可能有两种排布方式,究竟是高自旋或是低自旋,主 要取决于电子成对能与分裂能△的相对大小。 p主要由中心元素确定;△主要与配体有关。 四、晶体场稳定化能CFSE d电子在分裂后的d道中重新分布,导致体系总能量下降,体 系总能量(比球形对称场)的降低值。 它与d电子数和晶体场的强弱有关。 五、应用一对颜色的解释 d-d跃迁。因此d~9配离子有色;d0、d0配离子无色
三、电子排布与高、低自旋 中心元素d电子的排布遵循原子结构电子排布原理,并受分裂 能的影响。 d 4~7 则可能有两种排布方式,究竟是高自旋或是低自旋,主 要取决于电子成对能P与分裂能△的相对大小。 p主要由中心元素确定; △主要与配体有关。 四、晶体场稳定化能CFSE d电子在分裂后的d轨道中重新分布,导致体系总能量下降,体 系总能量(比球形对称场)的降低值。 它与d电子数和晶体场的强弱有关。 五、应用——对颜色的解释 d-d跃迁。因此d 1~9配离子有色;d 0 、d 10配离子无色

第四节配位平衡 一、配位平衡及其平衡常数 K不稳、K稳 意义:表征配合物在水中离解程度的大小。 二、逐级常数 与多元弱电解质一样,配合物的离解或配位也是分步的 规律:1.K稳K稳1K稳2K稳3 2.K1>K2>K3但各级常数相差不大 三、应用一有关计算 例:使0.1 mol AgCl溶于1LNH溶液中,问NH3的浓度 应为多少?
第四节 配位平衡 一、配位平衡及其平衡常数 K不稳、 K稳 意义:表征配合物在水中离解程度的大小。 二、逐级常数 与多元弱电解质一样,配合物的离解或配位也是分步的 规律: 1. K稳=K稳1 K稳2 K稳3 2. K1>K2>K3 但各级常数相差不大 三、应用——有关计算 例:使0.1mol AgCl溶于1L NH3溶液中,问NH3的浓度 应为多少?