
第十四章卤素 Chapter 14 Halogen
第十四章 卤素 Chapter 14 Halogen
H Be He Mg S Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Sr Y Zr Nb Mo Te Ru Rh Pd Ag Cd In Sn Sb Te Ba H Ta W Re Os Ir Pt Au Hg TI Pb Ne : Bh Hs 111 112 dblock La Ce Pr Nd Pm Sm Eu Gd Th Dy Ho Er Tm Yb Lu Al Ar Ar Th Pa U Np Pu Am Cm Bk Cr Es Fm Md No Lr Ga Br Kr 卤素在周期表 Xe 中的位置 TI Pb Bi Po At Rn 114 116 118 pblock
卤素在周期表 中的位置

本章教学要求 1. 掌握卤素单质、氢化物、含氧酸及其盐的结构、 性质、制备和用途: 2.掌握元素电势图并用以判断卤素及其化合物的氧化 还原性以及它们之间的重点元素硫、卤素的单质及 它们之间的相互转化关系
本章教学要求 1.掌握卤素单质、氢化物、含氧酸及其盐的结构、 性质、制备和用途; 2. 掌握元素电势图并用 以判断卤素及其化合物的氧化 还原性以及它们之间的重点元素硫、卤素的单质及 它们之间的相互转化关系

14.1 卤素的通性 本章内容 14.2 卤素单质 14.3 氟氯溴碘的化合物 11.4 砹的化学(不要求)
14.1 卤素的通性 14.2 卤素单质 14.3 氟氯溴碘的化合物 11.4 砹的化学(不要求)
14.1卤素的通性 14.1.1卤素原子的物理性质 第16/WⅥ至第18/Ⅷ族元素的某些性质 元素 I/kJ-mol-1 x* 共价半径pm 离子半径*pm 部分氧化态 0 1320 3.44 73 124 -2,-1,0,+1,+2 1005 2.44 102 170 -2,0,+4,+6 947 2.55 117 -2,0,+4,+6 184 Te -2,0,+4,+6 875 2.10 135 207 Po -2,0,+2,+4,+6 F 1687 3.98 117 -1,0 CI 1257 3.16 167 -1,0,+1,+3,+5,+7 Br 1146 2.96 182 -1,0,+1,+3,+5,+7 1015 2.66 206 -1,0,+1,+3,+5,+7 At He 2378 0 Ne 2087 Ar 1527 Kr 0 1357 Xe 0,+2 1177 Rn 2.6 0,+2,+4,+6,+8 1043 鲍林电负性 *氧族元素的2半径,】 卤族元素的E半径
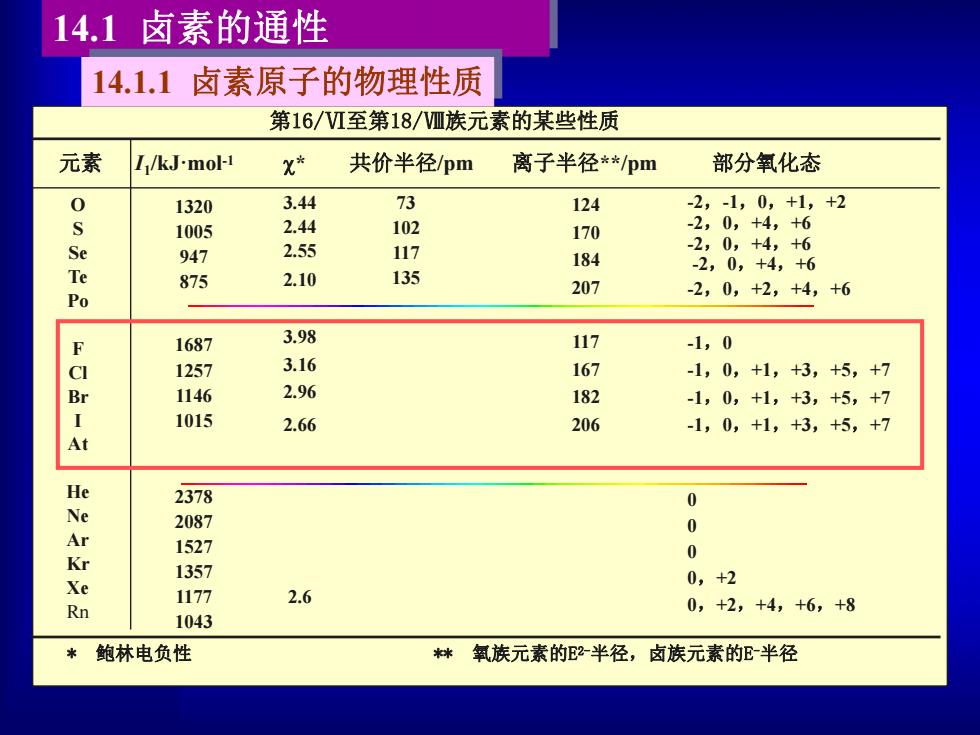
14.1 卤素的通性 第16/Ⅵ至第18/Ⅷ族元素的某些性质 元素 I1 /kJ·mol -1 * 共价半径/pm 离子半径**/pm 部分氧化态 O S Se Te Po F Cl Br I At He Ne Ar Kr Xe Rn 1320 1005 947 875 1687 1257 1146 1015 2378 2087 1527 1357 1177 1043 3.44 2.44 2.55 2.10 3.98 3.16 2.96 2.66 2.6 73 102 117 135 124 170 184 207 117 167 182 206 -2,-1,0,+1,+2 -2,0,+4,+6 -2,0,+4,+6 -2,0,+4,+6 -2,0,+2,+4,+6 -1,0 -1,0,+1,+3,+5,+7 -1,0,+1,+3,+5,+7 -1,0,+1,+3,+5,+7 0 0 0 0,+2 0,+2,+4,+6,+8 * 鲍林电负性 ** 氧族元素的E2-半径,卤族元素的E-半径 14.1.1 卤素原子的物理性质

从上表可见: (1)卤素是典型的非金属元素; (2)卤素具有丰富的氧化还原化学特征: 。一方面指元素本身能形成多种氧化态的事实 。另一方面指可使其他元素达到通常难以达到的氧化态: F可以稳定元素的高氧化态:VFs、MoF和ReF, 3)氟化学的研究导致稀有气体化合物的发现
(1) 卤素是典型的非金属元素; (2) 卤素具有丰富的氧化还原化学特征: ●一方面指元素本身能形成多种氧化态的事实 ●另一方面指可使其他元素达到通常难以达到的氧化态: F- 可以稳定元素的高氧化态:VF5、MoF6和ReF7 (3) 氟化学的研究导致稀有气体化合物的发现。 从上表可见:

14.1.2 卤素的存在 卤素主要以卤化物形式存在于自然界.氟的资源是CaF2(荧石) 、冰晶石和磷灰石;氯、溴是海水和盐湖卤水;碘是碘酸盐沉积,主 要是智利硝石 萤石 冰晶石 智利硝石 CaF2 3NaF.AlF3 NalO3 14.1.3卤素的电势图 (自学)
14.1.2 卤素的存在 卤素主要以卤化物形式存在于自然界. 氟的资源是 CaF2(荧石) 、冰晶石和磷灰石;氯、溴是海水和盐湖卤水;碘是碘酸盐沉积,主 要是智利硝石. 萤石 CaF2 冰晶石 3NaF.AlF3 智利硝石 NaIO3 14.1.3 卤素的电势图 (自学)
14.2卤素单质 2233 193 14.2.1卤素单质的物理性质 159 151 F C Br2 室温聚集态 g g 分子间力 小 大 b.p./℃ -188 34.5 59 183 F2 Br m.p./℃ -220 -101 -7.3 升华 颜色 卤素分子中键的离解能(kJmo) 无色(浅黄) 黄绿 红棕 紫色 共价半径pm 58 99 114 133 45 单 电负性 4.00 3.00 2.80 2.50 电子亲和能/kJmo1 334 355 325 295 质 的 共价半 电 熔 负 沸 径 性 点
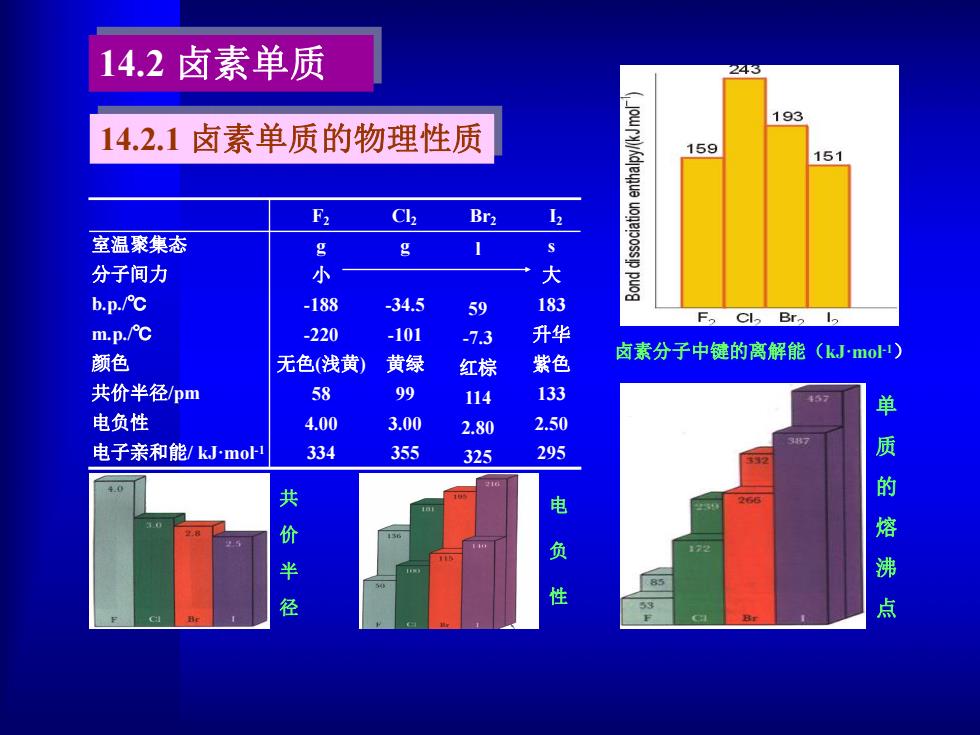
F2 Cl2 Br2 I2 室温聚集态 分子间力 b.p./℃ m.p./℃ 颜色 共价半径/pm 电负性 电子亲和能/ kJ·mol -1 g 小 -188 -220 无色(浅黄) 58 4.00 334 g -34.5 -101 黄绿 99 3.00 355 l 59 -7.3 红棕 114 2.80 325 s 大 183 升华 紫色 133 2.50 295 卤素分子中键的离解能(kJ·mol -1) 单 质 的 熔 沸 点 电 负 性 共 价 半 径 14.2.1 卤素单质的物理性质 14.2 卤素单质
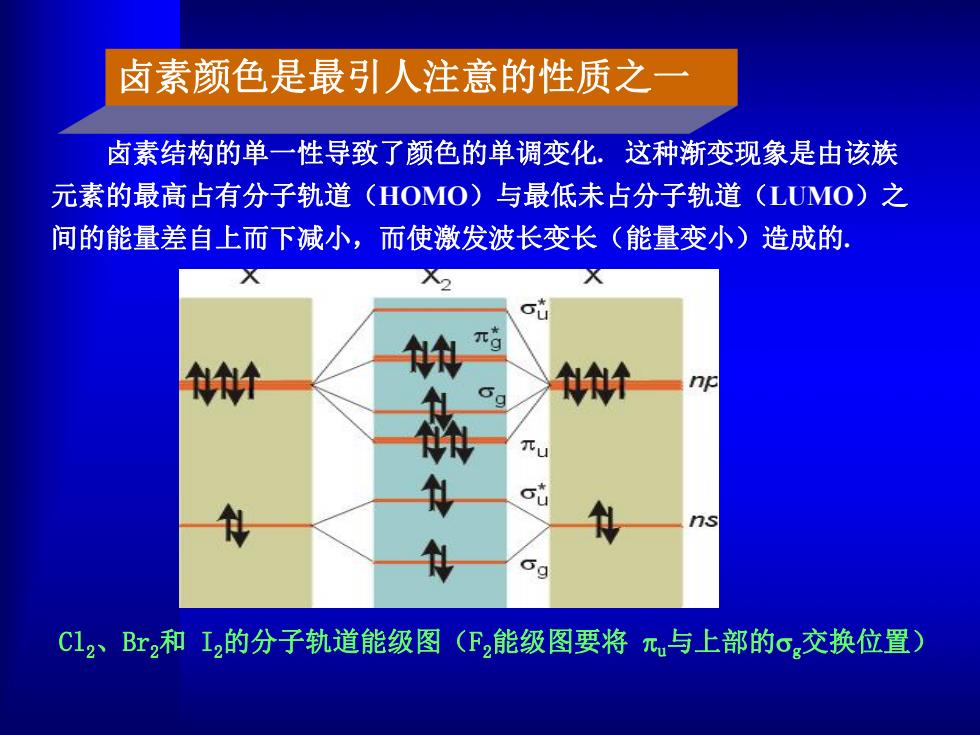
卤素颜色是最引人注意的性质之一 卤素结构的单一性导致了颜色的单调变化.这种渐变现象是由该族 元素的最高占有分子轨道(HOMO)与最低未占分子轨道(LUMO)之 间的能量差自上而下减小,而使激发波长变长(能量变小)造成的. 针 快 g 计 np 门S C12、Br2和I2的分子轨道能级图(F2能级图要将元与上部的o交换位置
卤素结构的单一性导致了颜色的单调变化. 这种渐变现象是由该族 元素的最高占有分子轨道(HOMO)与最低未占分子轨道(LUMO)之 间的能量差自上而下减小,而使激发波长变长(能量变小)造成的. Cl2、Br2和 I2的分子轨道能级图(F2能级图要将 u与上部的g交换位置) 卤素颜色是最引人注意的性质之一
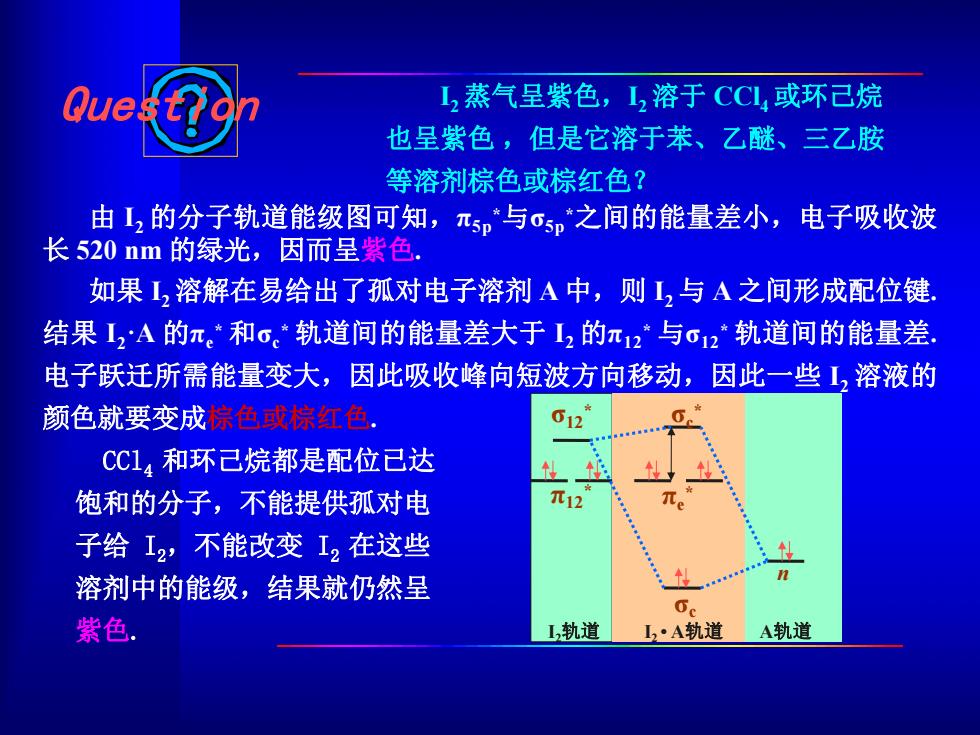
Que L,蒸气呈紫色,L,溶于CCL或环已烷 也呈紫色,但是它溶于苯、乙醚、三乙胺 等溶剂棕色或棕红色? 由2的分子轨道能级图可知,元5p与@5p之间的能量差小,电子吸收波 长520nm的绿光,因而呈紫色. 如果1,溶解在易给出了孤对电子溶剂A中,则L,与A之间形成配位键 结果I2A的π。*和o。轨道间的能量差大于I2的π12与c2轨道间的能量差 电子跃迁所需能量变大,因此吸收峰向短波方向移动,因此一些1,溶液的 颜色就要变成棕色或棕红色 012 CC14和环己烷都是配位已达 饱和的分子,不能提供孤对电 元12 子给I2,不能改变I2在这些 n 溶剂中的能级,结果就仍然呈 6 紫色. L,轨道 L2·A轨道 A轨道
由 I2 的分子轨道能级图可知,π5p *与σ5p *之间的能量差小,电子吸收波 长 520 nm 的绿光,因而呈紫色. 如果 I2 溶解在易给出了孤对电子溶剂 A 中,则 I2 与 A 之间形成配位键. 结果 I2·A 的πe * 和σc * 轨道间的能量差大于 I2 的π12 * 与σ12 * 轨道间的能量差. 电子跃迁所需能量变大,因此吸收峰向短波方向移动,因此一些 I2 溶液的 颜色就要变成棕色或棕红色. CCl4 和环己烷都是配位已达 饱和的分子,不能提供孤对电 子给 I2,不能改变 I2 在这些 溶剂中的能级,结果就仍然呈 紫色. Question I2蒸气呈紫色,I2溶于 CCl4或环己烷 也呈紫色 ,但是它溶于苯、乙醚、三乙胺 等溶剂棕色或棕红色? σ12 * π12 * σc * πe * σc n I2轨道 I2 • A轨道 A轨道