
第十五拿 氧族元素 Chapter 15 Oxygen family element
第十五章 氧族元素 Chapter 15 Oxygen family element
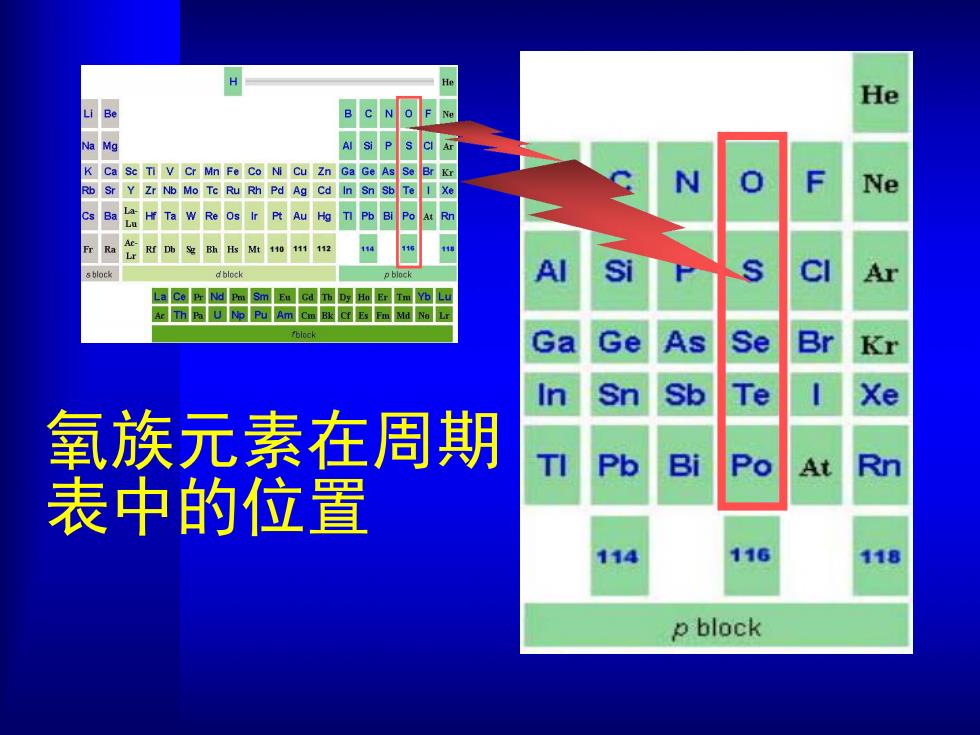
He Be B C N O F K Ma Ca Sc TI V Cr Mn Fe Co Ni Cu Zn Ga Ge Se Sr Y Zr N Mo Tc Ru Rh Pd Ag Cd In Sn N 0 Ne Po sblock dhlock Al Si Ar La Ce Pr Nd Pm Sm Eu Gd Th Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md Ne Lr Ga Se Br K Sb Te Xe 氧族元素在周期 Pb Bi Po At Rn 表中的位置 114 116 118 p block
氧族元素在周期 表中的位置

本章教学要求 了解氧化物的分类; 2.掌握氧、臭氧、过氧化氢的结构、性质和用途; 3.掌握硫的成键特征及多种氧化态所形成的重要物种的 结构、性质、制备和用途,以及它们之间的相互转化 关系
本章教学要求 1.了解氧化物的分类; 2.掌握氧、臭氧、过氧化氢的结构、性质和用途; 3. 掌握硫的成键特征及多种氧化态所形成的重要物种的 结构、性质、制备和用途,以及它们之间的相互转化 关系

15.1 氧族元素的通性 本章内容 15.2 氧及其化合物 Oxygen and it's some important compounds 15.3 硫及其化合物 Sulfur and it's some important compounds 15.4硒和碲(不要求) Selenium and Tellurium
15.1 氧族元素的通性 15.2 氧及其化合物 Oxygen and it’s some important compounds 15.3 硫及其化合物 Sulfur and it’ s some important compounds 15.4 硒和碲 (不要求) Selenium and Tellurium

15.1氧族元素通性 15.1.1氧族存在 氧是地球上含量最多的元素,它是燃烧和 呼吸不可缺少的气体。 硫史前就为人们所知,炼丹术的方士们称 它为“黄芽”。 硒和碲是分散的稀有元素,典型的半导体 材料。 钋为放射性元素,半衰期为138.38天
15.1 氧族元素通性 15.1.1 氧族存在 氧是地球上含量最多的元素,它是燃烧和 呼吸不可缺少的气体。 硫史前就为人们所知,炼丹术的方士们称 它为“黄芽” 。 硒和碲是分散的稀有元素,典型的半导体 材料。 钋为放射性元素,半衰期为138.38天
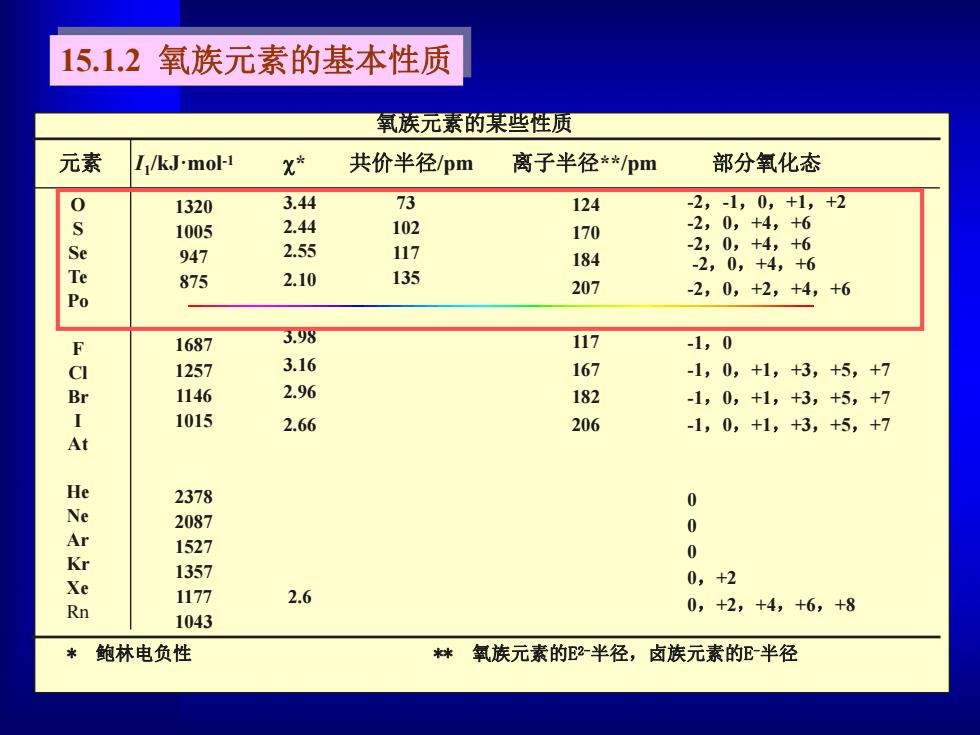
15.1.2氧族元素的基本性质 氧族元素的某些性质 元素 I/kJ-mol-1 x* 共价半径pm 离子半径*pm 部分氧化态 0 1320 3.44 73 124 -2,-1,0,+1,+2 1005 2.44 102 170 -2,0,+4,+6 e -2,0,+4,+6 947 2.55 117 184 -2,0,+4,+6 875 2.10 135 207 Po -2,0,+2,+4,+6 F 1687 3.98 117 -1,0 CI 1257 3.16 167 -1,0,+1,+3,+5,+7 Br 1146 2.96 182 -1,0,+1,+3,+5,+7 1015 2.66 206 -1,0,+1,+3,+5,+7 At He 2378 0 Ne 2087 Ar 0 1527 Kr 0 1357 Xe 0,+2 1177 2.6 Rn 0,+2,+4,+6,+8 1043 鲍林电负性 氧族元素的2半径,卤族元素的E半径
氧族元素的某些性质 元素 I1 /kJ·mol -1 * 共价半径/pm 离子半径**/pm 部分氧化态 O S Se Te Po F Cl Br I At He Ne Ar Kr Xe Rn 1320 1005 947 875 1687 1257 1146 1015 2378 2087 1527 1357 1177 1043 3.44 2.44 2.55 2.10 3.98 3.16 2.96 2.66 2.6 73 102 117 135 124 170 184 207 117 167 182 206 -2,-1,0,+1,+2 -2,0,+4,+6 -2,0,+4,+6 -2,0,+4,+6 -2,0,+2,+4,+6 -1,0 -1,0,+1,+3,+5,+7 -1,0,+1,+3,+5,+7 -1,0,+1,+3,+5,+7 0 0 0 0,+2 0,+2,+4,+6,+8 * 鲍林电负性 ** 氧族元素的E2-半径,卤族元素的E-半径 15.1.2 氧族元素的基本性质

从上表可见: (1)氧族元素从非金属向金属过渡; (2)氧族元素有丰富的氧化还原化学特征: ●一方面指元素本身能形成多种氧化态的事实 ●另一方面指可使其他元素达到通常难以达到的氧化态: O可以稳定元素的高氧化态:FeO4、MnO, 15.1.3氧族元素的电势图 (自学)
(1) 氧族元素从非金属向金属过渡; (2) 氧族元素有丰富的氧化还原化学特征: ●一方面指元素本身能形成多种氧化态的事实 ●另一方面指可使其他元素达到通常难以达到的氧化态: O 可以稳定元素的高氧化态:Fe3O4、MnO4 - 从上表可见: 15.1.3 氧族元素的电势图 (自学)
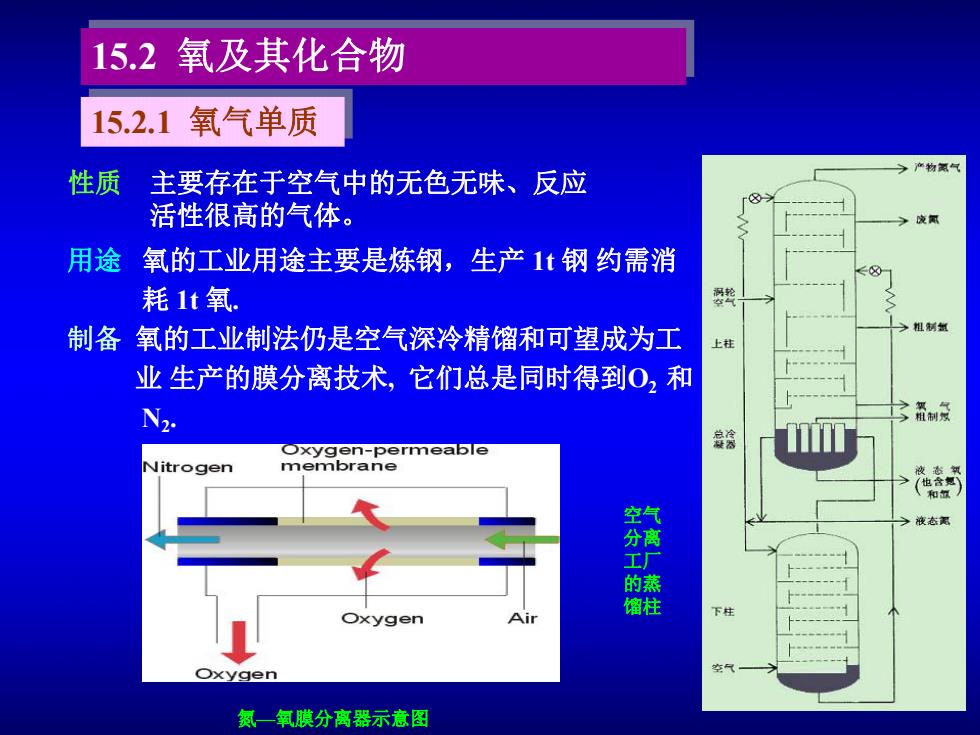
15.2氧及其化合物 15.2.1氧气单质 年物氨气 性质 主要存在于空气中的无色无味、反应 活性很高的气体。 用途 氧的工业用途主要是炼钢,生产1t钢约需消 耗1t氧. 奖 制备氧的工业制法仍是空气深冷精馏和可望成为工 上柱 业生产的膜分离技术,它们总是同时得到O2和 N 3备制效 ○xygen-permeable 盘涂 Nitrogen membrane 液数飘 和饭 今液态需 馏柱 下柱 xygen Oxygen 氮一氧膜分离器示意图
15.2 氧及其化合物 性质 主要存在于空气中的无色无味、反应 活性很高的气体。 用途 氧的工业用途主要是炼钢,生产 1t 钢 约需消 耗 1t 氧. 制备 氧的工业制法仍是空气深冷精馏和可望成为工 业 生产的膜分离技术, 它们总是同时得到O2 和 N2 . 氮—氧膜分离器示意图 空气 分离 工厂 的蒸 馏柱 15.2.1 氧气单质
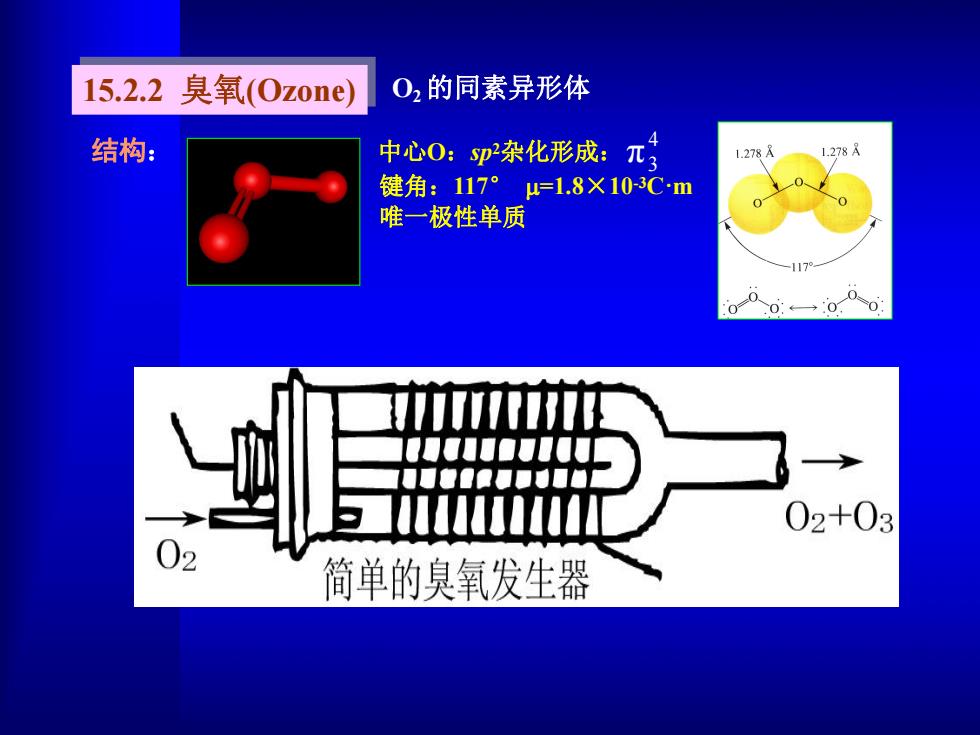
15.2.2臭氧(0z0ne 02的同素异形体 结构: 中心0:p泰化形成:元 1.278 1.278A 键角:117°=1.8X10-3Cm 唯一极性单质 -117 0 0←→0 02+03 )2 简单的臭氧发生器
结构: 中心O:sp 2杂化形成: 键角:117° =1.8×10 -3C·m 唯一极性单质 15.2.2 臭氧(Ozone) 4 π3 O2的同素异形体

性质:(1)不稳定:203=302,△,G=326kJmo1 (2)氧化性:03+21+2H一12+02+H20 酸性:03+2H+2e一02+H20 9=2.07V 碱性:03+H20+2e一 02+20H9=1.20V ●臭氧可将某些难以氧化的单质和化合物氧化: 2Ag+203=Ag202+202,03+Xe03+2H20=HXe06+O2 ●臭氧能将迅速而定量地氧化至12,该反应被用来测定O3的含量: 03+2+H20=12+02+20H ·臭氧的氧化性被用于漂白、除臭、杀菌和处理含酚、苯等的工业废水。 处理电镀工业含CN废液时基于以下反应: O3+CN- OCN-+02 OCN-+03 C02+N2+02 ●金在O3作用下可以迅速溶解于HC1,O3还能从SO2的低浓度废气中 制H2S042Au+3O3+8HCI→2 HAuCI]+3O2+3H20
● 臭氧可将某些难以氧化的单质和化合物氧化: 2 Ag + 2 O3 Ag2O2 + 2 O2 , O3 + XeO3 + 2 H2O H4XeO6 + O2 ● 臭氧能将 I - 迅速而定量地氧化至 I2,该反应被用来测定 O3的含量: O3 + 2I - + H2O I2 + O2 + 2OH- ● 臭氧的氧化性被用于漂白、除臭、杀菌和处理含酚、苯等的工业废水。 处理电镀工业含 CN- 废液时基于以下反应: O3 + CN- OCN- + O2 OCN- + O3 CO2 + N2 + O2 ● 金在 O3作用下可以迅速溶解于 HCl,O3 还能从 SO2的低浓度废气中 制 H2SO4 . 2 Au + 3 O3 + 8 HCl → 2 H[AuCl4] + 3 O2 + 3 H2O 性质:⑴ 不稳定: 2 O3 3 O2 , △rGθ= -326 kJ•mol -1 ⑵ 氧化性:O3 + 2 I - + 2 H+ I2 + O2 + H2O 酸性:O3 + 2 H+ + 2e - O2 + H2O E = 2.07V 碱性:O3 + H2O + 2e - O2 + 2OH- E = 1.20V